高一化学开学第一课教学课件(共34张PPT)
文档属性
| 名称 | 高一化学开学第一课教学课件(共34张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 714.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-18 00:00:00 | ||
图片预览











文档简介
课件34张PPT。高 中 化 学
Senior School Chemistry《洛杉矶时报》报道,一种叫做“一氧化二氢”的“不明化学物”把加州亚里索维耶荷市搅了个鸡犬不宁。因为网上消息风传,人一旦大量接触“一氧化二氢”,就将引发人体严重的“医学问题”,甚至会“致人死亡”。一时间当地居民人人自危,市政府也火速出台法令,以控制“一氧化二氢”所可能带来的“致命危机”。所谓致命的“一氧化二氢”不过是水(H2O)而已。 化学Chemistry
化学是人类进步的关键。
(美国化学家西博格教授在1979年美国化学学会成立100周年大会上所做的精辟论述)
化学是一门研究物质的组成、结构、性质以及变化规律的科学。
高 中 化 学 Senior School Chemistry化学是一门很有魅力的学科 定位高中化学与初中化学相比有下述几方面的特点 ⒈概念抽象
⒉进度快,反应方程式复杂
3.内涵深,联系广
⒋抓典型,带一族 繁、难、乱氧化物酸性氧化物碱式氧化物两性氧化物不成盐氧化物由两种元素组成其中一种为氧元素的化合物特殊氧化物能与酸反应生成盐和水的氧化物能与碱反应生成盐和水的氧化物必 修 模 块化学与生活·选修1 化学与技术·选修2 物质结构与性质·选修3 化学反应原理·选修4 有机化学基础·选修5 实验化学·选修6 选 修 模 块学 习 要 求
—— 课前预习
—— 认真听课,学会巧记
(记笔记)
—— 独立按时完成课堂内外作业
(勤练、必交、错题本)
—— 善于提出问题
—— 及时复习(睡前几分钟)
立足:课堂听课、课后作业、
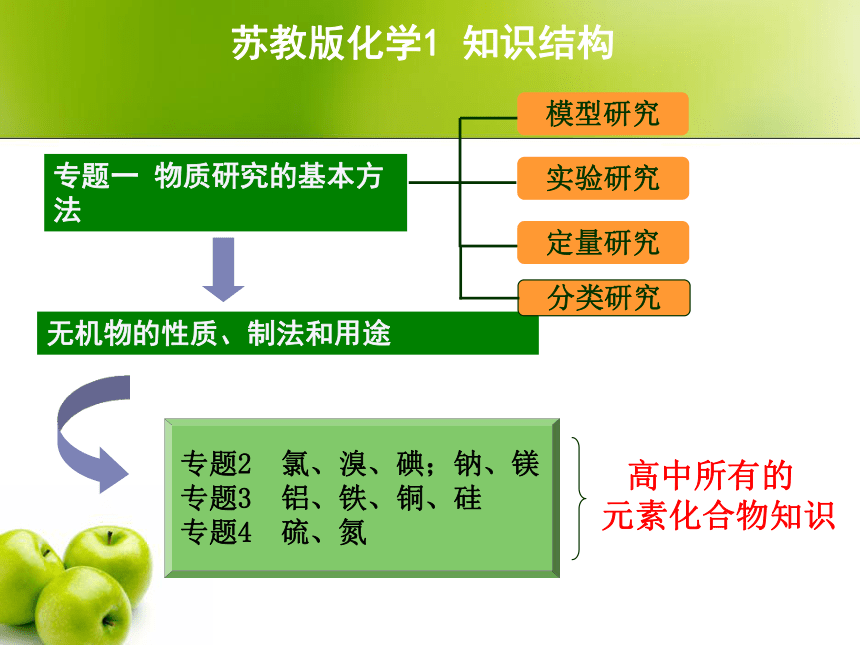
作业反馈、在校时间问题本化学1教材内容体系 (江苏教育出版社)苏教版化学1 知识结构专题一 物质研究的基本方 法§1-1-1 物质的分类及转化溶解度:
某温度下,100g水中最多能够溶解的溶质的质量单质:
同种元素构成的纯净物化合物:
不同种元素构成的纯净物一、物质的分类有机化合物:
含碳化合物(除CO、CO2、H2CO3、碳酸盐等外)氧化物酸性氧化物碱式氧化物两性氧化物不成盐氧化物由两种元素组成其中一种为氧元素的化合物特殊氧化物能与酸反应生成盐和水的氧化物能与碱反应生成盐和水的氧化物思考金属氧化物、非金属氧化物、酸性氧化物和碱性氧化物之间的关系?碱性氧化物 ______是金属氧化物
金属氧化物______是碱性氧化物
酸性氧化物______是非金属氧化物
非金属氧化物______是酸性氧化物一定不一定不一定不一定酸 在水溶液中阳离子只产生(电离)H+的化合物碱 在水溶液中阴离子只产生(电离) OH-的化合物盐 由金属离子(或NH4+)与酸根离子组成的化合物含氧酸盐无氧酸盐1、下列关于物质分类的正确组合是 练一练2、下列各组物质中,前者为混合物,后者为单质的是 A. Na2CO3·10H2O 、 石墨 B.碘酒、干冰
C. 石油、液氧 D.盐酸、水3、经测定,常温常压下的一瓶气体中只含有C、O两种元素,通常情况下这瓶气体不可能是 A、一种化合物 B、一种单质和一种化合物的混合物
C、两种化合物 D、两种单质4、航天技术测得三氧化二铁碳(C2O3)是金星大气层的成分之一,下列关于C2O3的说法错误的是 A.C2O3与CO2都是碳的氧化物
B.C2O3与CO2都是碳酸的酸酐
C.C2O3与CO都能与NaOH反应
D.C2O3与C的燃烧产物都是CO2二、物质的转化交流讨论CaO + H2O == Ca(OH)2CO2 + H2O == H2CO3NaOH + HCl == NaCl + H2O酸、碱、盐等物质的反应规律化学反应的分类1、根据反应物和生成物的类别(四大基本反应类型) 化合反应分解反应置换反应复分解反应化学反应的分类2、反应过程中元素化合价是否发生变化 氧化还原反应非氧化还原反应3CO + Fe2O3= 2Fe+ 3CO2Cl2 + H2O= HClO+ HCl1、标出下列物质中带线元素化合价 试一试NO Fe2O3 Mg3N2 CuCl2 Cu2O
NH3 CH4 MnCl2 MnO2 H2+2+3+2-3+2+1-3-4+2+4 02、划出下列物质中原子团,并标出原子团的化合价试一试NaOH Na2CO3 NH4Cl Al2(SO4)3
KMnO4 NaHCO3 K2MnO4 KClO3
Cu2(OH)2CO3 Na2O2 NaAlO2-1-2+1-2-1-1-2-1-2-1-2-11、3Fe+2O2 == Fe3O4 2、Na2O+H2O=2NaOH 3、CaCO3=CaO+CO2↑ 4、2KMnO4=K2MnO4+MnO2+O2 ↑ ΔΔ 判断下列反应中属于氧化还原反应的是______ ,属于非氧化还原反应的是______点燃5、Zn+H2SO4=ZnSO4+H2↑ 6、Zn+CuSO4=ZnSO4+Cu 7、CuO+2HCl=CuCl2+H2O 8、NaOH+HNO3=NaNO3+H2O√√√√氧化还原反应和四大基本反应类型的关系交流讨论※化合反应可能是氧化还原反应,一般说, 有单质参加的为氧化还原反应
※分解反应可能是氧化还原反应,一般说,有单质生成的为氧化还原反应
※置换反应全是氧化还原反应
※复分解反应一定不是氧化还原反应
氧化还原反应和四大基本反应类型的关系交流讨论单质参与单质生成 有单质参与或生成的反应一定是氧化还原反应?三、氧化还原反应2、特征 (判断依据)反应前后有元素化合价变化3、本质有电子的转移1、定义有化合价发生变化的反应 0 +1
0-1 有元素化合价升高的 ,叫做还原剂;
有元素化合价降低的 ,叫做氧化剂。还原剂被氧化;氧化剂被还原。还原剂氧化剂三、氧化还原反应氧化剂:得到电子(电子对偏向)
的物质
还原剂:失去电子(电子对偏离)
的物质 反应物4、重要概念氧化反应:物质失去电子的反应
还原反应:物质得到电子的反应被氧化被还原氧化产物:还原剂发生氧化反应后
的产物
还原产物:氧化剂发生还原反应后
的产物生成物5、氧化还原反应的分析方法 (1) 双线桥法——分析电子得失情况+4 0 +6 -1
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl 化合价降低,得2e—,被还原化合价升高,失2e—,被氧化(2)单线桥法——分析电子转移情况+4 0 +6 -1
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl 2e—氧化剂 + 还原剂 = 还原产物 + 氧化产物得ne-,化合价降低,被还原,还原反应失ne-,化合价升高,被氧化,氧化反应记录:
高 失 氧 (被氧化)
低 得 还 (被还原)
化学是人类进步的关键。
(美国化学家西博格教授在1979年美国化学学会成立100周年大会上所做的精辟论述)
化学是一门研究物质的组成、结构、性质以及变化规律的科学。
高 中 化 学 Senior School Chemistry化学是一门很有魅力的学科 定位高中化学与初中化学相比有下述几方面的特点 ⒈概念抽象
⒉进度快,反应方程式复杂
3.内涵深,联系广
⒋抓典型,带一族 繁、难、乱氧化物酸性氧化物碱式氧化物两性氧化物不成盐氧化物由两种元素组成其中一种为氧元素的化合物特殊氧化物能与酸反应生成盐和水的氧化物能与碱反应生成盐和水的氧化物必 修 模 块化学与生活·选修1 化学与技术·选修2 物质结构与性质·选修3 化学反应原理·选修4 有机化学基础·选修5 实验化学·选修6 选 修 模 块学 习 要 求
—— 课前预习
—— 认真听课,学会巧记
(记笔记)
—— 独立按时完成课堂内外作业
(勤练、必交、错题本)
—— 善于提出问题
—— 及时复习(睡前几分钟)
立足:课堂听课、课后作业、
作业反馈、在校时间问题本化学1教材内容体系 (江苏教育出版社)苏教版化学1 知识结构专题一 物质研究的基本方 法§1-1-1 物质的分类及转化溶解度:
某温度下,100g水中最多能够溶解的溶质的质量单质:
同种元素构成的纯净物化合物:
不同种元素构成的纯净物一、物质的分类有机化合物:
含碳化合物(除CO、CO2、H2CO3、碳酸盐等外)氧化物酸性氧化物碱式氧化物两性氧化物不成盐氧化物由两种元素组成其中一种为氧元素的化合物特殊氧化物能与酸反应生成盐和水的氧化物能与碱反应生成盐和水的氧化物思考金属氧化物、非金属氧化物、酸性氧化物和碱性氧化物之间的关系?碱性氧化物 ______是金属氧化物
金属氧化物______是碱性氧化物
酸性氧化物______是非金属氧化物
非金属氧化物______是酸性氧化物一定不一定不一定不一定酸 在水溶液中阳离子只产生(电离)H+的化合物碱 在水溶液中阴离子只产生(电离) OH-的化合物盐 由金属离子(或NH4+)与酸根离子组成的化合物含氧酸盐无氧酸盐1、下列关于物质分类的正确组合是 练一练2、下列各组物质中,前者为混合物,后者为单质的是 A. Na2CO3·10H2O 、 石墨 B.碘酒、干冰
C. 石油、液氧 D.盐酸、水3、经测定,常温常压下的一瓶气体中只含有C、O两种元素,通常情况下这瓶气体不可能是 A、一种化合物 B、一种单质和一种化合物的混合物
C、两种化合物 D、两种单质4、航天技术测得三氧化二铁碳(C2O3)是金星大气层的成分之一,下列关于C2O3的说法错误的是 A.C2O3与CO2都是碳的氧化物
B.C2O3与CO2都是碳酸的酸酐
C.C2O3与CO都能与NaOH反应
D.C2O3与C的燃烧产物都是CO2二、物质的转化交流讨论CaO + H2O == Ca(OH)2CO2 + H2O == H2CO3NaOH + HCl == NaCl + H2O酸、碱、盐等物质的反应规律化学反应的分类1、根据反应物和生成物的类别(四大基本反应类型) 化合反应分解反应置换反应复分解反应化学反应的分类2、反应过程中元素化合价是否发生变化 氧化还原反应非氧化还原反应3CO + Fe2O3= 2Fe+ 3CO2Cl2 + H2O= HClO+ HCl1、标出下列物质中带线元素化合价 试一试NO Fe2O3 Mg3N2 CuCl2 Cu2O
NH3 CH4 MnCl2 MnO2 H2+2+3+2-3+2+1-3-4+2+4 02、划出下列物质中原子团,并标出原子团的化合价试一试NaOH Na2CO3 NH4Cl Al2(SO4)3
KMnO4 NaHCO3 K2MnO4 KClO3
Cu2(OH)2CO3 Na2O2 NaAlO2-1-2+1-2-1-1-2-1-2-1-2-11、3Fe+2O2 == Fe3O4 2、Na2O+H2O=2NaOH 3、CaCO3=CaO+CO2↑ 4、2KMnO4=K2MnO4+MnO2+O2 ↑ ΔΔ 判断下列反应中属于氧化还原反应的是______ ,属于非氧化还原反应的是______点燃5、Zn+H2SO4=ZnSO4+H2↑ 6、Zn+CuSO4=ZnSO4+Cu 7、CuO+2HCl=CuCl2+H2O 8、NaOH+HNO3=NaNO3+H2O√√√√氧化还原反应和四大基本反应类型的关系交流讨论※化合反应可能是氧化还原反应,一般说, 有单质参加的为氧化还原反应
※分解反应可能是氧化还原反应,一般说,有单质生成的为氧化还原反应
※置换反应全是氧化还原反应
※复分解反应一定不是氧化还原反应
氧化还原反应和四大基本反应类型的关系交流讨论单质参与单质生成 有单质参与或生成的反应一定是氧化还原反应?三、氧化还原反应2、特征 (判断依据)反应前后有元素化合价变化3、本质有电子的转移1、定义有化合价发生变化的反应 0 +1
0-1 有元素化合价升高的 ,叫做还原剂;
有元素化合价降低的 ,叫做氧化剂。还原剂被氧化;氧化剂被还原。还原剂氧化剂三、氧化还原反应氧化剂:得到电子(电子对偏向)
的物质
还原剂:失去电子(电子对偏离)
的物质 反应物4、重要概念氧化反应:物质失去电子的反应
还原反应:物质得到电子的反应被氧化被还原氧化产物:还原剂发生氧化反应后
的产物
还原产物:氧化剂发生还原反应后
的产物生成物5、氧化还原反应的分析方法 (1) 双线桥法——分析电子得失情况+4 0 +6 -1
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl 化合价降低,得2e—,被还原化合价升高,失2e—,被氧化(2)单线桥法——分析电子转移情况+4 0 +6 -1
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl 2e—氧化剂 + 还原剂 = 还原产物 + 氧化产物得ne-,化合价降低,被还原,还原反应失ne-,化合价升高,被氧化,氧化反应记录:
高 失 氧 (被氧化)
低 得 还 (被还原)
同课章节目录
