高中化学人教版必修一第三章第二节《几种重要的金属化合物》ppt课件 (共53张PPT)
文档属性
| 名称 | 高中化学人教版必修一第三章第二节《几种重要的金属化合物》ppt课件 (共53张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-18 00:00:00 | ||
图片预览









文档简介
课件53张PPT。第三章 金属及其化合物第二节 几种重要的金属化合物 联想并列举常见的钠的化合物,并用
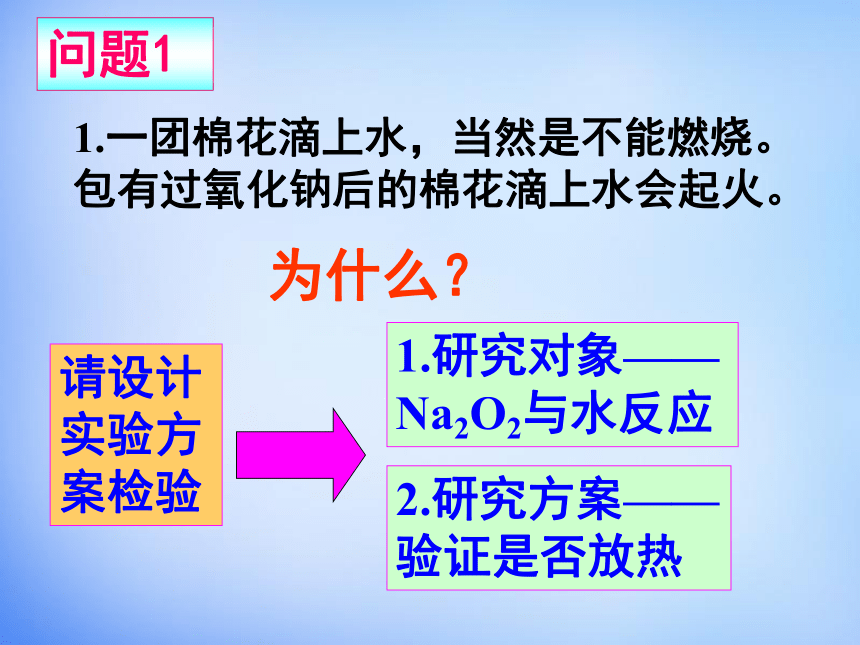
分类的思想对上述物质进行分类。创境设问NaCl谷氨酸钠亚硝酸钠氢氧化钠金属氧化物金属氢氧化物(碱)钠盐小魔术我与刘谦比高下滴水生火:用脱脂棉包裹少量过氧化钠粉末,用滴管滴加少量水。吹气生火:用脱脂棉包裹过氧化钠粉末,通过玻璃导管往脱脂棉中吹气。问题1为什么?1.一团棉花滴上水,当然是不能燃烧。包有过氧化钠后的棉花滴上水会起火。请设计实验方案检验1.研究对象——Na2O2与水反应2.研究方案——验证是否放热活动1实验3-5:向小试管中加入约一药匙过氧化钠,向其中加入约一滴管水,用带火星的木条检验生成的气体。
用手轻轻摸一摸试管外壁,有什么感觉?向反应后的溶液中加入酚酞溶液,有什么现象发生?O2反应放热有碱生成带火星的木条复燃;
试管外壁热;
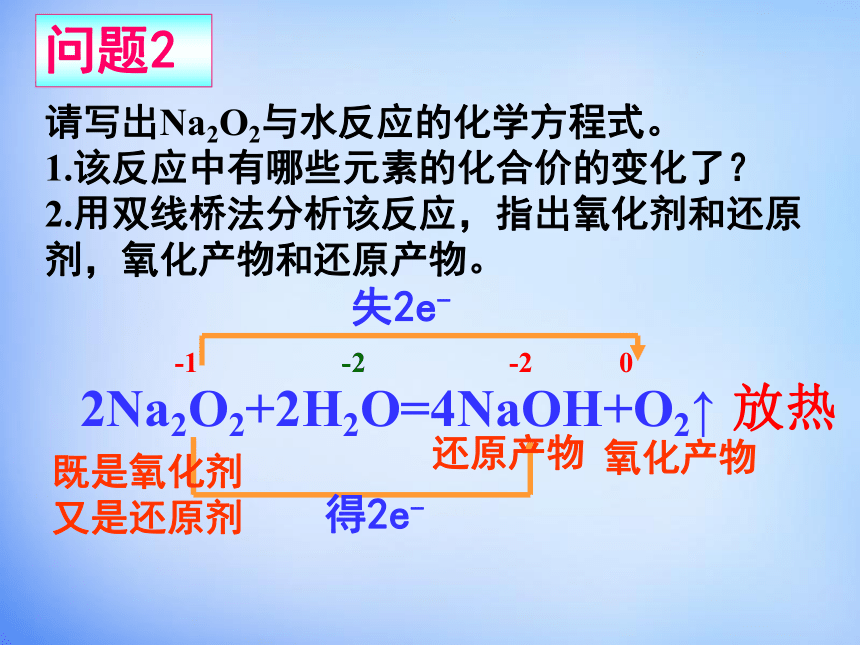
滴加酚酞,溶液呈红色-1 -2 -2 0失2e-得2e-2Na2O2+2H2O=4NaOH+O2↑ 请写出Na2O2与水反应的化学方程式。
1.该反应中有哪些元素的化合价的变化了?
2.用双线桥法分析该反应,指出氧化剂和还原剂,氧化产物和还原产物。既是氧化剂
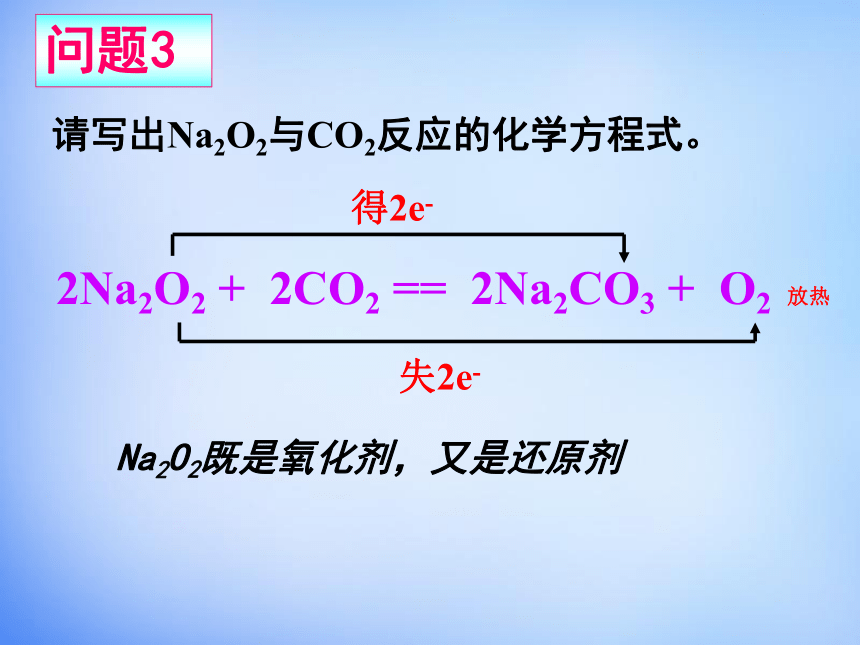
又是还原剂问题2放热还原产物氧化产物2Na2O2 + 2CO2 == 2Na2CO3 + O2 放热 失2e-得2e-Na2O2既是氧化剂,又是还原剂请写出Na2O2与CO2反应的化学方程式。问题3Na2O2Na2O淡黄色固体白色固体2Na2O2+2H2O
=4NaOH+O2↑Na2O+H2O
=2NaOH2Na2O2+2CO2
=2Na2CO3+O2Na2O+CO2
=Na2CO3供氧剂-2-1归纳拓展过氧化钠与氧化钠的比较2Na2O2+4HCl
=4NaCl+2H2O+O2↑Na2O+2HCl
=2NaCl+H2OO2O2O2碱性氧化物:与酸反应生成盐和水的化合物。
如Na2O、CaO、CuO、Fe2O3等。碱性氧化物的通性:
1.与水反应生成碱;
2.与CO2等反应生成盐;
3.与酸反应生成盐和水。思考:Na2O2是碱性氧化物吗?不是,属于过氧化物。碳酸钠和碳酸氢钠属于哪类物质?观察二者的物理性质?预测它们的性质有哪些异同?问题3小结:仍有固体残留溶液变微红色白色粉未,加水结块成晶体,放热白色粉未,加水部分溶解,感受不到热量变化振荡长时间可溶解溶液变红色1.溶解过程放热
2.易溶于水
3.溶液显碱性1.溶解过程微弱放热
2.易溶于水,但溶解度比Na2CO3小
3.溶液显碱性,但碱性比Na2CO3弱活动3Na2CO3和NaHCO3分解实验现象:
Na2CO3受热无明显现象;
NaHCO3受热产生使澄清石灰水变浑浊的气体——CO2请写出NaHCO3受热分解的化学方程式。受热稳定受热不稳定有其它方法进行实验吗?以上实验中左右两支盛有澄清石灰水的试管有何现象?思考与交流问题41.向两支盛有Na2CO3和NaHCO3溶液中分别加入盐酸溶液,有何现象?写出反应的化学方程式和离子方程式。2.Na2CO3和NaHCO3能否与NaOH溶液反应?如果能,写出化学方程式和离子方程式。3.Na2CO3和NaHCO3能否与CaCl2溶液反应?如果能,写出化学方程式和离子方程式。胃药---NaHCO3片制肥皂造纸发酵剂泡沫灭火哭器制玻璃①加热固体,看能否产生使澄清的石灰水变浑浊的气体②加入同浓度盐酸,比较反应速率③相同温度下,比较溶解性,或溶液碱性强弱④加入氯化钙溶液,是否产生白色沉淀拓展思考1.厨房里,我们不小心将盛有纯碱,小苏打
的瓶子弄混了,该怎样区别它们呢? 2.如何实现NaHCO3和 Na2CO3之间相互转化?拓展思考Na2CO3 NaHCO3CO2+H2O①固体(加热)
②溶液(NaOH)阅读课本 1.原理:某些金属或其化合物(离子)灼烧时使火焰呈现出特殊的颜色。2.操作:
把铂丝(或用铁丝)用稀盐酸洗涤后灼烧,反复多次,至火焰变为无色。
用干净的铂丝蘸某待测溶液或固体,放到酒精灯火焰上灼烧,观察其火焰的颜色。
测完后将铂丝用稀盐酸洗净,在火焰上灼烧至无色。问题43.应用:4.注意:(1)焰色反应不是燃烧。
(2)焰色反应不是化学变化,而是该元素的物理性质。(1)离子检验,物质鉴别。
(2)焰火材料。钠--黄色
钾--紫色(透过蓝色的钴玻璃)小结:一、过氧化钠 1、与水反应: 2Na2O2+2H2O=4NaOH+O2↑ 2、与CO2反应:2Na2O2+2CO2=2Na2CO3 +O2(有强氧化性、漂白性)二、碳酸钠和碳酸氢钠 1、与酸反应:CO32- + 2H+ = H2O+CO2↑
HCO3- + H+ = H2O+CO2 ↑2、受热分解:2NaHCO3==Na2CO3+H2O+CO2 ↑△三、焰色反应:钠—黄 钾—紫用耐高温的Al2O3制成的坩埚用耐磨的Al2O3做成的轴承 球磨机配套系列衬砖球塞球石小丽的一天问题1阅读教材P58,思考下列问题:
1.Al2O3有哪些物理性质?
2. Al2O3能与哪些物质发生反应?请写出化学方程式和离子方程式。3.Al2O3属于哪类氧化物?4.什么是两性氧化物?问题2阅读教材P58,思考下列问题:
1.能用氧化铝和水为原料制取氢氧化铝?
2.应该用什么药品制取氢氧化铝呢?3.用铝盐和碱液反应制取氢氧化铝时,用强碱好还是弱碱好?请设计实验方案验证活动1可供选用试剂:硫酸铝溶液、NaOH溶液、氨水产生白色沉淀,后溶解产生白色沉淀,不溶解制备氢氧化铝宜用铝盐和氨水反应请写出实验室制取氢氧化铝的化学方程式和离子方程式。活动2 将制得的氢氧化铝放入两支试管中,分别加入稀盐酸和氢氧化钠溶液,振荡,观察现象,分析作出解释,填写下表:白色沉淀溶解白色沉淀溶解Al(OH)3既能与酸反应又能与碱反应生成盐和水属于两性氢氧化物请写出氢氧化铝与稀盐酸和氢氧化钠溶液反应的化学方程式和离子方程式。问题32.氢氧化铝还有什么性质?请用化学方程式表示。3.氢氧化铝有哪些物理性质?有哪些用途?1.什么是两性氢氧化物? ①可以中和胃酸。(药物胃舒平的主要成分)
②Al(OH)3作净水剂。 例:明矾净水既可以与酸反应又可以与碱反应生成盐和水的氢氧化物称为两性氢氧化物。硫酸铝钾:KAl(SO4)2硫酸铝钾的电离:
KAl(SO4)2 = K++ Al3+ + 2SO42-
溶液中有三种自由移动的离子,两种阳离子,一种阴离子明矾溶于水后生成Al(OH)3胶体明矾:KAl(SO4)2·12H2OAl(OH)3胶体可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清。吸附性资料卡片——复盐可做净水剂小结:1、氧化铝(Al2O3)
Al2O3+6H+ = 2Al3+ +3H2O
Al2O3+2OH- = 2AlO2- +H2O2、氢氧化铝 Al(OH)3Al3++3NH3·H2O==Al(OH)3↓+3NH4+Al(OH)3+3H+ =Al3+ +3H2OAl(OH)3+OH-=AlO2- +2H2O 你知道故宫的外墙是用什么颜料粉刷?创境设问磁铁矿 FeO是一种黑色粉末,不稳定,在空气里会迅速被氧化为Fe3O4。主要成分:Fe3O4(俗称磁性氧化铁)铁的氧化物——铁红磁性氧化铁黑色粉末红棕色粉末黑色晶体+2价+3价+2价、+3价不溶不溶不溶不稳定稳定稳定FeO + 2H+ = Fe2+ + H2OFe2O3 + 6H+ = Fe3+ + 3H2OFe3O4 + 8H+= Fe2+ + 2Fe3++4 H2O铁有哪些氢氧化物?如何制备铁的氢氧化物?方案一:能否通过铁和水反应制得?方案二:能否通过铁的氧化物和水反应得到?方案三:用可溶性铁盐、亚铁盐与碱溶液反应?问题2 白色絮状沉淀 → 灰绿色 → 红褐色沉淀 红褐色沉淀FeCl3 + 3NaOH = Fe(OH)3?+3NaClFeSO4 + 2NaOH =
Fe(OH)2? + Na2SO4实验3-9:在FeCl3、FeSO4分别加入NaOH溶液,观察并记录现象 铁的两种氢氧化物可以分别由相对应的可溶性盐
和碱溶液反应制得。活动1
拓展思考1.为什么在实际操作中几乎看不到白色Fe(OH)2沉淀而只看到灰绿色?2.能不能通过实验改进,使生成的Fe(OH) 2沉淀能较长时间保持白色?Fe(OH)2易被氧化的原因:1.反应的溶液与空气接触;2.反应试剂溶有氧气;实验改进的目的:
隔绝氧气与反应物和生成物接触措施:
1.用煮沸过的蒸馏水配制FeSO4溶液和NaOH溶液;
2.在试管中FeSO4溶液液面上加几滴植物油;
3. 胶头滴管的末端伸入FeSO4溶液液面之下;4Fe(OH)2 + O2+2H2O = 4Fe(OH)3?问题3 Fe(OH)2和Fe(OH)3具有哪些性质?请写出化学方程式和离子方程式?铁的氢氧化物 Fe2++2OH-=Fe(OH)2↓Fe3++3OH-=Fe(OH)3↓ 灰白色 红褐色 难溶于水 难溶于水 受热易分解 易被空气中氧气氧化成氢氧化铁 4Fe(OH)2+2H2O+O2
=4Fe(OH)3 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O 归纳拓展1.将Fe(OH)2露置在空气中加热所得产物为( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe(OH)3
2.稀硫酸中加入适量铁粉,反应完全后再加入适量的NaOH溶液,放置片刻,整个过程中观察到的颜色变化是( )
A.无色、灰绿色、红褐色
B.无色、浅绿色、白色、灰绿色、红褐色
C.灰绿色、红褐色、蓝色
D.灰绿色、白色、浅绿色、灰绿色、红褐色 BB拓展练习 苹果汁是人们喜爱的饮料,但是现榨的苹果汁在空气中会慢慢的由浅绿色变为棕黄色,为什么呢?新鲜苹果汁放置一段时间O2 Fe2+ Fe3+ Fe2+(浅绿色)→Fe3+(棕黄色),如何判断FeCl2溶液是否有部分Fe2+被氧化成Fe3+?问题4活动2溶液呈血红色溶液颜色无变化实验3-10:向FeCl3和FeCl2溶液中分别加入KSCN溶液 Fe3++3SCN-=Fe(SCN)3 (血红色溶液)(可用来检验Fe3+的存在)Fe3+离子的检验 如何防止FeCl2溶液的Fe2+被氧化成Fe3+?问题5溶液由黄色变成浅绿色溶液由浅绿色变为红色溶液由浅绿色变为红色Fe3+具有氧化性
2Fe3++Fe=3Fe2+ Fe2+具有还原性
2Fe2++Cl2=2Fe3++2Cl- 思考:怎样检验溶液中有Fe2+离子?活动3P61 科学探究 Fe2+ Fe3+ 还原剂:金属单质,如铁、铜、S2-、I-等
氧化剂:Cl2、O2 、 H2O2、 Na2O2 、
KMnO4等氧化剂还原剂Fe2+和Fe3+的相互转化归纳拓展Fe3+和Fe2+的鉴别 白色沉淀→灰绿色→红褐色立即产生红褐色沉淀不变红色,若再通Cl2则变血红色变血红色浅绿色归纳拓展棕黄色或黄色3. 要证明某溶液中不含Fe3+,而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
①滴入足量氯水 ②加入铁粉 ③滴入KSCN溶液 ④滴入NaOH溶液
A. ①③ B. ③② C. ③① D. ③④
4.要除去FeCl2溶液中少量的FeCl3,可行的办法是 ( )
A.滴入KSCN溶液 B.通入氯气
C.加入铜粉 D.加入铁粉拓展练习CD铜盐—资料卡片P62 误食重金属盐中毒的原因:重金属离子使蛋白质变性,从而使蛋白质失去了生理活性。铝盐和铁盐的净水作用不加试剂加入明矾加入硫酸铁溶液 2 min时5 min时无明显变化有明显沉降,溶液半透明有明显沉降溶液半透明沉淀沉在底部 溶液接近透明沉淀沉在底部 溶液接近透明 浑浊 , 略有沉降 明矾和硫酸铁溶液可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,可用做净水剂。结 论实践活动小结:1、铁的氧化物(FeO 、 Fe2O3、 Fe3O4)2、铁的氢氧化物( Fe(OH)2 Fe(OH)3 )3、铁盐和亚铁盐(1)Fe3+的检验
(2)Fe3+与Fe2+的相互转化(3) Fe3+与Fe2+鉴别方法 2Fe2++Cl2 = 2Fe3++2Cl-2Fe3++Fe = 3Fe2+ 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
分类的思想对上述物质进行分类。创境设问NaCl谷氨酸钠亚硝酸钠氢氧化钠金属氧化物金属氢氧化物(碱)钠盐小魔术我与刘谦比高下滴水生火:用脱脂棉包裹少量过氧化钠粉末,用滴管滴加少量水。吹气生火:用脱脂棉包裹过氧化钠粉末,通过玻璃导管往脱脂棉中吹气。问题1为什么?1.一团棉花滴上水,当然是不能燃烧。包有过氧化钠后的棉花滴上水会起火。请设计实验方案检验1.研究对象——Na2O2与水反应2.研究方案——验证是否放热活动1实验3-5:向小试管中加入约一药匙过氧化钠,向其中加入约一滴管水,用带火星的木条检验生成的气体。
用手轻轻摸一摸试管外壁,有什么感觉?向反应后的溶液中加入酚酞溶液,有什么现象发生?O2反应放热有碱生成带火星的木条复燃;
试管外壁热;
滴加酚酞,溶液呈红色-1 -2 -2 0失2e-得2e-2Na2O2+2H2O=4NaOH+O2↑ 请写出Na2O2与水反应的化学方程式。
1.该反应中有哪些元素的化合价的变化了?
2.用双线桥法分析该反应,指出氧化剂和还原剂,氧化产物和还原产物。既是氧化剂
又是还原剂问题2放热还原产物氧化产物2Na2O2 + 2CO2 == 2Na2CO3 + O2 放热 失2e-得2e-Na2O2既是氧化剂,又是还原剂请写出Na2O2与CO2反应的化学方程式。问题3Na2O2Na2O淡黄色固体白色固体2Na2O2+2H2O
=4NaOH+O2↑Na2O+H2O
=2NaOH2Na2O2+2CO2
=2Na2CO3+O2Na2O+CO2
=Na2CO3供氧剂-2-1归纳拓展过氧化钠与氧化钠的比较2Na2O2+4HCl
=4NaCl+2H2O+O2↑Na2O+2HCl
=2NaCl+H2OO2O2O2碱性氧化物:与酸反应生成盐和水的化合物。
如Na2O、CaO、CuO、Fe2O3等。碱性氧化物的通性:
1.与水反应生成碱;
2.与CO2等反应生成盐;
3.与酸反应生成盐和水。思考:Na2O2是碱性氧化物吗?不是,属于过氧化物。碳酸钠和碳酸氢钠属于哪类物质?观察二者的物理性质?预测它们的性质有哪些异同?问题3小结:仍有固体残留溶液变微红色白色粉未,加水结块成晶体,放热白色粉未,加水部分溶解,感受不到热量变化振荡长时间可溶解溶液变红色1.溶解过程放热
2.易溶于水
3.溶液显碱性1.溶解过程微弱放热
2.易溶于水,但溶解度比Na2CO3小
3.溶液显碱性,但碱性比Na2CO3弱活动3Na2CO3和NaHCO3分解实验现象:
Na2CO3受热无明显现象;
NaHCO3受热产生使澄清石灰水变浑浊的气体——CO2请写出NaHCO3受热分解的化学方程式。受热稳定受热不稳定有其它方法进行实验吗?以上实验中左右两支盛有澄清石灰水的试管有何现象?思考与交流问题41.向两支盛有Na2CO3和NaHCO3溶液中分别加入盐酸溶液,有何现象?写出反应的化学方程式和离子方程式。2.Na2CO3和NaHCO3能否与NaOH溶液反应?如果能,写出化学方程式和离子方程式。3.Na2CO3和NaHCO3能否与CaCl2溶液反应?如果能,写出化学方程式和离子方程式。胃药---NaHCO3片制肥皂造纸发酵剂泡沫灭火哭器制玻璃①加热固体,看能否产生使澄清的石灰水变浑浊的气体②加入同浓度盐酸,比较反应速率③相同温度下,比较溶解性,或溶液碱性强弱④加入氯化钙溶液,是否产生白色沉淀拓展思考1.厨房里,我们不小心将盛有纯碱,小苏打
的瓶子弄混了,该怎样区别它们呢? 2.如何实现NaHCO3和 Na2CO3之间相互转化?拓展思考Na2CO3 NaHCO3CO2+H2O①固体(加热)
②溶液(NaOH)阅读课本 1.原理:某些金属或其化合物(离子)灼烧时使火焰呈现出特殊的颜色。2.操作:
把铂丝(或用铁丝)用稀盐酸洗涤后灼烧,反复多次,至火焰变为无色。
用干净的铂丝蘸某待测溶液或固体,放到酒精灯火焰上灼烧,观察其火焰的颜色。
测完后将铂丝用稀盐酸洗净,在火焰上灼烧至无色。问题43.应用:4.注意:(1)焰色反应不是燃烧。
(2)焰色反应不是化学变化,而是该元素的物理性质。(1)离子检验,物质鉴别。
(2)焰火材料。钠--黄色
钾--紫色(透过蓝色的钴玻璃)小结:一、过氧化钠 1、与水反应: 2Na2O2+2H2O=4NaOH+O2↑ 2、与CO2反应:2Na2O2+2CO2=2Na2CO3 +O2(有强氧化性、漂白性)二、碳酸钠和碳酸氢钠 1、与酸反应:CO32- + 2H+ = H2O+CO2↑
HCO3- + H+ = H2O+CO2 ↑2、受热分解:2NaHCO3==Na2CO3+H2O+CO2 ↑△三、焰色反应:钠—黄 钾—紫用耐高温的Al2O3制成的坩埚用耐磨的Al2O3做成的轴承 球磨机配套系列衬砖球塞球石小丽的一天问题1阅读教材P58,思考下列问题:
1.Al2O3有哪些物理性质?
2. Al2O3能与哪些物质发生反应?请写出化学方程式和离子方程式。3.Al2O3属于哪类氧化物?4.什么是两性氧化物?问题2阅读教材P58,思考下列问题:
1.能用氧化铝和水为原料制取氢氧化铝?
2.应该用什么药品制取氢氧化铝呢?3.用铝盐和碱液反应制取氢氧化铝时,用强碱好还是弱碱好?请设计实验方案验证活动1可供选用试剂:硫酸铝溶液、NaOH溶液、氨水产生白色沉淀,后溶解产生白色沉淀,不溶解制备氢氧化铝宜用铝盐和氨水反应请写出实验室制取氢氧化铝的化学方程式和离子方程式。活动2 将制得的氢氧化铝放入两支试管中,分别加入稀盐酸和氢氧化钠溶液,振荡,观察现象,分析作出解释,填写下表:白色沉淀溶解白色沉淀溶解Al(OH)3既能与酸反应又能与碱反应生成盐和水属于两性氢氧化物请写出氢氧化铝与稀盐酸和氢氧化钠溶液反应的化学方程式和离子方程式。问题32.氢氧化铝还有什么性质?请用化学方程式表示。3.氢氧化铝有哪些物理性质?有哪些用途?1.什么是两性氢氧化物? ①可以中和胃酸。(药物胃舒平的主要成分)
②Al(OH)3作净水剂。 例:明矾净水既可以与酸反应又可以与碱反应生成盐和水的氢氧化物称为两性氢氧化物。硫酸铝钾:KAl(SO4)2硫酸铝钾的电离:
KAl(SO4)2 = K++ Al3+ + 2SO42-
溶液中有三种自由移动的离子,两种阳离子,一种阴离子明矾溶于水后生成Al(OH)3胶体明矾:KAl(SO4)2·12H2OAl(OH)3胶体可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清。吸附性资料卡片——复盐可做净水剂小结:1、氧化铝(Al2O3)
Al2O3+6H+ = 2Al3+ +3H2O
Al2O3+2OH- = 2AlO2- +H2O2、氢氧化铝 Al(OH)3Al3++3NH3·H2O==Al(OH)3↓+3NH4+Al(OH)3+3H+ =Al3+ +3H2OAl(OH)3+OH-=AlO2- +2H2O 你知道故宫的外墙是用什么颜料粉刷?创境设问磁铁矿 FeO是一种黑色粉末,不稳定,在空气里会迅速被氧化为Fe3O4。主要成分:Fe3O4(俗称磁性氧化铁)铁的氧化物——铁红磁性氧化铁黑色粉末红棕色粉末黑色晶体+2价+3价+2价、+3价不溶不溶不溶不稳定稳定稳定FeO + 2H+ = Fe2+ + H2OFe2O3 + 6H+ = Fe3+ + 3H2OFe3O4 + 8H+= Fe2+ + 2Fe3++4 H2O铁有哪些氢氧化物?如何制备铁的氢氧化物?方案一:能否通过铁和水反应制得?方案二:能否通过铁的氧化物和水反应得到?方案三:用可溶性铁盐、亚铁盐与碱溶液反应?问题2 白色絮状沉淀 → 灰绿色 → 红褐色沉淀 红褐色沉淀FeCl3 + 3NaOH = Fe(OH)3?+3NaClFeSO4 + 2NaOH =
Fe(OH)2? + Na2SO4实验3-9:在FeCl3、FeSO4分别加入NaOH溶液,观察并记录现象 铁的两种氢氧化物可以分别由相对应的可溶性盐
和碱溶液反应制得。活动1
拓展思考1.为什么在实际操作中几乎看不到白色Fe(OH)2沉淀而只看到灰绿色?2.能不能通过实验改进,使生成的Fe(OH) 2沉淀能较长时间保持白色?Fe(OH)2易被氧化的原因:1.反应的溶液与空气接触;2.反应试剂溶有氧气;实验改进的目的:
隔绝氧气与反应物和生成物接触措施:
1.用煮沸过的蒸馏水配制FeSO4溶液和NaOH溶液;
2.在试管中FeSO4溶液液面上加几滴植物油;
3. 胶头滴管的末端伸入FeSO4溶液液面之下;4Fe(OH)2 + O2+2H2O = 4Fe(OH)3?问题3 Fe(OH)2和Fe(OH)3具有哪些性质?请写出化学方程式和离子方程式?铁的氢氧化物 Fe2++2OH-=Fe(OH)2↓Fe3++3OH-=Fe(OH)3↓ 灰白色 红褐色 难溶于水 难溶于水 受热易分解 易被空气中氧气氧化成氢氧化铁 4Fe(OH)2+2H2O+O2
=4Fe(OH)3 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O 归纳拓展1.将Fe(OH)2露置在空气中加热所得产物为( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe(OH)3
2.稀硫酸中加入适量铁粉,反应完全后再加入适量的NaOH溶液,放置片刻,整个过程中观察到的颜色变化是( )
A.无色、灰绿色、红褐色
B.无色、浅绿色、白色、灰绿色、红褐色
C.灰绿色、红褐色、蓝色
D.灰绿色、白色、浅绿色、灰绿色、红褐色 BB拓展练习 苹果汁是人们喜爱的饮料,但是现榨的苹果汁在空气中会慢慢的由浅绿色变为棕黄色,为什么呢?新鲜苹果汁放置一段时间O2 Fe2+ Fe3+ Fe2+(浅绿色)→Fe3+(棕黄色),如何判断FeCl2溶液是否有部分Fe2+被氧化成Fe3+?问题4活动2溶液呈血红色溶液颜色无变化实验3-10:向FeCl3和FeCl2溶液中分别加入KSCN溶液 Fe3++3SCN-=Fe(SCN)3 (血红色溶液)(可用来检验Fe3+的存在)Fe3+离子的检验 如何防止FeCl2溶液的Fe2+被氧化成Fe3+?问题5溶液由黄色变成浅绿色溶液由浅绿色变为红色溶液由浅绿色变为红色Fe3+具有氧化性
2Fe3++Fe=3Fe2+ Fe2+具有还原性
2Fe2++Cl2=2Fe3++2Cl- 思考:怎样检验溶液中有Fe2+离子?活动3P61 科学探究 Fe2+ Fe3+ 还原剂:金属单质,如铁、铜、S2-、I-等
氧化剂:Cl2、O2 、 H2O2、 Na2O2 、
KMnO4等氧化剂还原剂Fe2+和Fe3+的相互转化归纳拓展Fe3+和Fe2+的鉴别 白色沉淀→灰绿色→红褐色立即产生红褐色沉淀不变红色,若再通Cl2则变血红色变血红色浅绿色归纳拓展棕黄色或黄色3. 要证明某溶液中不含Fe3+,而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
①滴入足量氯水 ②加入铁粉 ③滴入KSCN溶液 ④滴入NaOH溶液
A. ①③ B. ③② C. ③① D. ③④
4.要除去FeCl2溶液中少量的FeCl3,可行的办法是 ( )
A.滴入KSCN溶液 B.通入氯气
C.加入铜粉 D.加入铁粉拓展练习CD铜盐—资料卡片P62 误食重金属盐中毒的原因:重金属离子使蛋白质变性,从而使蛋白质失去了生理活性。铝盐和铁盐的净水作用不加试剂加入明矾加入硫酸铁溶液 2 min时5 min时无明显变化有明显沉降,溶液半透明有明显沉降溶液半透明沉淀沉在底部 溶液接近透明沉淀沉在底部 溶液接近透明 浑浊 , 略有沉降 明矾和硫酸铁溶液可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,可用做净水剂。结 论实践活动小结:1、铁的氧化物(FeO 、 Fe2O3、 Fe3O4)2、铁的氢氧化物( Fe(OH)2 Fe(OH)3 )3、铁盐和亚铁盐(1)Fe3+的检验
(2)Fe3+与Fe2+的相互转化(3) Fe3+与Fe2+鉴别方法 2Fe2++Cl2 = 2Fe3++2Cl-2Fe3++Fe = 3Fe2+ 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
