人教版高中化学选修4 第一章 化学反应能量 第一节化学反应与能量变化 第一课时 《焓变,反应热》教学课件共25张PPT (共25张PPT)
文档属性
| 名称 | 人教版高中化学选修4 第一章 化学反应能量 第一节化学反应与能量变化 第一课时 《焓变,反应热》教学课件共25张PPT (共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 58.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-20 07:40:05 | ||
图片预览







文档简介
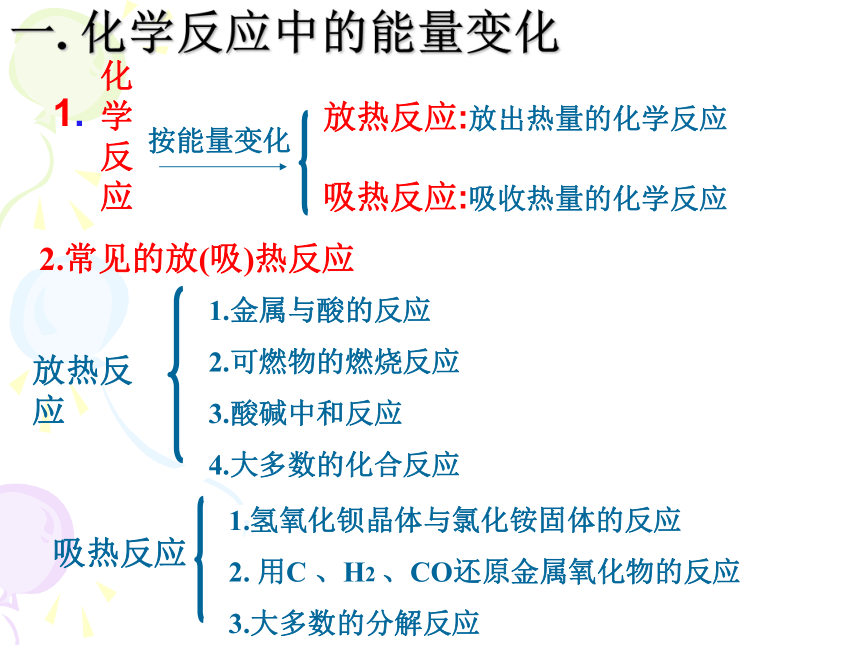
课件25张PPT。“给我一个支点和一根足够长的杠杆,我可以撬动地球!”思考 推动人类社会进步的这个杠杆是什么呢?阿基米德能 量第一章 化学反应与能量第一节 化学反应与能量的变化一. 化学反应中的能量变化2.常见的放(吸)热反应1.金属与酸的反应
2.可燃物的燃烧反应
3.酸碱中和反应
4.大多数的化合反应1.氢氧化钡晶体与氯化铵固体的反应
2. 用C 、H2 、CO还原金属氧化物的反应
3.大多数的分解反应
[课题一] 化学反应为什么伴随着能量的变化?☆从反应物和生成物具有的能量去考虑放热反应吸热反应能量反应过程反应物总能量生成物总能量能量反应过程E反>E生E反形成化学键需要 能量从化学键的变化角度解释为什么化学反应中存在能量变化?吸收释放一、反应热 焓变1. 焓(H):
2.焓变(△H):
3.反应热:(1)符号: ΔH
(2)单位:kJ/mol 或 kJ?mol-1(3)产生原因:化学键断裂——吸热
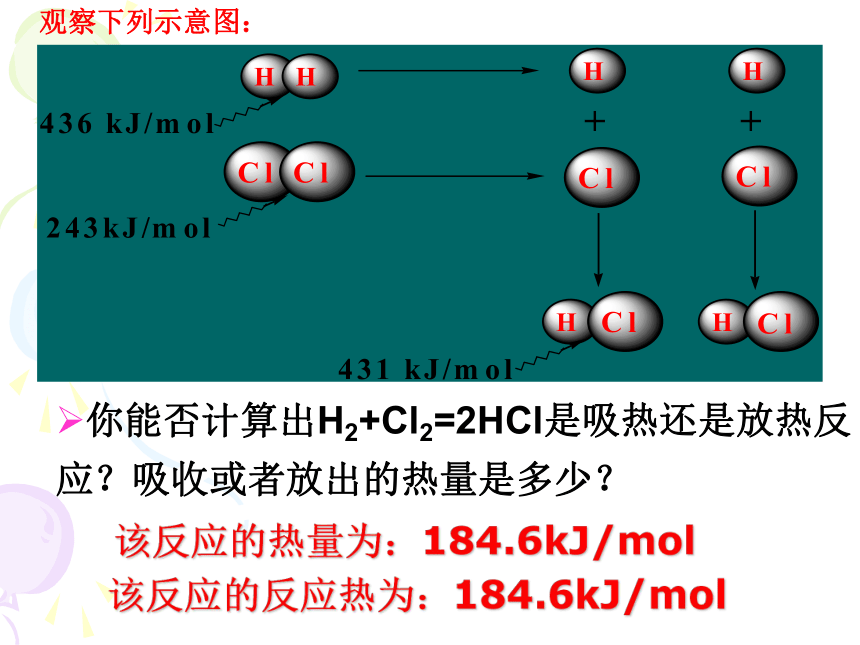
化学键形成——放热是与内能有关的物理量。 在一定条件下,某一化学反应是 吸热反应还是放热反应,由生成物与反应物的焓值差决定,即化学反应过程中所释放或吸收的能量.观察下列示意图:
你能否计算出H2+Cl2=2HCl是吸热还是放热反应?吸收或者放出的热量是多少? 该反应的热量为:184.6kJ/mol该反应的反应热为:184.6kJ/mol△H= E(吸) - E(放)△H= Q(生成物总能量) - Q(反应物总能量)微观角度----从化学键上认识E(吸)代表反应物断键时吸收的总能量
E(放)代表生成物成键时放出的总能量对化学反应中能量变化的认识宏观角度-----从物质本身的内能上认识△H 为“+”或△H >0△H 为“-”或△H <0体系的能量是升高还是降低?
环境的能量是升高还是降低?
规定放热反应的ΔH 为“-”,是站在谁的角度?体系还是环境?放热反应思考1: 降 低 升 高 体 系思考2:△H<0时反应 热 放吸△H > 0时反应 热[课题二] 如何在化学方程式中反映其热量变化?热化学方程式第二课时H2(g)+1/2O2(g) = H2O(g) △H=-241.8 kJ/mol
H2(g)十1/2O2 (g)=H2O(l) △H=-285.8kJ/mol与化学方程式相比,以上方程式有哪些不同?H2O(l) = H2(g)十1/2O2 (g) △H=+285.8kJ/mol以上均为热化学反应方程式1.热化学方程式定义能表示参加反应物质的量和反应热的关系的化学方程式注意:热化学方程式包含物质变化和能量变化两个
部分,二者缺一不可。
物质变化能量变化一写2、热化学方程式的书写步骤二注三写3.书写热化学方程式应注意事项: (1)注明反应物和生成物的聚集状态,固体(s)、液体(l)、气体(g)、溶液(aq)表示
(2)在方程式后写下ΔH的数值和单位注明△H 的“+”、“—” ,方程式与ΔH用空格隔开。(3) 热化学方程式中化学计量数可表示各物质的物质的量,可以是整数或分数。
同一化学反应中,化学计量数加倍,△H也要加倍。当反应逆向进行时,其ΔH与正反应的数值相等,符号相反。(4)一般不写反应条件;不标明生成沉淀“↓”或气体“↑” 。(5)书写热化学方程式时应注明△H的测定条件。但绝大多数△H是在25℃,,101kpa下测定的,可不注明温度和压强练习:1mol C与水蒸气反应生成CO 和H2,需要吸收 131.5 kJ的热量。写出此反应的热化学方程式。C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5KJ/mol0.5mol C与水蒸气反应生成CO 和H2,需要写出此反应的热化学方程式和吸收多少的热量?1/2C(s)+1/2H2O(g)=1/2CO(g)+1/2H2(g)
△H= + 65.75KJ/molC(金刚石 s )C(石墨 s )6)同一物质所具有的能量越低,性质越稳定
物质所具有的能量越高,性质越不稳定气、液、固态性质越来越稳定,所具有的能量越来越低备注:
同一种物质的三种形态:固体(s) 液体(l) 气体(g)
所具有能量的大小比较? S(g)+O2(g)=SO2 (g) ΔH1 = -akJ/mol
S(s)+O2(g)=SO2 (g) ΔH2 = -bkJ/mol
a b ΔH1ΔH2><一写4.热化学方程式的书写步骤二注三写比较化学反应方程式和热化学反应方程式不注明要求必须在物质或微粒之后注明无必须注明表示化学反应中物质的变化不仅表明化学反应中的物质的变化,而且表明化学反应中的能量变化。2H2+O2=2H2O2H2(g)+O2(g)=2H2O(g)
△H=-483.6 kJ/molH2(g)+1/2O2(g) = H2O(g)
△H=-241.8 kJ/mol比较放热反应和吸热反应△H<0或△H为“-”△H>0或△H为“+”反应物的总能量大于
生成物能量反应物的总能量小于
生成物能量反应物总键能小于
生成物的总键能反应物的总键能大于生成物总键能物质能量越低,键能越大,越稳定,
物质能量越高,键能越小,越不稳定
1、化学键断裂,吸收能量;
化学键生成,放出能量小结:从化学键角度(微观)从物质总能量角度(宏观) Q吸>Q放,Q吸E生,E反
2.可燃物的燃烧反应
3.酸碱中和反应
4.大多数的化合反应1.氢氧化钡晶体与氯化铵固体的反应
2. 用C 、H2 、CO还原金属氧化物的反应
3.大多数的分解反应
[课题一] 化学反应为什么伴随着能量的变化?☆从反应物和生成物具有的能量去考虑放热反应吸热反应能量反应过程反应物总能量生成物总能量能量反应过程E反>E生E反
2.焓变(△H):
3.反应热:(1)符号: ΔH
(2)单位:kJ/mol 或 kJ?mol-1(3)产生原因:化学键断裂——吸热
化学键形成——放热是与内能有关的物理量。 在一定条件下,某一化学反应是 吸热反应还是放热反应,由生成物与反应物的焓值差决定,即化学反应过程中所释放或吸收的能量.观察下列示意图:
你能否计算出H2+Cl2=2HCl是吸热还是放热反应?吸收或者放出的热量是多少? 该反应的热量为:184.6kJ/mol该反应的反应热为:184.6kJ/mol△H= E(吸) - E(放)△H= Q(生成物总能量) - Q(反应物总能量)微观角度----从化学键上认识E(吸)代表反应物断键时吸收的总能量
E(放)代表生成物成键时放出的总能量对化学反应中能量变化的认识宏观角度-----从物质本身的内能上认识△H 为“+”或△H >0△H 为“-”或△H <0体系的能量是升高还是降低?
环境的能量是升高还是降低?
规定放热反应的ΔH 为“-”,是站在谁的角度?体系还是环境?放热反应思考1: 降 低 升 高 体 系思考2:△H<0时反应 热 放吸△H > 0时反应 热[课题二] 如何在化学方程式中反映其热量变化?热化学方程式第二课时H2(g)+1/2O2(g) = H2O(g) △H=-241.8 kJ/mol
H2(g)十1/2O2 (g)=H2O(l) △H=-285.8kJ/mol与化学方程式相比,以上方程式有哪些不同?H2O(l) = H2(g)十1/2O2 (g) △H=+285.8kJ/mol以上均为热化学反应方程式1.热化学方程式定义能表示参加反应物质的量和反应热的关系的化学方程式注意:热化学方程式包含物质变化和能量变化两个
部分,二者缺一不可。
物质变化能量变化一写2、热化学方程式的书写步骤二注三写3.书写热化学方程式应注意事项: (1)注明反应物和生成物的聚集状态,固体(s)、液体(l)、气体(g)、溶液(aq)表示
(2)在方程式后写下ΔH的数值和单位注明△H 的“+”、“—” ,方程式与ΔH用空格隔开。(3) 热化学方程式中化学计量数可表示各物质的物质的量,可以是整数或分数。
同一化学反应中,化学计量数加倍,△H也要加倍。当反应逆向进行时,其ΔH与正反应的数值相等,符号相反。(4)一般不写反应条件;不标明生成沉淀“↓”或气体“↑” 。(5)书写热化学方程式时应注明△H的测定条件。但绝大多数△H是在25℃,,101kpa下测定的,可不注明温度和压强练习:1mol C与水蒸气反应生成CO 和H2,需要吸收 131.5 kJ的热量。写出此反应的热化学方程式。C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5KJ/mol0.5mol C与水蒸气反应生成CO 和H2,需要写出此反应的热化学方程式和吸收多少的热量?1/2C(s)+1/2H2O(g)=1/2CO(g)+1/2H2(g)
△H= + 65.75KJ/molC(金刚石 s )C(石墨 s )6)同一物质所具有的能量越低,性质越稳定
物质所具有的能量越高,性质越不稳定气、液、固态性质越来越稳定,所具有的能量越来越低备注:
同一种物质的三种形态:固体(s) 液体(l) 气体(g)
所具有能量的大小比较? S(g)+O2(g)=SO2 (g) ΔH1 = -akJ/mol
S(s)+O2(g)=SO2 (g) ΔH2 = -bkJ/mol
a b ΔH1ΔH2><一写4.热化学方程式的书写步骤二注三写比较化学反应方程式和热化学反应方程式不注明要求必须在物质或微粒之后注明无必须注明表示化学反应中物质的变化不仅表明化学反应中的物质的变化,而且表明化学反应中的能量变化。2H2+O2=2H2O2H2(g)+O2(g)=2H2O(g)
△H=-483.6 kJ/molH2(g)+1/2O2(g) = H2O(g)
△H=-241.8 kJ/mol比较放热反应和吸热反应△H<0或△H为“-”△H>0或△H为“+”反应物的总能量大于
生成物能量反应物的总能量小于
生成物能量反应物总键能小于
生成物的总键能反应物的总键能大于生成物总键能物质能量越低,键能越大,越稳定,
物质能量越高,键能越小,越不稳定
1、化学键断裂,吸收能量;
化学键生成,放出能量小结:从化学键角度(微观)从物质总能量角度(宏观) Q吸>Q放,Q吸
