人教版高一化学必修一教学课件《第二章第二节 离子反应》 (共14张PPT)
文档属性
| 名称 | 人教版高一化学必修一教学课件《第二章第二节 离子反应》 (共14张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 215.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-23 06:58:22 | ||
图片预览






文档简介
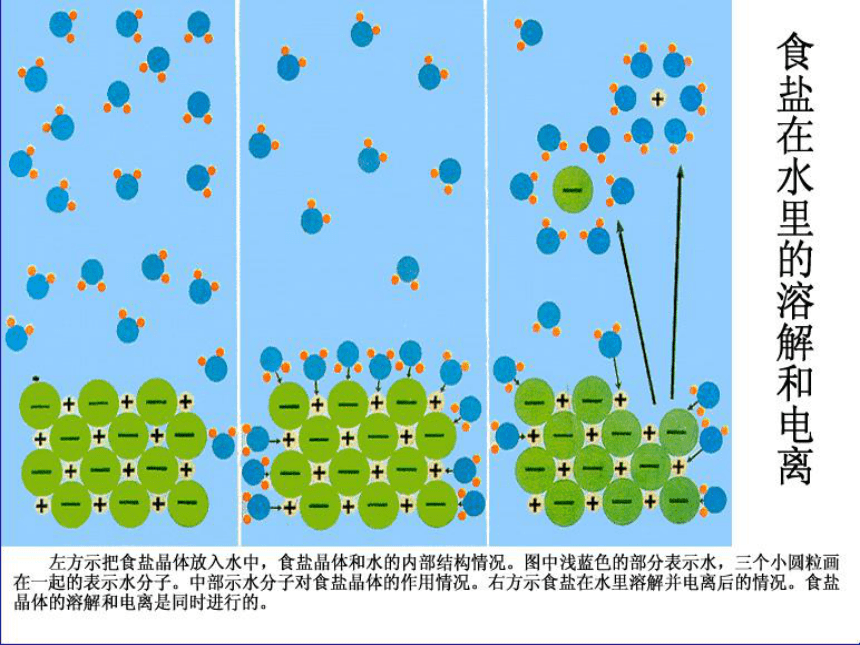
课件14张PPT。离子反应回顾与思考: 为什么NaCl、HCl、HNO3等的水溶液能够导电呢?引入: 在初中化学的学习中,我们接触过一些常见的酸、碱和盐,你能举出一些常见的酸碱和盐的例子吗?到底什么是酸、碱和盐呢? 酸、碱、盐溶液导电原因:
1、酸、碱、盐溶液的导电性,导电原因:
酸、碱、盐溶液能够导电是因为物质溶于水时,离解成自由移动的阴、阳离子。
讲解: 酸:电离时生成的阳离子 全部 是氢离子的化合物叫做酸。 碱:电离时生成的阴离子 全部 是氢氧根离子的化合物叫做碱。Na++OH-NaOH=2H++SO42—H2SO4=电离时生成金属离子(或NH4+)和酸根离子的化合物叫做盐” 盐:=Mg2++2Cl-MgCl2理解:电解质和非电解质电解质:凡是在水溶液中或熔融状态下,能导电的化合物。非电解质:凡是在水溶液中和熔融状态下,都不能导电的化合物。下列物质哪些是电解质?哪些是非电解质?加深理解:①金属铜 ②固态NaCl ③SO2 ④H2SO4
⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨葡萄糖电解质:②④⑧非电解质: ③⑨了解:强电解质与弱电解质 强电解质: 在水溶液里全部电离成离子的 电解质 弱电解质: 在水溶液里部分电离成离子的 电解质强电解质与弱电解质的比较 掌握:电离方程式的书写2Na++SO42—Na2SO4=表示电解质电离的式子叫电离方程式 H++NO3—HNO3=NH3·H2OH++ CH3COO—CH3COOHNH4++OH—H++ CH3COOCH3COOHBaSO4、CaCO3、AgCl等难溶于水的盐是否属电解
质?CH3COOH易溶,是否属强电解质?
BaSO4、CaCO3、AgCl虽然难溶,但溶解的极少部分却是
完全电离,所以它们为强电解质。 CH3COOH虽易溶于水,但它却不能完全电离,所以属弱电解质。因此,电解质的强弱跟其溶解度无必然联系,本质区别在于它们在水溶液中的电离程度。
思考与交流: 小结:
强电解质
强酸:如HCl、H2SO4、HNO3
强碱:如NaOH、KOH、Ba(OH)2
大多数盐:如NaCl、AgNO3
弱电解质
弱酸:如H2S、H2CO3、CH3COOH
弱碱:NH3·H2O、Cu(OH)2
其它:H2O
1、酸、碱、盐溶液的导电性,导电原因:
酸、碱、盐溶液能够导电是因为物质溶于水时,离解成自由移动的阴、阳离子。
讲解: 酸:电离时生成的阳离子 全部 是氢离子的化合物叫做酸。 碱:电离时生成的阴离子 全部 是氢氧根离子的化合物叫做碱。Na++OH-NaOH=2H++SO42—H2SO4=电离时生成金属离子(或NH4+)和酸根离子的化合物叫做盐” 盐:=Mg2++2Cl-MgCl2理解:电解质和非电解质电解质:凡是在水溶液中或熔融状态下,能导电的化合物。非电解质:凡是在水溶液中和熔融状态下,都不能导电的化合物。下列物质哪些是电解质?哪些是非电解质?加深理解:①金属铜 ②固态NaCl ③SO2 ④H2SO4
⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨葡萄糖电解质:②④⑧非电解质: ③⑨了解:强电解质与弱电解质 强电解质: 在水溶液里全部电离成离子的 电解质 弱电解质: 在水溶液里部分电离成离子的 电解质强电解质与弱电解质的比较 掌握:电离方程式的书写2Na++SO42—Na2SO4=表示电解质电离的式子叫电离方程式 H++NO3—HNO3=NH3·H2OH++ CH3COO—CH3COOHNH4++OH—H++ CH3COOCH3COOHBaSO4、CaCO3、AgCl等难溶于水的盐是否属电解
质?CH3COOH易溶,是否属强电解质?
BaSO4、CaCO3、AgCl虽然难溶,但溶解的极少部分却是
完全电离,所以它们为强电解质。 CH3COOH虽易溶于水,但它却不能完全电离,所以属弱电解质。因此,电解质的强弱跟其溶解度无必然联系,本质区别在于它们在水溶液中的电离程度。
思考与交流: 小结:
强电解质
强酸:如HCl、H2SO4、HNO3
强碱:如NaOH、KOH、Ba(OH)2
大多数盐:如NaCl、AgNO3
弱电解质
弱酸:如H2S、H2CO3、CH3COOH
弱碱:NH3·H2O、Cu(OH)2
其它:H2O
