人教版高一化学必修一教学课件《第二章第三节 氧化还原反应》 (共28张PPT)
文档属性
| 名称 | 人教版高一化学必修一教学课件《第二章第三节 氧化还原反应》 (共28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-23 06:58:58 | ||
图片预览




文档简介
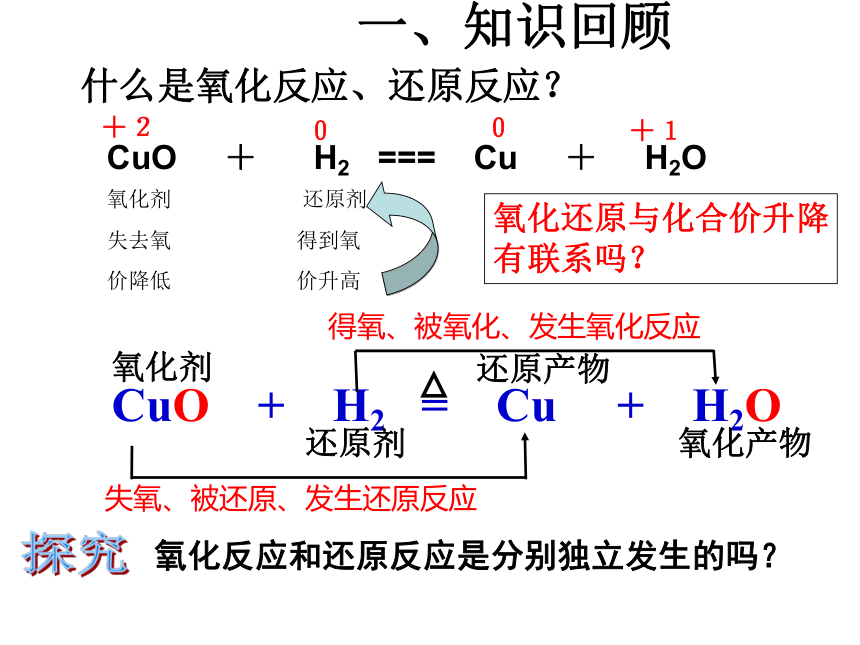
课件28张PPT。氧化还原反应一、知识回顾什么是氧化反应、还原反应?氧化反应和还原反应是分别独立发生的吗?探究+200+1CuO + H2 === Cu + H2O氧化剂还原剂失去氧得到氧价降低价升高氧化还原与化合价升降
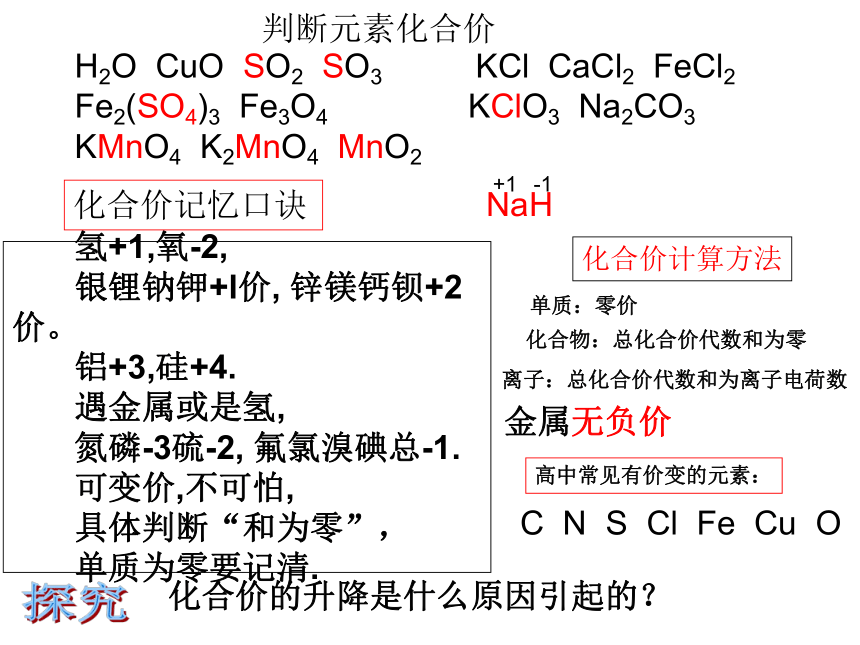
有联系吗?化合价的升降是什么原因引起的?探究H2O CuO SO2 SO3 KCl CaCl2 FeCl2
Fe2(SO4)3 Fe3O4 KClO3 Na2CO3
KMnO4 K2MnO4 MnO2判断元素化合价氢+1,氧-2,
银锂钠钾+l价, 锌镁钙钡+2价。
铝+3,硅+4.
遇金属或是氢,
氮磷-3硫-2, 氟氯溴碘总-1.
可变价,不可怕,
具体判断“和为零”,
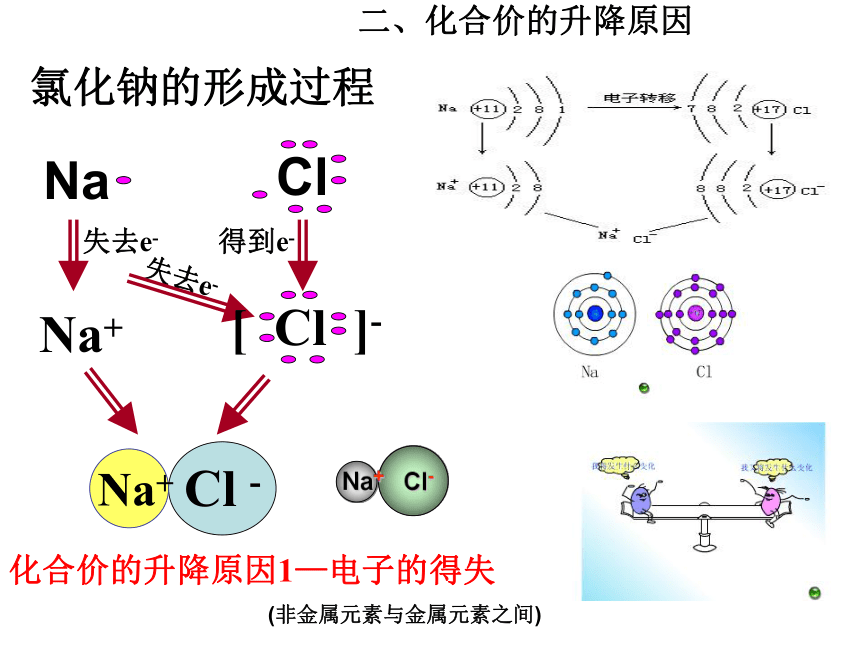
单质为零要记清.化合价记忆口诀 化合价计算方法单质:零价化合物:总化合价代数和为零离子:总化合价代数和为离子电荷数高中常见有价变的元素:C N S Cl Fe Cu O金属无负价NaH+1-1Na+氯化钠的形成过程化合价的升降原因1—电子的得失
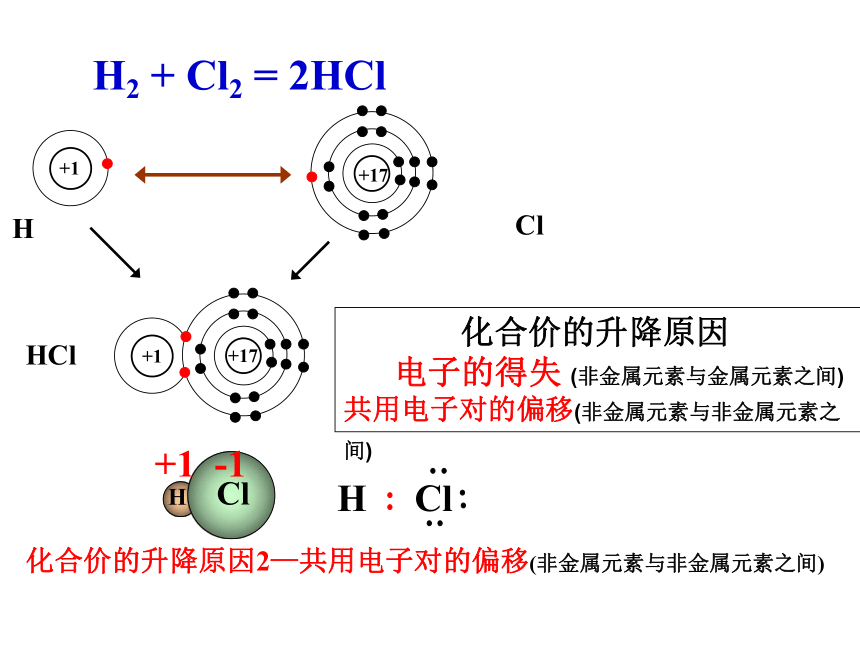
(非金属元素与金属元素之间)281287二、化合价的升降原因H Cl+1 -1 HCl化合价的升降原因2—共用电子对的偏移(非金属元素与非金属元素之间) H2 + Cl2 = 2HCl 化合价的升降原因
电子的得失 (非金属元素与金属元素之间)
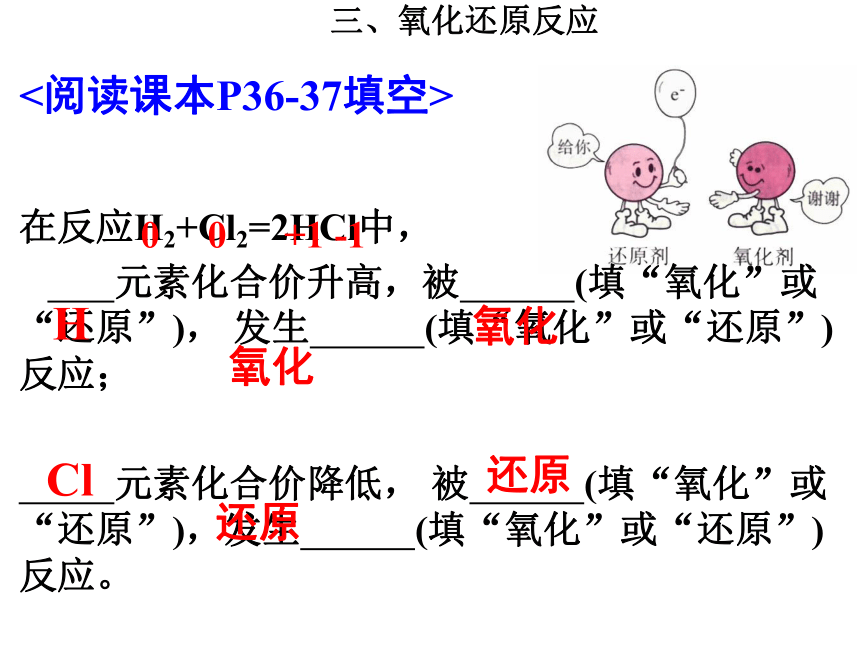
共用电子对的偏移(非金属元素与非金属元素之间) 在反应H2+Cl2=2HCl中,
元素化合价升高,被 (填“氧化”或“还原”), 发生 (填“氧化”或“还原”)反应;
元素化合价降低, 被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。<阅读课本P36-37填空>H氧化氧化Cl还原还原0 0 +1 -1三、氧化还原反应C+O2=CO20 0 +4 -20 0 +2 -2还原反应,化合价降低氧化反应,化合价升高氧化反应,化合价升高还原反应,化合价降低2Mg+O2=2MgO氧化反应,化合价升高H2 + CuO = H2O + Cu还原反应,化合价降低+200+1氧化反应即为化合价升高的反应;
还原反应即为化合价降低的反应。2KMnO4 == K2MnO4 + MnO2 + O2↑+7+6+40-2化合价降低,还原反应化合价升高,氧化反应从化合价的角度分析氧化还原氧化还原反应的几个重要概念1、氧化还原反应:凡是有元素化合价升降的化学反应。3、氧化剂:得电子(有元素价降低)的物质(反应物)。2、还原剂:失电子(有元素价升高)的物质(反应物)。化合价的升降原因 — 电子得失或共用电子对的偏移小结氧化还原反应判断 万能方法 (六根清楚法)氧失升氧还氧对应产物是氧化产物失去电子价升高被氧化还原剂发生氧化反应2H2 + O2 = 2H2O还原剂氧化剂玩湿身,痒痒痒
1、 Fe2O3高温下通CO气体,写出化学方程式:
______________________________________________
指出______元素化合价降低,_____(得、失)电子,
_______发生还原反应,___________是氧化剂,
___________是氧化产物。
______元素化合价升高,_____(得、失)电子,
_______发生氧化反应, __________是还原剂,
__________ 是还原产物。 Fe失Fe2O3Fe2O3CO2C得COCOFe+30+2+4【思考与交流】【思考与交流】2.判断:下列化学属何种基本反应类型?;
是否是氧化还原反应?⑤ Fe + CuSO4 == FeSO4 + Cu0 +2 +2 0⑥MgO+2HCl===MgCl2+H2O0 0 +4 -2②H2O+ CaO == Ca(OH)2+1 -2 0 0(7) CuO+CO===Cu+CO2化合分解置换分解化合复分解化合反应分解反应复分解反应置换反应氧化还原反应非氧化还原反应交叉分类图氧化还原反应与四种基本反应类型的关系正确的是 交叉分类图图1图2牛刀小试考考你(1)双线桥法分析氧化还原反应得失电子数计算公式= a × b × c 四. 氧化还原反应的表示方法注意:画箭头时两端对准同一元素;
线桥跨过等号
箭头上写明电子的得或失,与数目 单位等。元素价变下标3×1×2 e-3×2×1 e-得失标化合价画箭头写得失基本步骤练一练1.用双线桥法分析下列反应。②2KClO3 2KCl+3O2↑④3Cu + 8HNO3(稀) 3Cu(NO3)2+ 2 NO↑+ 4H2O ③ MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑+ 2H2O ?1.用双线桥法分析下列反应。②2KClO3 2KCl+3O2↑④3Cu + 8HNO3(稀) 3Cu(NO3)2+ 2 NO↑+ 4H2O ③ MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑+ H2O ?6×1×2 e-2×3×2 e-得失失失得得1×2×1 e-2×1×1 e-3×1×2 e-2×1×3 e-(2)单线桥法练习:注意:箭头的方向失电子的元素指向得电子的元素; 不用标电子的得与失;线桥不用跨过等号。注意:画箭头时两端对准同一元素;线桥跨过等号
箭头上写明电子的得或失,与数目 单位等。(1)双线桥法3×2×1 e-②2KClO3 2KCl+3O2↑+5-26×1×2 e--10拓展1、氧化性与还原性相对强弱的比较
(相对强弱指得失电子的难易程度)
⑴根据已知的化学方程式
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性:氧化剂(左)>氧化产物(右)
还原性:还原剂(左) >还原产物(左)例: Fe+ Cu2+ = Fe2+ + Cu氧化性:
还原性:Cu2+>Fe2+Fe > Cu0+2+203.已知有如下反应:
①2BrO3- + Cl2 == Br2 + 2ClO3-
②ClO3- + 5Cl- + 6H+ == 3Cl2 + 3H2O
③2FeCl3 + 2KI == 2FeCl2 + 2KCl + I2
④2FeCl2 + Cl2 == 2FeCl3
下列各微粒氧化能力由强到弱的顺序正确的是( )
A、ClO3- > BrO3- > Cl2 >Fe3+ > I2
B、BrO3- > Cl2 > ClO3- >I2 > Fe3+
C、BrO3- > ClO3- > Cl2 >Fe3+ > I2
D、BrO3- > ClO3- > Fe3+ >Cl2 > I2C练一练一般规律:原子与离子性质相反、强弱相反(2)根据金属活动顺序表判断金属活动顺序(单质还原性:价升高):对应阳离子氧化性(价降低):Cu<(H)<Fe<Zn<Al<Mg<NaCu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au(3)根据元素非金属性活动顺序表判断F O Cl Br I S⑴根据已知的化学方程式拓展2 归中反应的价变分析
氧化还原反应中,同一元素的不同价态生成中间某价态。
原理:只靠拢不相交
例:5KCl + KClO3 + 3H2SO4 = 3Cl2 + 3H2O + 3K2SO4
2Na2S + Na2SO3 + 6HCl = 3S + 6NaCl + 3H2O -1+50-2+40-1+50-1+50-1牛刀小试小结 氧化还原反应◆从得氧失氧角度分析
说明:仅局限于得氧失氧的反应。
◆从化合价升降角度分析
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
说明:氧化还原反应的本质是电子转移。
既有物质得到氧又有物质失去氧的反应 氧化还原反应。有元素化合价升降的化学反应是氧化还原反应。有电子转移(得失或偏移)的化学反应是氧化还原反应。还、失、升;氧、氧、氧判断下列反应中的氧化剂、还原剂【思考与探究】② CuSO4 + Fe == FeSO4 + Cu ① 2Na + Cl2 = 2NaCl 氧化剂氧化剂H2O既是氧化剂又是还原剂氧化剂还原剂还原剂还原剂还、失、升;氧、氧、氧1、下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的2、氧化还原反应的实质是 ( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或共用电子对的偏移
D.氧原子的得失DC<感悟新知>还、失、升;氧、氧、氧<感悟新知>C3.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是还、失、升;氧、氧、氧4、实现下列变化,一定要加入其它物质作氧化剂的是( )
A.CaCO3 → CO2
B.NaCl → NaNO3
C.Zn → ZnCl2
D.CuO → CuSO4C<感悟新知>还、失、升;氧、氧、氧0+2<感悟新知>5、在下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中氢元素的化合价发生变化的是( )
A、NaOH + HCl = NaCl + H2O
B、Zn +2HCl = ZnCl2 + H2
C、MnO2 +4HCl(浓)==MnCl2 +2H2O +Cl2
D、CuO + 2HCl = CuCl2 + H2OCB还、失、升;氧、氧、氧
有联系吗?化合价的升降是什么原因引起的?探究H2O CuO SO2 SO3 KCl CaCl2 FeCl2
Fe2(SO4)3 Fe3O4 KClO3 Na2CO3
KMnO4 K2MnO4 MnO2判断元素化合价氢+1,氧-2,
银锂钠钾+l价, 锌镁钙钡+2价。
铝+3,硅+4.
遇金属或是氢,
氮磷-3硫-2, 氟氯溴碘总-1.
可变价,不可怕,
具体判断“和为零”,
单质为零要记清.化合价记忆口诀 化合价计算方法单质:零价化合物:总化合价代数和为零离子:总化合价代数和为离子电荷数高中常见有价变的元素:C N S Cl Fe Cu O金属无负价NaH+1-1Na+氯化钠的形成过程化合价的升降原因1—电子的得失
(非金属元素与金属元素之间)281287二、化合价的升降原因H Cl+1 -1 HCl化合价的升降原因2—共用电子对的偏移(非金属元素与非金属元素之间) H2 + Cl2 = 2HCl 化合价的升降原因
电子的得失 (非金属元素与金属元素之间)
共用电子对的偏移(非金属元素与非金属元素之间) 在反应H2+Cl2=2HCl中,
元素化合价升高,被 (填“氧化”或“还原”), 发生 (填“氧化”或“还原”)反应;
元素化合价降低, 被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。<阅读课本P36-37填空>H氧化氧化Cl还原还原0 0 +1 -1三、氧化还原反应C+O2=CO20 0 +4 -20 0 +2 -2还原反应,化合价降低氧化反应,化合价升高氧化反应,化合价升高还原反应,化合价降低2Mg+O2=2MgO氧化反应,化合价升高H2 + CuO = H2O + Cu还原反应,化合价降低+200+1氧化反应即为化合价升高的反应;
还原反应即为化合价降低的反应。2KMnO4 == K2MnO4 + MnO2 + O2↑+7+6+40-2化合价降低,还原反应化合价升高,氧化反应从化合价的角度分析氧化还原氧化还原反应的几个重要概念1、氧化还原反应:凡是有元素化合价升降的化学反应。3、氧化剂:得电子(有元素价降低)的物质(反应物)。2、还原剂:失电子(有元素价升高)的物质(反应物)。化合价的升降原因 — 电子得失或共用电子对的偏移小结氧化还原反应判断 万能方法 (六根清楚法)氧失升氧还氧对应产物是氧化产物失去电子价升高被氧化还原剂发生氧化反应2H2 + O2 = 2H2O还原剂氧化剂玩湿身,痒痒痒
1、 Fe2O3高温下通CO气体,写出化学方程式:
______________________________________________
指出______元素化合价降低,_____(得、失)电子,
_______发生还原反应,___________是氧化剂,
___________是氧化产物。
______元素化合价升高,_____(得、失)电子,
_______发生氧化反应, __________是还原剂,
__________ 是还原产物。 Fe失Fe2O3Fe2O3CO2C得COCOFe+30+2+4【思考与交流】【思考与交流】2.判断:下列化学属何种基本反应类型?;
是否是氧化还原反应?⑤ Fe + CuSO4 == FeSO4 + Cu0 +2 +2 0⑥MgO+2HCl===MgCl2+H2O0 0 +4 -2②H2O+ CaO == Ca(OH)2+1 -2 0 0(7) CuO+CO===Cu+CO2化合分解置换分解化合复分解化合反应分解反应复分解反应置换反应氧化还原反应非氧化还原反应交叉分类图氧化还原反应与四种基本反应类型的关系正确的是 交叉分类图图1图2牛刀小试考考你(1)双线桥法分析氧化还原反应得失电子数计算公式= a × b × c 四. 氧化还原反应的表示方法注意:画箭头时两端对准同一元素;
线桥跨过等号
箭头上写明电子的得或失,与数目 单位等。元素价变下标3×1×2 e-3×2×1 e-得失标化合价画箭头写得失基本步骤练一练1.用双线桥法分析下列反应。②2KClO3 2KCl+3O2↑④3Cu + 8HNO3(稀) 3Cu(NO3)2+ 2 NO↑+ 4H2O ③ MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑+ 2H2O ?1.用双线桥法分析下列反应。②2KClO3 2KCl+3O2↑④3Cu + 8HNO3(稀) 3Cu(NO3)2+ 2 NO↑+ 4H2O ③ MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑+ H2O ?6×1×2 e-2×3×2 e-得失失失得得1×2×1 e-2×1×1 e-3×1×2 e-2×1×3 e-(2)单线桥法练习:注意:箭头的方向失电子的元素指向得电子的元素; 不用标电子的得与失;线桥不用跨过等号。注意:画箭头时两端对准同一元素;线桥跨过等号
箭头上写明电子的得或失,与数目 单位等。(1)双线桥法3×2×1 e-②2KClO3 2KCl+3O2↑+5-26×1×2 e--10拓展1、氧化性与还原性相对强弱的比较
(相对强弱指得失电子的难易程度)
⑴根据已知的化学方程式
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性:氧化剂(左)>氧化产物(右)
还原性:还原剂(左) >还原产物(左)例: Fe+ Cu2+ = Fe2+ + Cu氧化性:
还原性:Cu2+>Fe2+Fe > Cu0+2+203.已知有如下反应:
①2BrO3- + Cl2 == Br2 + 2ClO3-
②ClO3- + 5Cl- + 6H+ == 3Cl2 + 3H2O
③2FeCl3 + 2KI == 2FeCl2 + 2KCl + I2
④2FeCl2 + Cl2 == 2FeCl3
下列各微粒氧化能力由强到弱的顺序正确的是( )
A、ClO3- > BrO3- > Cl2 >Fe3+ > I2
B、BrO3- > Cl2 > ClO3- >I2 > Fe3+
C、BrO3- > ClO3- > Cl2 >Fe3+ > I2
D、BrO3- > ClO3- > Fe3+ >Cl2 > I2C练一练一般规律:原子与离子性质相反、强弱相反(2)根据金属活动顺序表判断金属活动顺序(单质还原性:价升高):对应阳离子氧化性(价降低):Cu<(H)<Fe<Zn<Al<Mg<NaCu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au(3)根据元素非金属性活动顺序表判断F O Cl Br I S⑴根据已知的化学方程式拓展2 归中反应的价变分析
氧化还原反应中,同一元素的不同价态生成中间某价态。
原理:只靠拢不相交
例:5KCl + KClO3 + 3H2SO4 = 3Cl2 + 3H2O + 3K2SO4
2Na2S + Na2SO3 + 6HCl = 3S + 6NaCl + 3H2O -1+50-2+40-1+50-1+50-1牛刀小试小结 氧化还原反应◆从得氧失氧角度分析
说明:仅局限于得氧失氧的反应。
◆从化合价升降角度分析
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
说明:氧化还原反应的本质是电子转移。
既有物质得到氧又有物质失去氧的反应 氧化还原反应。有元素化合价升降的化学反应是氧化还原反应。有电子转移(得失或偏移)的化学反应是氧化还原反应。还、失、升;氧、氧、氧判断下列反应中的氧化剂、还原剂【思考与探究】② CuSO4 + Fe == FeSO4 + Cu ① 2Na + Cl2 = 2NaCl 氧化剂氧化剂H2O既是氧化剂又是还原剂氧化剂还原剂还原剂还原剂还、失、升;氧、氧、氧1、下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的2、氧化还原反应的实质是 ( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或共用电子对的偏移
D.氧原子的得失DC<感悟新知>还、失、升;氧、氧、氧<感悟新知>C3.某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是还、失、升;氧、氧、氧4、实现下列变化,一定要加入其它物质作氧化剂的是( )
A.CaCO3 → CO2
B.NaCl → NaNO3
C.Zn → ZnCl2
D.CuO → CuSO4C<感悟新知>还、失、升;氧、氧、氧0+2<感悟新知>5、在下列反应中,HCl中氯元素的化合价发生变化的是( ),HCl中氢元素的化合价发生变化的是( )
A、NaOH + HCl = NaCl + H2O
B、Zn +2HCl = ZnCl2 + H2
C、MnO2 +4HCl(浓)==MnCl2 +2H2O +Cl2
D、CuO + 2HCl = CuCl2 + H2OCB还、失、升;氧、氧、氧
