高中化学选修四《3.1 弱电解质的电离》课件 (共31张PPT)
文档属性
| 名称 | 高中化学选修四《3.1 弱电解质的电离》课件 (共31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 939.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-23 00:00:00 | ||
图片预览









文档简介
课件31张PPT。弱电解质的电离公开课教案
课题:第三章 第一节? 弱电解质的电离
班级:高二(12)班
授课人:
时间:2015年3月21日第三节课
弱电解质的电离2018/11/113思考:1 、什么叫电解质?试举例说明。 知识回顾:电解质:在水溶液中或熔化状态下能够导电
的化合物。思考:2 、什么叫非电解质?试举例说明。非电解质:在水溶液中和熔化状态下都不能够导电的化合物。弱电解质的电离2018/11/114
例如:
电解质:酸 碱 盐,H2O
非电解质:大多数有机物,SO3、CO2等
说明:溶液导电与否是由内外因共同作用的结果,内因为必须有电解质,外因在水的作用下两者缺一不可,可用下列图示表示:
电解质 电离 导电
溶液导电性强弱是由溶液中自由移动离子浓度和所带电荷数决定。弱电解质的电离2018/11/115等浓度的盐酸、醋酸溶液中的H+浓度的大小? 醋酸和盐酸是常见的两种酸,根据你的经
验,你认为它们的电离程度有无差异?
你能设计实验验证你的猜想吗?请写出实
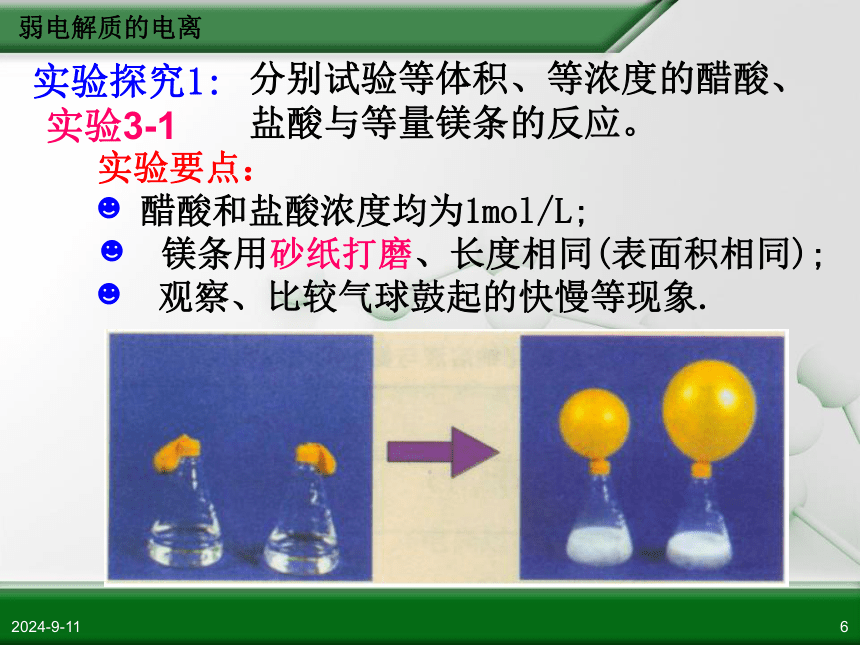
验方案并与大家交流。 弱电解质的电离2018/11/116实验探究1:分别试验等体积、等浓度的醋酸、盐酸与等量镁条的反应。实验要点:
醋酸和盐酸浓度均为1mol/L;
镁条用砂纸打磨、长度相同(表面积相同);
观察、比较气球鼓起的快慢等现象.实验3-1弱电解质的电离2018/11/117 镁与等浓度的盐酸、醋酸反应
的速率, 前者快于后者。 镁与盐酸反应非常剧烈,产生大量的气泡,气球鼓起很快。等浓度的盐酸中c(H+)比醋酸大.镁与醋酸反应较快,产生气泡,
气球鼓起较慢。弱电解质的电离2018/11/118实验探究2:用pH试纸测定1mol/L的盐酸、醋酸pH。实验数据:pH(HCl) = 0 pH(CH3COOH) = 2 数据处理: 结 论: 盐酸完全电离, 电离程度(即电离度)为100%;
醋酸不完全电离, 电离程度较小,且小于100%,
即醋酸的电离是可逆的。0.1mol/L HCl c(H+) = 1mol/L
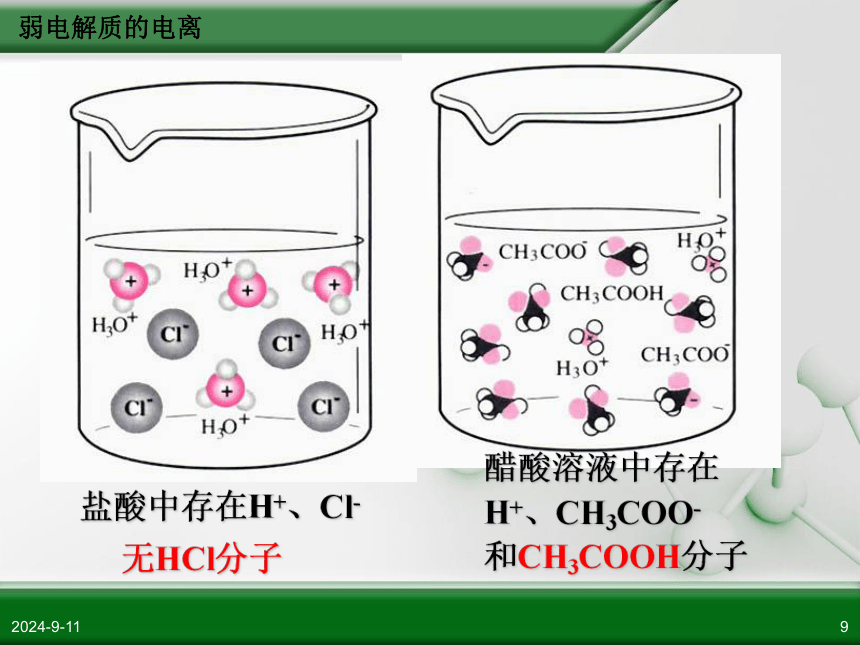
0.1mol/L CH3COOH c(H+) = 0.01mol/L 弱电解质的电离2018/11/119盐酸中存在H+、Cl-
无HCl分子醋酸溶液中存在
H+、CH3COO-
和CH3COOH分子弱电解质的电离2018/11/1110强电解质:包括:强酸、强碱、大多数盐类包括: 弱酸 (如CH3COOH)、
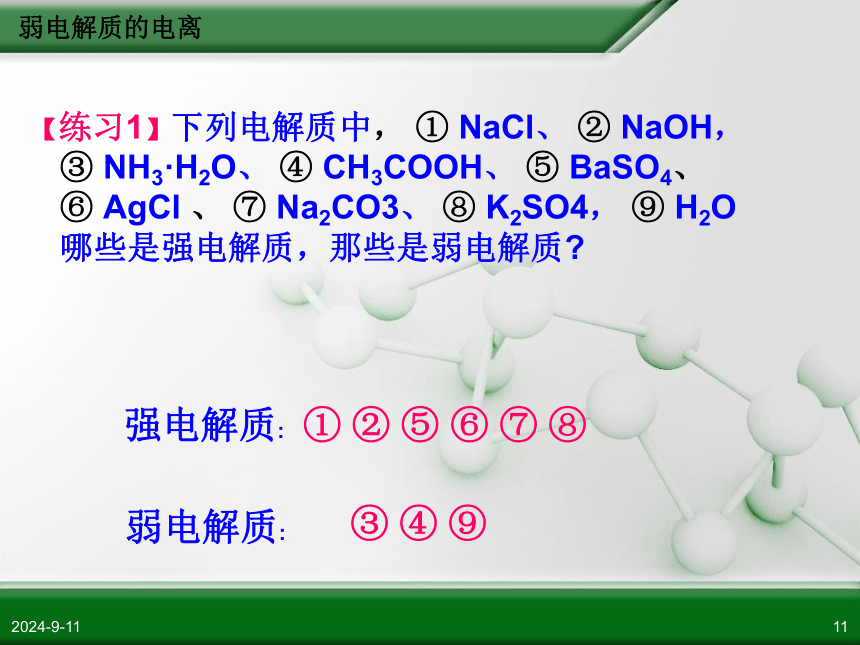
弱碱 (如NH3·H2O) 、水HCl = H+ + Cl– 能全部电离的电解质称强电解质. 不完全电离的电解质称弱电解质.CH3COOH H+ + CH3COO– 弱电解质:1、概念一、强弱电解质弱电解质的电离2018/11/1111【练习1】下列电解质中, ① NaCl、 ② NaOH, ③ NH3·H2O、 ④ CH3COOH、 ⑤ BaSO4、 ⑥ AgCl 、 ⑦ Na2CO3、 ⑧ K2SO4, ⑨ H2O 哪些是强电解质,那些是弱电解质?① ② ⑤ ⑥ ⑦ ⑧
弱电解质:
③ ④ ⑨
强电解质:
弱电解质的电离2018/11/11122、电离方程式的书写强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸分步电离,可分步书写电离方程式(一般只写第一步),多元弱碱也是分步电离,但可按一步电离写出。NaCl = Na++Cl-弱电解质的电离2018/11/1113 小练: 请写出Na2SO4、HClO、NH3·H2O 、H2CO3、Fe(OH)3 在水溶液中的电离方程式。Na2SO4 = 2Na+ +SO42-HClO H++ClO-NH3·H2O NH4++OH-H2CO3 H++HCO3-HCO3- H++CO32-Fe(OH)3 Fe3++3OH-弱电解质的电离2018/11/1114【练习2】写出下列物质的电离方程式
(1) HF
(2) KHSO4
(3) CaCO3
(4) Cu(OH)2
H + +F-=K + +H + +SO42-= Ca2+ +CO32-Cu 2+ +2OH-
弱电解质的电离2018/11/1115 强等号、弱可逆、多元弱酸分步写,多元弱碱一步完弱电解质的电离2018/11/1116 电解质的强弱与其溶解度有何关系?
电解质的强弱与其水溶液的导电能力
有何关系?强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离。问题探讨CaCO3、Fe(OH)3的溶解度都很小,CaCO3属于强电解质,而Fe(OH)3属于弱电解质;CH3COOH、HCl的溶解度都很大,HCl属于强电解质,而CH3COOH 属于弱电解质。弱电解质的电离2018/11/1117我明白了:
强弱电解质≠溶液的导电能力强弱
强弱电解质≠物质的溶解性大小
弱电解质的电离2018/11/1118【练习3】讨论以下两种说法是否正确,并说明原因:
①石墨、铜、铝合金都能导电,所以它们都是
电解质。
②强电解质溶液的导电能力一定强于弱电解
质溶液的导电能力。①电解质的研究对象是化合物,所以单质、
混合物都不是电解质。②导电能力和溶液中离子浓度有关,而强弱电
解质是指电离能力的。弱电解质的电离2018/11/1119 思考与交流: (1)当醋酸溶于水后, V(电离)和 V(结合) 怎
样变化?二、弱电解质的电离平衡 (2) 当V(电离) = V(结合) 时,可逆过程达到一
种怎样的状态?画出V~t图。 CH3COO - + H+ → CH3COOH CH3COOH → CH3COO - + H+弱电解质的电离2018/11/1120V电离V结合V电离=V结合≠ 0 t1电离平衡状态弱电解质电离的V-t图像弱电解质的电离2018/11/11212.特征 1.定义:在一定条件(如温度、浓度)下,当电解质
分子电离成离子的速率和离子重新结合成
分子的速率相等时, 电离过程就达到了平
衡状态 ― 电离平衡动:电离平衡是一种动态平衡 定:条件不变,溶液中各分子、离子的浓
度不变,溶液里既有离子又有分子.变: 条件改变时,电离平衡发生移动。 等:V电离 = V结合≠0逆:弱电解质的电离是可逆过程弱电解质的电离2018/11/1122思考与交流: 根据上图及化学平衡理论,分析一元弱酸(HA) 一元弱碱(BOH)的电离平衡过程,并完成问题: 1.写出电离方程式 2.填表接近于0接近于0最大增大增大减小不变不变不变弱电解质的电离2018/11/1123最大最大最小减小减小增大弱电解质的电离2018/11/11243.影响电离平衡的条件
(1)内因:电解质本身的性质。通常电解质越弱电离程 度越小。(2) 影响电离平衡移动的条件——外因②温度:电离过程是吸热过程,温度升高,平衡向电离方向移动。③浓度:溶液稀释平衡向电离方向移动 ①加入试剂:加入增大弱电解质电离出离子浓度的物质,
使电离平衡向逆方向移动 加入减小弱电解质电离出离子浓度的物质,
使电离平衡向电离方向移动电离平衡和化学平衡一样,当外界条件改变时符合勒沙特列原理。弱电解质的电离2018/11/1125【练习4】填写乙酸溶液电离平衡影响的因素CH3COOHCH3COOHCH3COO-
H+
H+逆方向逆方向增大增大增大增大增大增大增大增大减少减少减少减少减少减少减少正方向正方向正方向——正方向增大减少增大弱电解质的电离2018/11/1126
【练习5】有物质的量浓度相同、体积相等的三种酸:a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率________。(用<、=、> 表示)b>a>c【练习6】把0.05 mol NaOH固体分别加入100 mL下列液体中,溶液的导电性变化不大的是( )
A.自来水
B. 0.5 mol/L NH4Cl溶液
C. 0.5 mol/L 醋酸
D. 0.5 mol/L 盐酸 BD弱电解质的电离2018/11/1127知识网络弱电解质的电离弱电解质电离平衡电离
特点1)部分电离
2)存在电解质分子和阴阳离子
3)电离方程式用“ ”连接举例:弱酸、弱碱、水特点:逆、等、动、定、变影响因素温度
浓度
同离子效应 弱电解质的电离弱电解质的电离
布置作业:ⅠP43-44 1、2、3
Ⅱ完成《全品测评卷》同步练习
Ⅲ自主学习:P42-43《科学探究》--电离常数2018/11/1129Thanks
谢谢您的观看!弱电解质的电离弱电解质的电离
课题:第三章 第一节? 弱电解质的电离
班级:高二(12)班
授课人:
时间:2015年3月21日第三节课
弱电解质的电离2018/11/113思考:1 、什么叫电解质?试举例说明。 知识回顾:电解质:在水溶液中或熔化状态下能够导电
的化合物。思考:2 、什么叫非电解质?试举例说明。非电解质:在水溶液中和熔化状态下都不能够导电的化合物。弱电解质的电离2018/11/114
例如:
电解质:酸 碱 盐,H2O
非电解质:大多数有机物,SO3、CO2等
说明:溶液导电与否是由内外因共同作用的结果,内因为必须有电解质,外因在水的作用下两者缺一不可,可用下列图示表示:
电解质 电离 导电
溶液导电性强弱是由溶液中自由移动离子浓度和所带电荷数决定。弱电解质的电离2018/11/115等浓度的盐酸、醋酸溶液中的H+浓度的大小? 醋酸和盐酸是常见的两种酸,根据你的经
验,你认为它们的电离程度有无差异?
你能设计实验验证你的猜想吗?请写出实
验方案并与大家交流。 弱电解质的电离2018/11/116实验探究1:分别试验等体积、等浓度的醋酸、盐酸与等量镁条的反应。实验要点:
醋酸和盐酸浓度均为1mol/L;
镁条用砂纸打磨、长度相同(表面积相同);
观察、比较气球鼓起的快慢等现象.实验3-1弱电解质的电离2018/11/117 镁与等浓度的盐酸、醋酸反应
的速率, 前者快于后者。 镁与盐酸反应非常剧烈,产生大量的气泡,气球鼓起很快。等浓度的盐酸中c(H+)比醋酸大.镁与醋酸反应较快,产生气泡,
气球鼓起较慢。弱电解质的电离2018/11/118实验探究2:用pH试纸测定1mol/L的盐酸、醋酸pH。实验数据:pH(HCl) = 0 pH(CH3COOH) = 2 数据处理: 结 论: 盐酸完全电离, 电离程度(即电离度)为100%;
醋酸不完全电离, 电离程度较小,且小于100%,
即醋酸的电离是可逆的。0.1mol/L HCl c(H+) = 1mol/L
0.1mol/L CH3COOH c(H+) = 0.01mol/L 弱电解质的电离2018/11/119盐酸中存在H+、Cl-
无HCl分子醋酸溶液中存在
H+、CH3COO-
和CH3COOH分子弱电解质的电离2018/11/1110强电解质:包括:强酸、强碱、大多数盐类包括: 弱酸 (如CH3COOH)、
弱碱 (如NH3·H2O) 、水HCl = H+ + Cl– 能全部电离的电解质称强电解质. 不完全电离的电解质称弱电解质.CH3COOH H+ + CH3COO– 弱电解质:1、概念一、强弱电解质弱电解质的电离2018/11/1111【练习1】下列电解质中, ① NaCl、 ② NaOH, ③ NH3·H2O、 ④ CH3COOH、 ⑤ BaSO4、 ⑥ AgCl 、 ⑦ Na2CO3、 ⑧ K2SO4, ⑨ H2O 哪些是强电解质,那些是弱电解质?① ② ⑤ ⑥ ⑦ ⑧
弱电解质:
③ ④ ⑨
强电解质:
弱电解质的电离2018/11/11122、电离方程式的书写强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸分步电离,可分步书写电离方程式(一般只写第一步),多元弱碱也是分步电离,但可按一步电离写出。NaCl = Na++Cl-弱电解质的电离2018/11/1113 小练: 请写出Na2SO4、HClO、NH3·H2O 、H2CO3、Fe(OH)3 在水溶液中的电离方程式。Na2SO4 = 2Na+ +SO42-HClO H++ClO-NH3·H2O NH4++OH-H2CO3 H++HCO3-HCO3- H++CO32-Fe(OH)3 Fe3++3OH-弱电解质的电离2018/11/1114【练习2】写出下列物质的电离方程式
(1) HF
(2) KHSO4
(3) CaCO3
(4) Cu(OH)2
H + +F-=K + +H + +SO42-= Ca2+ +CO32-Cu 2+ +2OH-
弱电解质的电离2018/11/1115 强等号、弱可逆、多元弱酸分步写,多元弱碱一步完弱电解质的电离2018/11/1116 电解质的强弱与其溶解度有何关系?
电解质的强弱与其水溶液的导电能力
有何关系?强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离。问题探讨CaCO3、Fe(OH)3的溶解度都很小,CaCO3属于强电解质,而Fe(OH)3属于弱电解质;CH3COOH、HCl的溶解度都很大,HCl属于强电解质,而CH3COOH 属于弱电解质。弱电解质的电离2018/11/1117我明白了:
强弱电解质≠溶液的导电能力强弱
强弱电解质≠物质的溶解性大小
弱电解质的电离2018/11/1118【练习3】讨论以下两种说法是否正确,并说明原因:
①石墨、铜、铝合金都能导电,所以它们都是
电解质。
②强电解质溶液的导电能力一定强于弱电解
质溶液的导电能力。①电解质的研究对象是化合物,所以单质、
混合物都不是电解质。②导电能力和溶液中离子浓度有关,而强弱电
解质是指电离能力的。弱电解质的电离2018/11/1119 思考与交流: (1)当醋酸溶于水后, V(电离)和 V(结合) 怎
样变化?二、弱电解质的电离平衡 (2) 当V(电离) = V(结合) 时,可逆过程达到一
种怎样的状态?画出V~t图。 CH3COO - + H+ → CH3COOH CH3COOH → CH3COO - + H+弱电解质的电离2018/11/1120V电离V结合V电离=V结合≠ 0 t1电离平衡状态弱电解质电离的V-t图像弱电解质的电离2018/11/11212.特征 1.定义:在一定条件(如温度、浓度)下,当电解质
分子电离成离子的速率和离子重新结合成
分子的速率相等时, 电离过程就达到了平
衡状态 ― 电离平衡动:电离平衡是一种动态平衡 定:条件不变,溶液中各分子、离子的浓
度不变,溶液里既有离子又有分子.变: 条件改变时,电离平衡发生移动。 等:V电离 = V结合≠0逆:弱电解质的电离是可逆过程弱电解质的电离2018/11/1122思考与交流: 根据上图及化学平衡理论,分析一元弱酸(HA) 一元弱碱(BOH)的电离平衡过程,并完成问题: 1.写出电离方程式 2.填表接近于0接近于0最大增大增大减小不变不变不变弱电解质的电离2018/11/1123最大最大最小减小减小增大弱电解质的电离2018/11/11243.影响电离平衡的条件
(1)内因:电解质本身的性质。通常电解质越弱电离程 度越小。(2) 影响电离平衡移动的条件——外因②温度:电离过程是吸热过程,温度升高,平衡向电离方向移动。③浓度:溶液稀释平衡向电离方向移动 ①加入试剂:加入增大弱电解质电离出离子浓度的物质,
使电离平衡向逆方向移动 加入减小弱电解质电离出离子浓度的物质,
使电离平衡向电离方向移动电离平衡和化学平衡一样,当外界条件改变时符合勒沙特列原理。弱电解质的电离2018/11/1125【练习4】填写乙酸溶液电离平衡影响的因素CH3COOHCH3COOHCH3COO-
H+
H+逆方向逆方向增大增大增大增大增大增大增大增大减少减少减少减少减少减少减少正方向正方向正方向——正方向增大减少增大弱电解质的电离2018/11/1126
【练习5】有物质的量浓度相同、体积相等的三种酸:a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率________。(用<、=、> 表示)b>a>c【练习6】把0.05 mol NaOH固体分别加入100 mL下列液体中,溶液的导电性变化不大的是( )
A.自来水
B. 0.5 mol/L NH4Cl溶液
C. 0.5 mol/L 醋酸
D. 0.5 mol/L 盐酸 BD弱电解质的电离2018/11/1127知识网络弱电解质的电离弱电解质电离平衡电离
特点1)部分电离
2)存在电解质分子和阴阳离子
3)电离方程式用“ ”连接举例:弱酸、弱碱、水特点:逆、等、动、定、变影响因素温度
浓度
同离子效应 弱电解质的电离弱电解质的电离
布置作业:ⅠP43-44 1、2、3
Ⅱ完成《全品测评卷》同步练习
Ⅲ自主学习:P42-43《科学探究》--电离常数2018/11/1129Thanks
谢谢您的观看!弱电解质的电离弱电解质的电离
