高中化学必修2课件:1-1 第一节《元素周期表》课时2
文档属性
| 名称 | 高中化学必修2课件:1-1 第一节《元素周期表》课时2 |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-23 20:07:36 | ||
图片预览





文档简介
课件22张PPT。第一节 元素周期表第2课时 碱金属元素的性质与原子结构第一章 物质结构元素周期律1.掌握碱金属单质的主要性质及其递变规律。
2.初步掌握主族元素原子结构与元素性质的内在联系。 本课设计主线:原子结构——化学性质——物理性质——总结升华。课题以设问的形式引导学生观察碱金属原子结构的异同点,并根据结构推测化学性质,接着用实验、资料分析的方法验证其相似性及递变性;从而总结出碱金属元素化学性质的相似与递变规律。之后阅读教材碱金属的物理性质,归纳物理性质的相似和递变规律。最后采用表格的形式归纳总结碱金属的结构、性质的递变规律,并设计精选习题培养学生应用知识的能力。
碱金属化学性质的学习,注重从结构决定性质的角度入手,结合结构推测其化学性质,并用实验、资料分析的方法验证其化学性质的相似性及递变性。碱金属物理性质的学习采用学生自主学习阅读教材并归纳,有助于锻炼学生比较、分析归纳总结的能力。碱金属元素单质Li
Na
K
Rb
Cs
Fr1.元素的原子结构和元素的性质之间有什么关系呢?
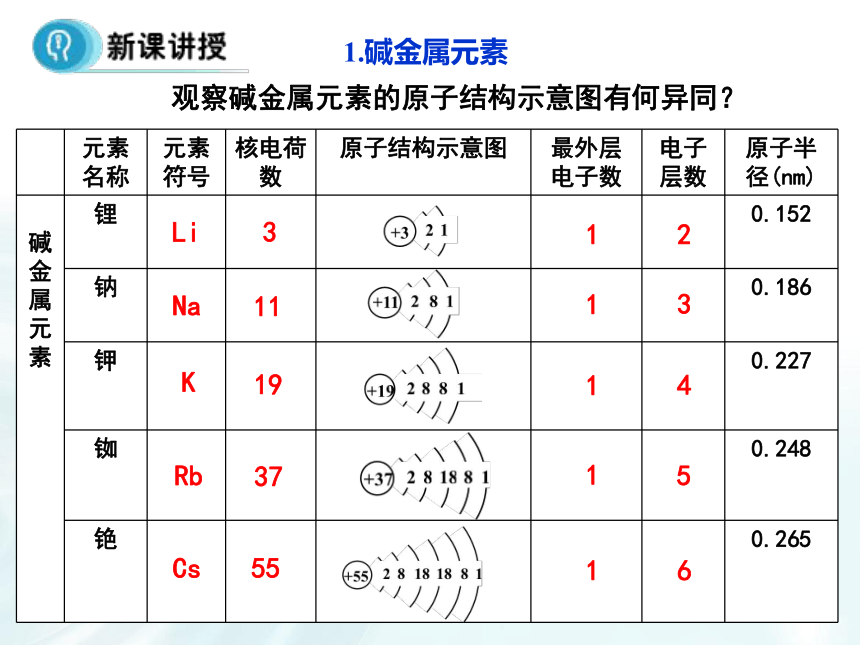
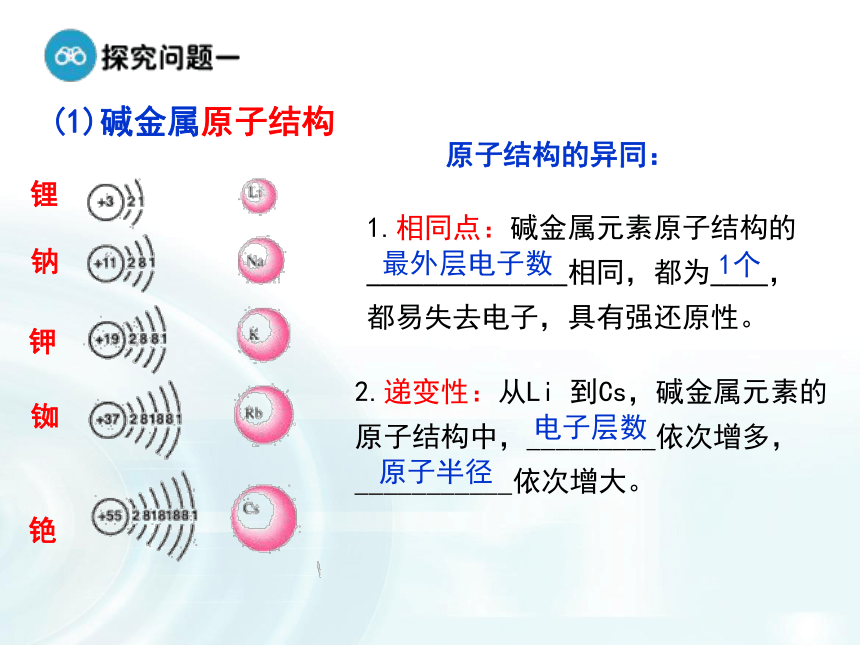
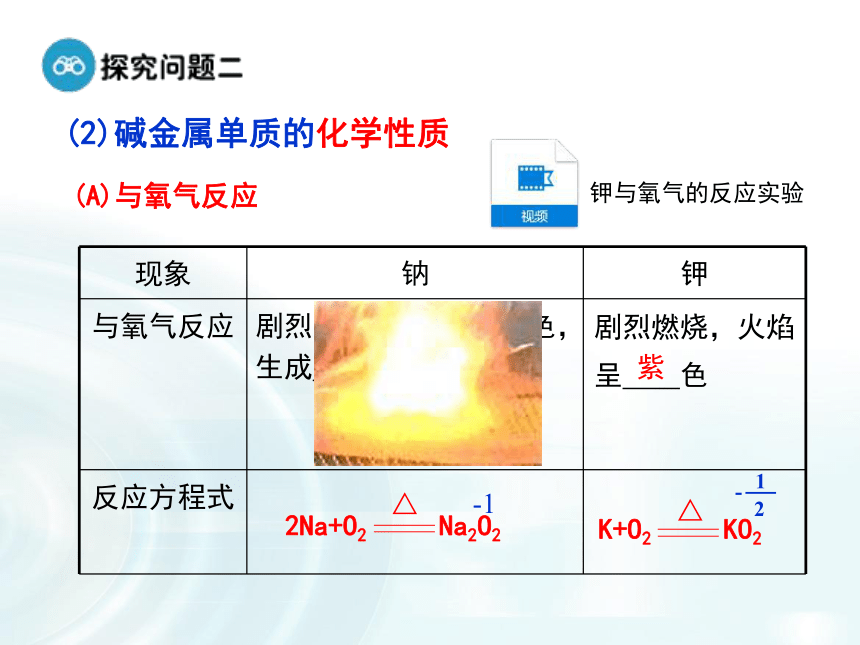
2.我们把ⅠA 族(除氢)称为碱金属,为什么要把它们编在一个族呢?1.碱金属元素观察碱金属元素的原子结构示意图有何异同?(1)碱金属原子结构原子结构的异同:1.相同点:碱金属元素原子结构的______________相同,都为____,都易失去电子,具有强还原性。2.递变性:从Li 到Cs,碱金属元素的原子结构中,_________依次增多,___________依次增大。最外层电子数1个电子层数原子半径结构决定性质,可否从碱金属原子的结构角度推测其化学性质如何?又是否完全相同?失去1个电子+1价阳离子表现出还原性可与非金属、水等反应(2)碱金属单质的化学性质(A)与氧气反应黄淡黄-1剧烈燃烧,火焰
呈 色
紫钾与氧气的反应实验从Li到Cs,随电子层数的递增,还原性(金属性)逐渐增强.(B)与水反应浮、熔、游、响、红浮、熔、游、响、红,有微弱爆炸 2Na + 2H2O
2NaOH + H2↑2K + 2H2O
2KOH + H2↑钾钠、钾与水反应的实验对比请描述钠与水反应的实验操作及现象;从Li到Cs,随电子层数的递增,还原性(金属性)逐渐增强。会反应,比Na缓慢 遇水燃烧,甚至爆炸 对应的碱和氢气2M + 2H2O 2MOH + H2↑
(M=Li, Na, K, Rb, Cs)(B)与水反应碱性逐渐增强(1)碱金属元素结构和化学性质的相似性和递变性Li Na K Rb Cs1.相似性:最外层上都只有一个电子化学性质相似1) 易失去电子,表现出强还原性2)化合物中均显+1价2.递变性:核电荷数↑电子层数↑原子半径↑核对最外层电子的引力↓失电子能力↑还原性↑金属性↑牢记规律在元素周期表中,同主族元素从上到下原子核外电子层数依次______,原子半径逐渐______,失电子能力逐渐______,金属性逐渐______。还原性:Li < Na < K < Rb < Cs氧化性:Li +< Na+ < K+ < Rb+ < Cs+易失难得增多增大增强增强KRbCs(1)碱金属单质的物理性质阅读P7,试着归纳碱金属物理性质的相似性和递变性Li表1-1 碱金属的主要性质最轻的金属,保存在石蜡里密度反常,比钠的密度小熔沸点逐渐降低碱金属物理性质的递变规律柔软较小较低强逐渐增大(K特殊)逐渐降低均为银白色(Cs略带金色)碱金属元素的递变规律增
加增
加增
加减
弱增
强增
大
(K
除
外)降
低增
强1.锂是世界上最轻的金属,它属于碱金属的一种。下列关于碱金属的说法正确的是( )
A.和锂同一主族的都是金属元素
B.Na+比Li多一个电子层
C.Li+、Na+、K+、Rb+的最外层都有8个电子
D.Li是碱金属中原子半径最小的原子HDNa+有两个电子层,Li有两个电子层Li+最外层只有2个电子2.下列对碱金属性质的叙述中正确的是( )
A.碱金属元素的单质具有强还原性,可置换出硫酸铜溶液中的铜单质
B.单质在空气中燃烧生成的都是过氧化物
C.碱金属单质与水反应生成碱和氢气
D.单质熔、沸点随着原子序数递增而升高CLi燃烧后生成物只有Li2O熔、沸点在逐渐降低碱金属单质还原性强,会首先与水反应2M+2H2O 2MOH+H2↑(M=Li, Na, K, Rb, Cs)3.下列关于碱金属某些性质的排序中,正确的是( )
A.还原性:Li>Na>K>Rb>Cs
B.密度:LiC.熔点、沸点: LiD.原子半径: LiA.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸.C氧化物种类增多
2.初步掌握主族元素原子结构与元素性质的内在联系。 本课设计主线:原子结构——化学性质——物理性质——总结升华。课题以设问的形式引导学生观察碱金属原子结构的异同点,并根据结构推测化学性质,接着用实验、资料分析的方法验证其相似性及递变性;从而总结出碱金属元素化学性质的相似与递变规律。之后阅读教材碱金属的物理性质,归纳物理性质的相似和递变规律。最后采用表格的形式归纳总结碱金属的结构、性质的递变规律,并设计精选习题培养学生应用知识的能力。
碱金属化学性质的学习,注重从结构决定性质的角度入手,结合结构推测其化学性质,并用实验、资料分析的方法验证其化学性质的相似性及递变性。碱金属物理性质的学习采用学生自主学习阅读教材并归纳,有助于锻炼学生比较、分析归纳总结的能力。碱金属元素单质Li
Na
K
Rb
Cs
Fr1.元素的原子结构和元素的性质之间有什么关系呢?
2.我们把ⅠA 族(除氢)称为碱金属,为什么要把它们编在一个族呢?1.碱金属元素观察碱金属元素的原子结构示意图有何异同?(1)碱金属原子结构原子结构的异同:1.相同点:碱金属元素原子结构的______________相同,都为____,都易失去电子,具有强还原性。2.递变性:从Li 到Cs,碱金属元素的原子结构中,_________依次增多,___________依次增大。最外层电子数1个电子层数原子半径结构决定性质,可否从碱金属原子的结构角度推测其化学性质如何?又是否完全相同?失去1个电子+1价阳离子表现出还原性可与非金属、水等反应(2)碱金属单质的化学性质(A)与氧气反应黄淡黄-1剧烈燃烧,火焰
呈 色
紫钾与氧气的反应实验从Li到Cs,随电子层数的递增,还原性(金属性)逐渐增强.(B)与水反应浮、熔、游、响、红浮、熔、游、响、红,有微弱爆炸 2Na + 2H2O
2NaOH + H2↑2K + 2H2O
2KOH + H2↑钾钠、钾与水反应的实验对比请描述钠与水反应的实验操作及现象;从Li到Cs,随电子层数的递增,还原性(金属性)逐渐增强。会反应,比Na缓慢 遇水燃烧,甚至爆炸 对应的碱和氢气2M + 2H2O 2MOH + H2↑
(M=Li, Na, K, Rb, Cs)(B)与水反应碱性逐渐增强(1)碱金属元素结构和化学性质的相似性和递变性Li Na K Rb Cs1.相似性:最外层上都只有一个电子化学性质相似1) 易失去电子,表现出强还原性2)化合物中均显+1价2.递变性:核电荷数↑电子层数↑原子半径↑核对最外层电子的引力↓失电子能力↑还原性↑金属性↑牢记规律在元素周期表中,同主族元素从上到下原子核外电子层数依次______,原子半径逐渐______,失电子能力逐渐______,金属性逐渐______。还原性:Li < Na < K < Rb < Cs氧化性:Li +< Na+ < K+ < Rb+ < Cs+易失难得增多增大增强增强KRbCs(1)碱金属单质的物理性质阅读P7,试着归纳碱金属物理性质的相似性和递变性Li表1-1 碱金属的主要性质最轻的金属,保存在石蜡里密度反常,比钠的密度小熔沸点逐渐降低碱金属物理性质的递变规律柔软较小较低强逐渐增大(K特殊)逐渐降低均为银白色(Cs略带金色)碱金属元素的递变规律增
加增
加增
加减
弱增
强增
大
(K
除
外)降
低增
强1.锂是世界上最轻的金属,它属于碱金属的一种。下列关于碱金属的说法正确的是( )
A.和锂同一主族的都是金属元素
B.Na+比Li多一个电子层
C.Li+、Na+、K+、Rb+的最外层都有8个电子
D.Li是碱金属中原子半径最小的原子HDNa+有两个电子层,Li有两个电子层Li+最外层只有2个电子2.下列对碱金属性质的叙述中正确的是( )
A.碱金属元素的单质具有强还原性,可置换出硫酸铜溶液中的铜单质
B.单质在空气中燃烧生成的都是过氧化物
C.碱金属单质与水反应生成碱和氢气
D.单质熔、沸点随着原子序数递增而升高CLi燃烧后生成物只有Li2O熔、沸点在逐渐降低碱金属单质还原性强,会首先与水反应2M+2H2O 2MOH+H2↑(M=Li, Na, K, Rb, Cs)3.下列关于碱金属某些性质的排序中,正确的是( )
A.还原性:Li>Na>K>Rb>Cs
B.密度:Li
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸.C氧化物种类增多
