高中化学必修2课件:1-1 第一节《元素周期表》课时3
文档属性
| 名称 | 高中化学必修2课件:1-1 第一节《元素周期表》课时3 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-23 00:00:00 | ||
图片预览





文档简介
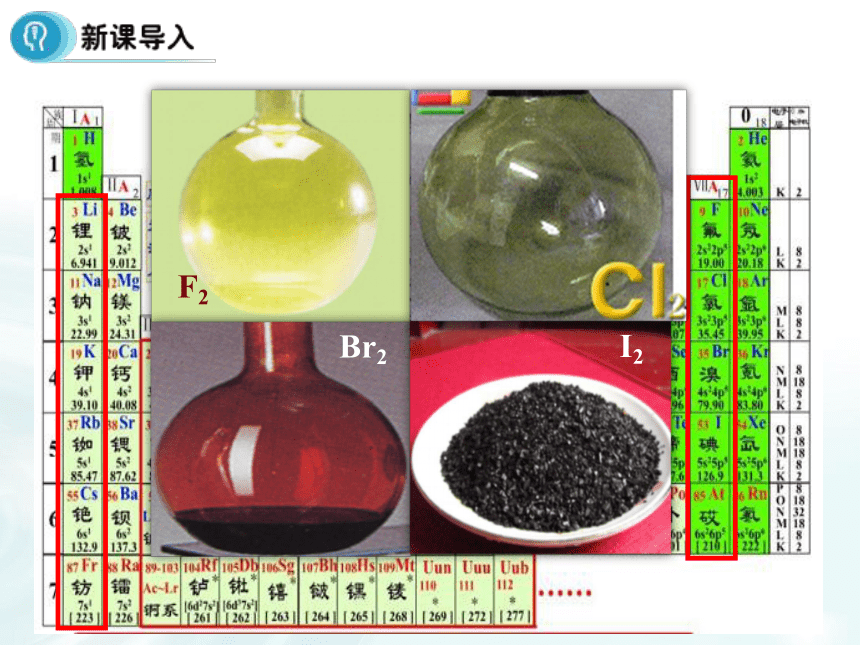
课件22张PPT。第一章 物质结构 元素周期表第1节 元素周期表(课时3)1、掌握卤族元素单质的主要性质及递变规律。
2、掌握主族元素原子结构与元素性质的内在联系。 本课设计主线:卤素物理性质——原子结构——化学性质。采用回忆碱金属的递变规律引导学生思考卤素之间是否存在类似的递变规律,以明确本课目标。首先阅读资料卡片归纳卤素的物理性质递变规律,并补充介绍溴、碘单质的特性。接着观察卤素原子结构的异同推测化学性质。重点介绍与氢气化合、卤素单质间的置换反应及与水反应。并归纳卤素氧化性的强弱关系,总结递变规律。最后采用表格的形式梳理卤素的结构、性质的递变规律,并升华总结本节元素性质与结构之间关系——结构决定性质。并设计精选习题培养学生应用知识的技能。
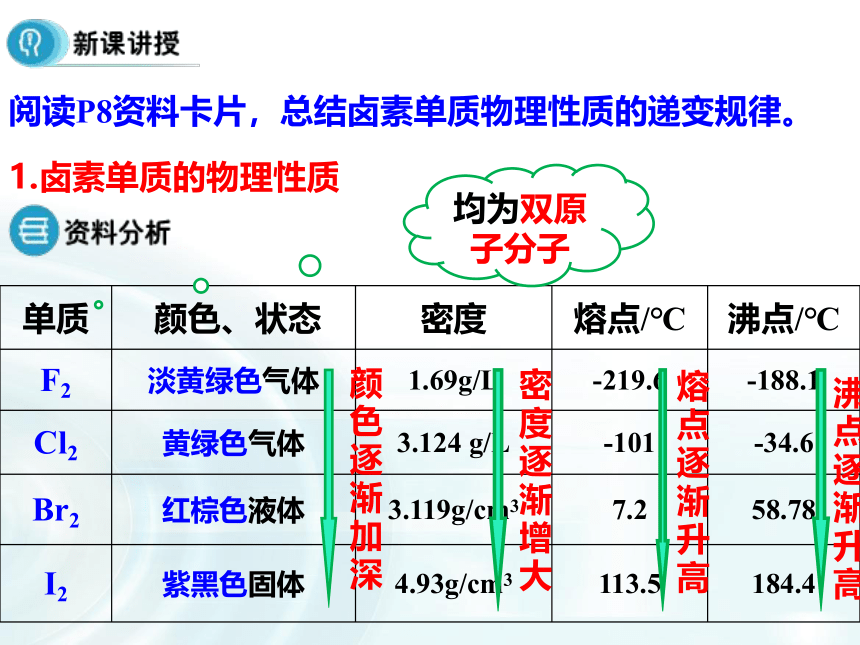
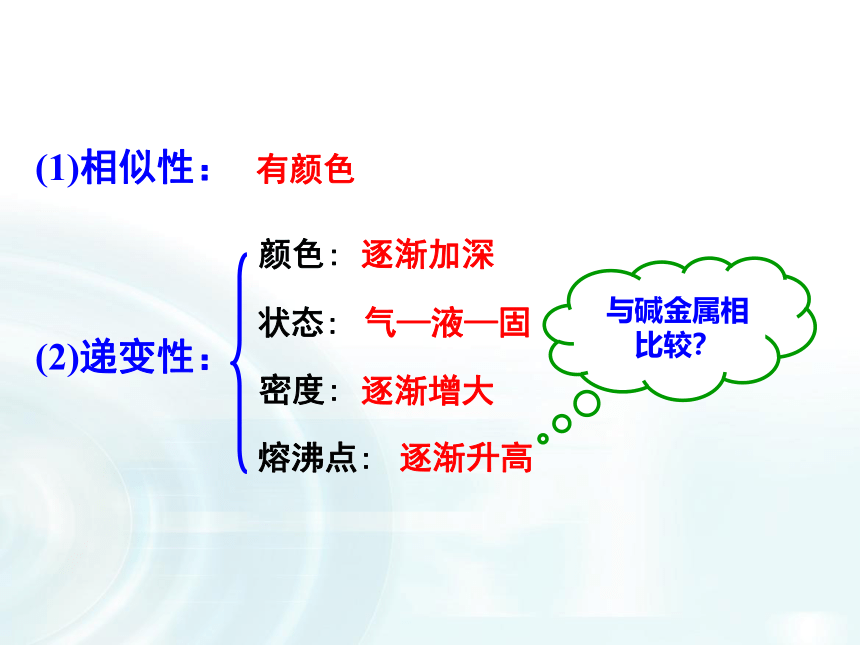
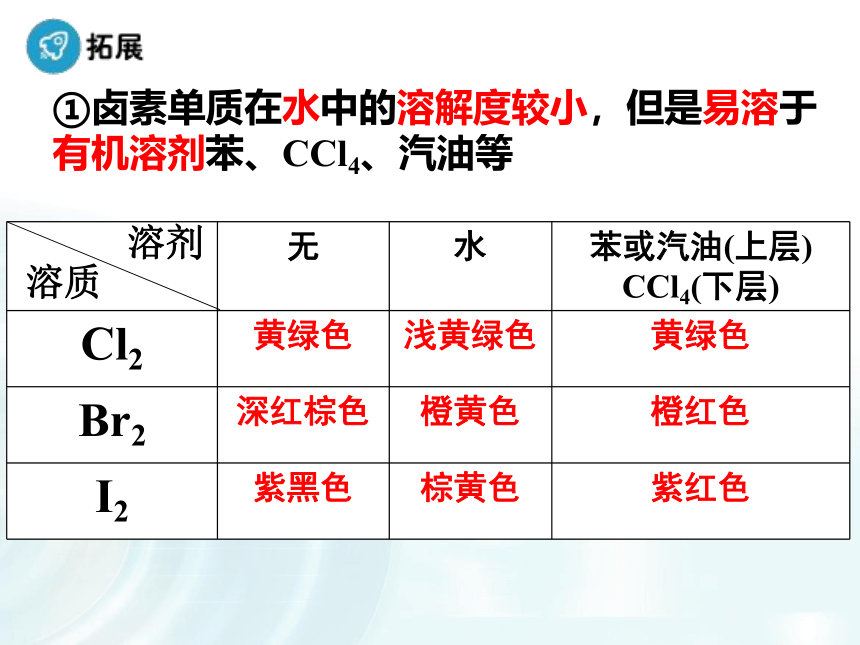
卤素化学性质的学习,注重从结构决定性质角度入手推测化学性质的递变规律。与氢气化合,采用阅读教材表格归纳递变规律,有助于提高学生的总结归纳能力;卤素之间的置换反应配有相关视频,通过观察实验,并用氧化还原知识分析氧化性、还原性强弱关系。做到理论与实践相结合,加深理解;接着设置疑问引入卤素单质与水的反应,总结化学性质递变规律。F2Br2I21.卤素单质的物理性质 阅读P8资料卡片,总结卤素单质物理性质的递变规律。密度逐渐增大熔点逐渐升高沸点逐渐升高颜色逐渐加深均为双原子分子(1)相似性:(2)递变性:有颜色颜色:状态:密度:熔沸点:逐渐加深气—液—固逐渐增大逐渐升高①卤素单质在水中的溶解度较小,但是易溶于有机溶剂苯、CCl4、汽油等②卤素单质的特性A、溴的特性深红棕色液体,是常温下唯一呈液态的非金属单质有刺激性气味、有毒易挥发,溴蒸气为红棕色会腐蚀橡胶,用玻璃塞。密闭保存,加水液封B、碘的特性碘是一种紫黑色固体,碘的蒸气呈紫色易升华,用于分离、提纯碘晶体碘(I2)单质遇淀粉变蓝色
——用于碘、淀粉相互检验碘的升华观察卤族元素的原子结构示意图,思考并讨论:
①卤素的原子结构有什么异同点?
②根据原子结构,试推测卤素在化学性质上所表现的相似性和递变性。相似性:递变性:核电荷数递增电子层数递增原子半径依次增大易得一个电子表现氧化性氧化性逐渐减弱最外层7个电子得电子能力逐渐减弱2. 卤族元素的原子结构(1)与H2反应3. 卤素单质的化学性质 阅读教材P8,归纳卤素与氢气反应的相似性及反应条件、产物稳定性等的递变规律■单质氧化性减弱,体现递变性■都能跟氢气反应,体现相似性反应通式:H2 + X2 = 2HX
(X= F、Cl、Br、I) 逐
渐
变
难逐
渐
减
弱 逐
渐
减
弱 A、HX的稳定性:
B、HX的还原性:
C、HX水溶液的酸性:HF > HCl > HBr > HIHF 根据实验判断氧化性和还原性的强弱关系以强制弱无色橙红色无色紫色2NaBr +Cl2 = 2NaCl +Br2 2KI+Cl2 = 2KCl +I22Br - +Cl2 = 2Cl - + Br2 2I - +Cl2 = 2Cl - +I2氧化性:Cl2 > Br2
还原性:Br - > Cl -氧化性:Cl2 > I2
还原性:I - > Cl -(2)卤素单质间的置换反应实验-氯水置换溴和碘紫色 无色 2KI+Br2 = I2+2KBr 氧化性:Cl2 > Br2 > I22I - +Br2 = I2+2Br - 氧化性:Br2 > I2
还原性:I - > Br -还原性:I - > Br - > Cl - 溴和碘化钾溶液的反应实验小结:
氧化性:F2> Cl2> Br2>I2
还原性:F-> Cl- > Br- > I-注意:F2不能在溶液中置换后面的卤素单质2F2 + 2H2O = 4HF + O2氧化性:F2> Cl2> Br2>I2。 Cl2可从溴、碘的盐溶液中置换出相应的卤素单质,F2与氯、溴、碘的盐溶液可以置换出相应的卤素单质吗?Cl2 + H2O = HCl + HClOBr2 + H2O = HBr + HBrOI2 + H2O = HI + HIO反应通式:2F2 + 2H2O = 4HF + O2(特例)F 没有正价,只有0价和-1价相似性:递变性:与水反应的能力依次减弱(能反应)(很弱)(极弱)反应越来越弱(3)与水反应X2 + H2O = HX + HXO(X≠F)3. 卤素单质的化学性质F2→I2反应难易程度:增大
剧烈程度:减小氧化性:F2> Cl2> Br2>I2
还原性:F-> Cl- > Br- > I-卤族元素的递变规律从上到下增
加增
加增
加减弱减弱增
大升高减弱减弱 主族元素随原子核外电子层数增加,它们得失电子能力、金属性、非金属性递变趋势。规律:1.下列关于F、Cl、Br、I元素性质的比较,不正确的是( )A.它们的原子核外电子层数随核电荷数的增加而增多
B.被其他卤素单质从其卤素化物中置换出来可能性随核电荷数的增加而增大 C.单质的颜色随核电荷数的增加而加深
D.它们的氢化物的稳定性随核电荷数的增加而增强D卤离子的还原性逐渐增强F2淡黄绿色,Cl2黄绿色,Br2红棕色,I2紫黑色×√√√非金属性越强,氢化物越稳定2.下列说法不正确的是( )
A.HBr比HCl的还原性强
B.卤素是较强的非金属元素,故其单质只有氧化性
C.碘难溶于水,易溶于有机溶剂
D.碘单质能使湿润的碘化钾淀粉试纸变蓝还原性:F-> Cl- > Br- > I-√Cl2 + H2O = HCl + HClO,Cl元素既体现出氧化性,也体现出还原性×√√B
2、掌握主族元素原子结构与元素性质的内在联系。 本课设计主线:卤素物理性质——原子结构——化学性质。采用回忆碱金属的递变规律引导学生思考卤素之间是否存在类似的递变规律,以明确本课目标。首先阅读资料卡片归纳卤素的物理性质递变规律,并补充介绍溴、碘单质的特性。接着观察卤素原子结构的异同推测化学性质。重点介绍与氢气化合、卤素单质间的置换反应及与水反应。并归纳卤素氧化性的强弱关系,总结递变规律。最后采用表格的形式梳理卤素的结构、性质的递变规律,并升华总结本节元素性质与结构之间关系——结构决定性质。并设计精选习题培养学生应用知识的技能。
卤素化学性质的学习,注重从结构决定性质角度入手推测化学性质的递变规律。与氢气化合,采用阅读教材表格归纳递变规律,有助于提高学生的总结归纳能力;卤素之间的置换反应配有相关视频,通过观察实验,并用氧化还原知识分析氧化性、还原性强弱关系。做到理论与实践相结合,加深理解;接着设置疑问引入卤素单质与水的反应,总结化学性质递变规律。F2Br2I21.卤素单质的物理性质 阅读P8资料卡片,总结卤素单质物理性质的递变规律。密度逐渐增大熔点逐渐升高沸点逐渐升高颜色逐渐加深均为双原子分子(1)相似性:(2)递变性:有颜色颜色:状态:密度:熔沸点:逐渐加深气—液—固逐渐增大逐渐升高①卤素单质在水中的溶解度较小,但是易溶于有机溶剂苯、CCl4、汽油等②卤素单质的特性A、溴的特性深红棕色液体,是常温下唯一呈液态的非金属单质有刺激性气味、有毒易挥发,溴蒸气为红棕色会腐蚀橡胶,用玻璃塞。密闭保存,加水液封B、碘的特性碘是一种紫黑色固体,碘的蒸气呈紫色易升华,用于分离、提纯碘晶体碘(I2)单质遇淀粉变蓝色
——用于碘、淀粉相互检验碘的升华观察卤族元素的原子结构示意图,思考并讨论:
①卤素的原子结构有什么异同点?
②根据原子结构,试推测卤素在化学性质上所表现的相似性和递变性。相似性:递变性:核电荷数递增电子层数递增原子半径依次增大易得一个电子表现氧化性氧化性逐渐减弱最外层7个电子得电子能力逐渐减弱2. 卤族元素的原子结构(1)与H2反应3. 卤素单质的化学性质 阅读教材P8,归纳卤素与氢气反应的相似性及反应条件、产物稳定性等的递变规律■单质氧化性减弱,体现递变性■都能跟氢气反应,体现相似性反应通式:H2 + X2 = 2HX
(X= F、Cl、Br、I) 逐
渐
变
难逐
渐
减
弱 逐
渐
减
弱 A、HX的稳定性:
B、HX的还原性:
C、HX水溶液的酸性:HF > HCl > HBr > HIHF
还原性:Br - > Cl -氧化性:Cl2 > I2
还原性:I - > Cl -(2)卤素单质间的置换反应实验-氯水置换溴和碘紫色 无色 2KI+Br2 = I2+2KBr 氧化性:Cl2 > Br2 > I22I - +Br2 = I2+2Br - 氧化性:Br2 > I2
还原性:I - > Br -还原性:I - > Br - > Cl - 溴和碘化钾溶液的反应实验小结:
氧化性:F2> Cl2> Br2>I2
还原性:F-> Cl- > Br- > I-注意:F2不能在溶液中置换后面的卤素单质2F2 + 2H2O = 4HF + O2氧化性:F2> Cl2> Br2>I2。 Cl2可从溴、碘的盐溶液中置换出相应的卤素单质,F2与氯、溴、碘的盐溶液可以置换出相应的卤素单质吗?Cl2 + H2O = HCl + HClOBr2 + H2O = HBr + HBrOI2 + H2O = HI + HIO反应通式:2F2 + 2H2O = 4HF + O2(特例)F 没有正价,只有0价和-1价相似性:递变性:与水反应的能力依次减弱(能反应)(很弱)(极弱)反应越来越弱(3)与水反应X2 + H2O = HX + HXO(X≠F)3. 卤素单质的化学性质F2→I2反应难易程度:增大
剧烈程度:减小氧化性:F2> Cl2> Br2>I2
还原性:F-> Cl- > Br- > I-卤族元素的递变规律从上到下增
加增
加增
加减弱减弱增
大升高减弱减弱 主族元素随原子核外电子层数增加,它们得失电子能力、金属性、非金属性递变趋势。规律:1.下列关于F、Cl、Br、I元素性质的比较,不正确的是( )A.它们的原子核外电子层数随核电荷数的增加而增多
B.被其他卤素单质从其卤素化物中置换出来可能性随核电荷数的增加而增大 C.单质的颜色随核电荷数的增加而加深
D.它们的氢化物的稳定性随核电荷数的增加而增强D卤离子的还原性逐渐增强F2淡黄绿色,Cl2黄绿色,Br2红棕色,I2紫黑色×√√√非金属性越强,氢化物越稳定2.下列说法不正确的是( )
A.HBr比HCl的还原性强
B.卤素是较强的非金属元素,故其单质只有氧化性
C.碘难溶于水,易溶于有机溶剂
D.碘单质能使湿润的碘化钾淀粉试纸变蓝还原性:F-> Cl- > Br- > I-√Cl2 + H2O = HCl + HClO,Cl元素既体现出氧化性,也体现出还原性×√√B
