高中化学必修2课件:1-2 第二节《元素周期律》课时2
文档属性
| 名称 | 高中化学必修2课件:1-2 第二节《元素周期律》课时2 |

|
|
| 格式 | zip | ||
| 文件大小 | 493.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-23 00:00:00 | ||
图片预览






文档简介
课件14张PPT。第2节 元素周期律课时2第一章 元素周期表1、了解两性元素2、了解元素最高化合价与元素周期表位置的关系3、了解元素周期表及周期律在其他方面的应用 本课首先利用结构、位置与性质三者之间的关系导入新课,进而引出元素周期表及周期律在其他方面的应用;首先巩固元素周期表及周期律在元素位置、性质及结构方面的应用,然后再说明在元素金属性及非金属性方面的应用;再而介绍在元素的化合价判断方面的应用。最后简单介绍在其他领域的应用元素周期表及周期律具体又有哪些应用呢?一、元素的位、构、性三者之间的关系应用1、结构决定位置原子序数=核电荷数
周期序数=电子层数
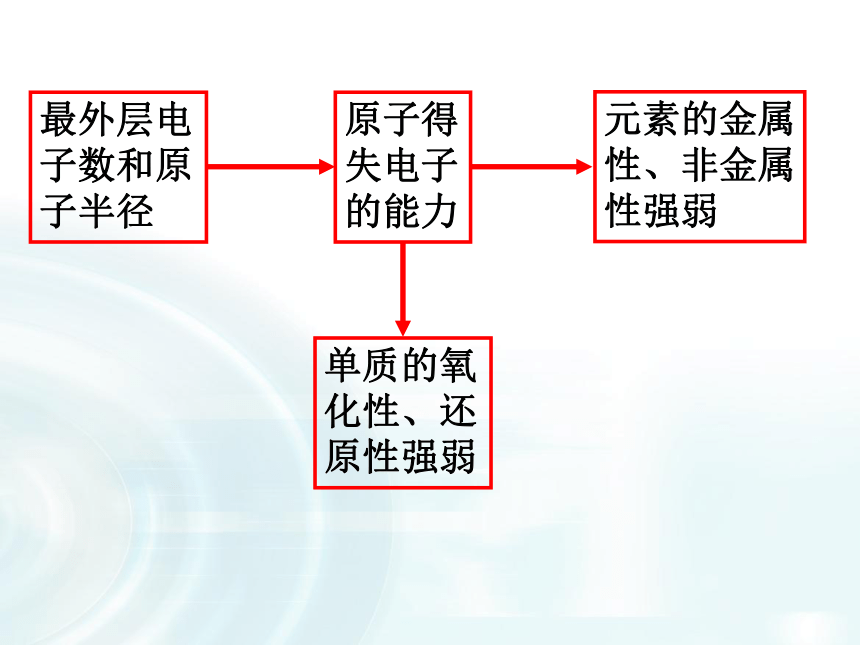
主族序数=最外层电子数2、结构决定性质 最外层电子数=主族元素的最高正价数=8-负价数最外层电子数和原子半径原子得失电子的能力元素的金属性、非金属性强弱单质的氧化性、还原性强弱3、位置决定性质二、金属与非金属性 分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图:同周期:从左到右,递变性 氧化性增强
非金属性逐渐增强金属性逐渐增强原子半径逐渐增大金属性逐渐增强还原性逐渐增强原子半径逐渐减小非金属性逐渐增强非金属性依次增强 什么元素的金属性最强?什么元素的非金属性最强它们分别位于元素周期表中的什么位置?三、元素的化合价与元素在周期表中的位置关系
(1)主族元素:
最高正价数 = 主族序数 = 最外层电子数?
(2)非金属元素:
|最高正价|+|最低负价|= 8?四、其他应用(P18)(1)预言未知元素并证实.
(2)分界处找半导体材料.
(3)在非金属区域找制农药元素.
(4)过度区寻找催化剂和耐高温、耐腐蚀的合金材料.1、硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se) 的保健品已经进入市场, 已知它与氧元素同族, 与K同周期, 关于硒的说法中不正确的是( )
A.原子序数为34????????????????
B.最高价氧化物的水化物的分子式为H2SeO4
C.Se的非金属性比Br弱????????
D.气态氢化物的稳定性比硫化氢气体强D2、有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。
由此可推知(填元素符号):
V是____、W是____、X是_____、Y是____、Z是_____H O Al S K
周期序数=电子层数
主族序数=最外层电子数2、结构决定性质 最外层电子数=主族元素的最高正价数=8-负价数最外层电子数和原子半径原子得失电子的能力元素的金属性、非金属性强弱单质的氧化性、还原性强弱3、位置决定性质二、金属与非金属性 分界线左边是金属元素,分界线右边是非金属元素,最右一个纵行是稀有气体元素。见下图:同周期:从左到右,递变性 氧化性增强
非金属性逐渐增强金属性逐渐增强原子半径逐渐增大金属性逐渐增强还原性逐渐增强原子半径逐渐减小非金属性逐渐增强非金属性依次增强 什么元素的金属性最强?什么元素的非金属性最强它们分别位于元素周期表中的什么位置?三、元素的化合价与元素在周期表中的位置关系
(1)主族元素:
最高正价数 = 主族序数 = 最外层电子数?
(2)非金属元素:
|最高正价|+|最低负价|= 8?四、其他应用(P18)(1)预言未知元素并证实.
(2)分界处找半导体材料.
(3)在非金属区域找制农药元素.
(4)过度区寻找催化剂和耐高温、耐腐蚀的合金材料.1、硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se) 的保健品已经进入市场, 已知它与氧元素同族, 与K同周期, 关于硒的说法中不正确的是( )
A.原子序数为34????????????????
B.最高价氧化物的水化物的分子式为H2SeO4
C.Se的非金属性比Br弱????????
D.气态氢化物的稳定性比硫化氢气体强D2、有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。
由此可推知(填元素符号):
V是____、W是____、X是_____、Y是____、Z是_____H O Al S K
