高中化学必修2课件:2-2 第二节《化学能与电能》课时2
文档属性
| 名称 | 高中化学必修2课件:2-2 第二节《化学能与电能》课时2 |  | |
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-23 20:21:39 | ||
图片预览





文档简介
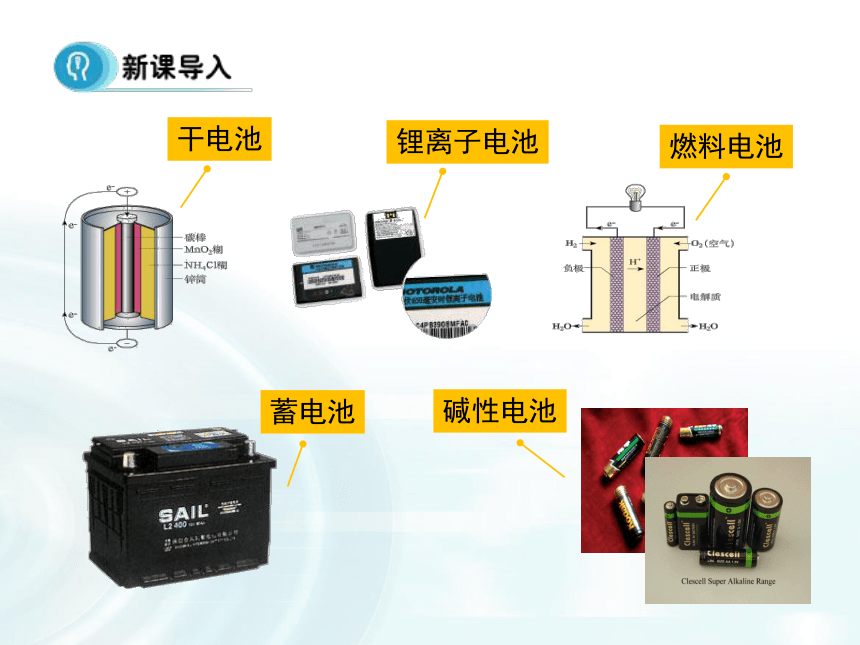
课件21张PPT。第二章 化学反应与能量第2节 化学能与电能(课时2)1.掌握原电池的构成和工作原理。
2.知道常见的化学电源的种类。
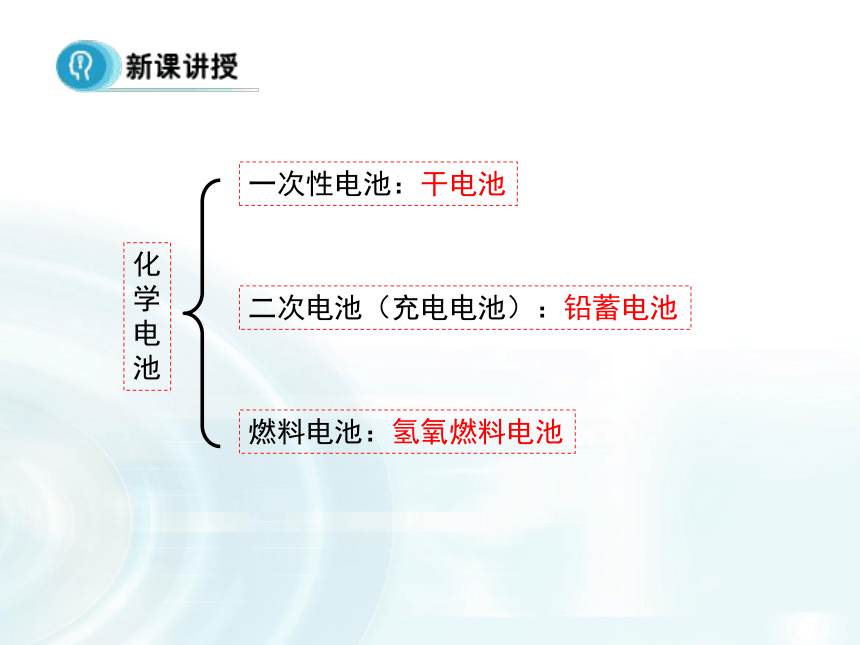
3.掌握简单原电池的电极反应。 本课首先让学生根据一些生活中的一些常用电池直接引入主题内容。本课着重是介绍化学电源的分类,学生要清楚化学电源的三种分类——一次电池、充电电池、燃料电池。并要清楚知道它们代表电池的结构特点和电极反应。
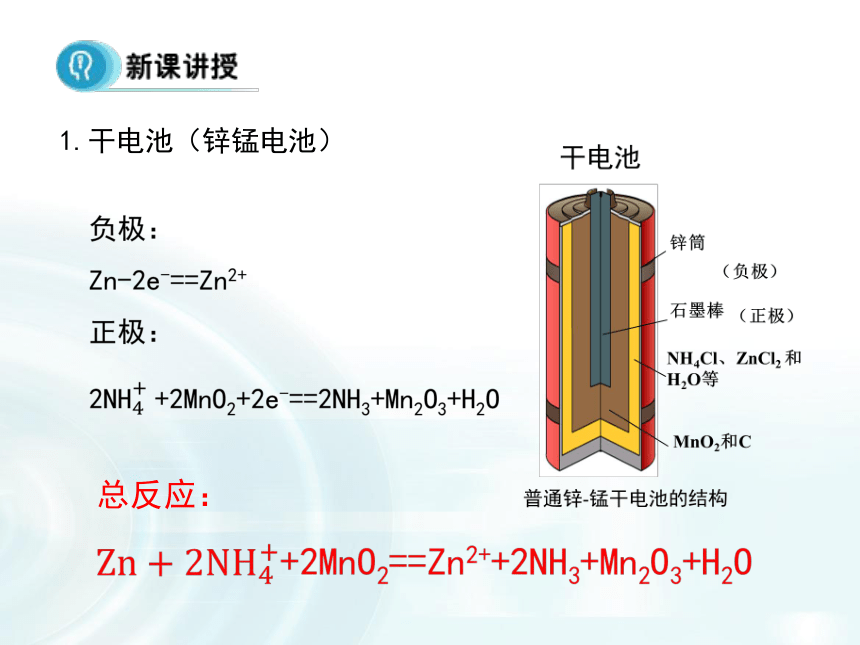
在讲解电源分类的时候,注意电池的基本结构,从而分析工作原理。通过图文的形式展现出各类电池的具体结构特点,要知道电池的工作原理就得知道电极反应,同时要注意电解质溶液对电池和电极反应的影响。干电池蓄电池锂离子电池燃料电池碱性电池一次性电池:干电池二次电池(充电电池):铅蓄电池燃料电池:氢氧燃料电池1.干电池(锌锰电池)总反应:??锌锰干电池即使不用,放置过久,也会失效(作为电解质的糊状NH4Cl显酸性),为了充分而有效地利用锌锰干电池,在购买、保存和使用方面你有何经验与建议?请与同学交流分享。碱性电池总反应:
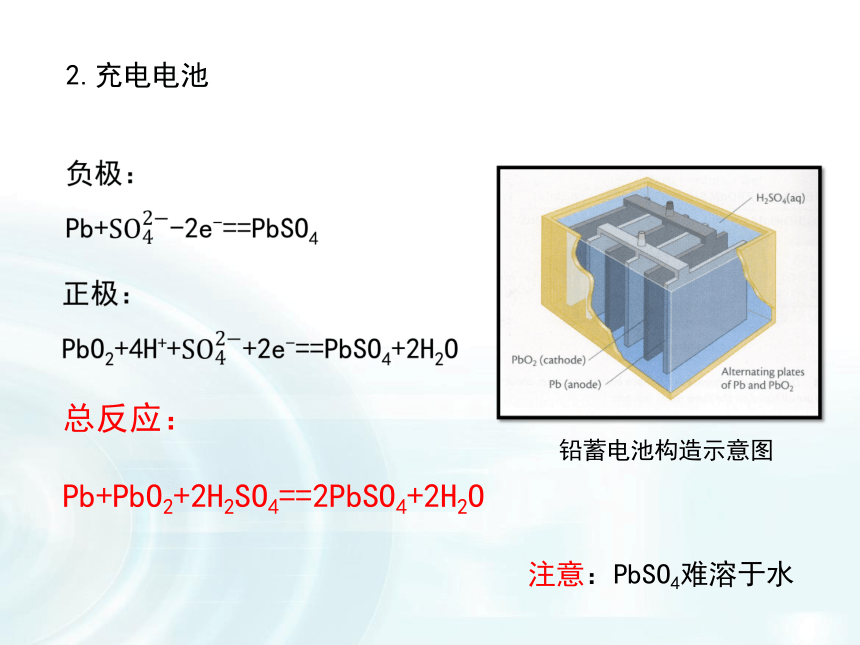
Pb+PbO2+2H2SO4==2PbSO4+2H2O ??2.充电电池注意:PbSO4难溶于水铅蓄电池构造示意图锂离子电池:它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。汽车用蓄电池锂离子电池优点:可反复使用充电电池与一次电池相比有何优点?如何科学合理地使用充电电池?请与同学们讨论、交流。3.燃料电池正极:O2 + 2H2O + 4e- == 4OH-负极:2H2 – 4e- == 4H+(1)氢氧燃料电池总反应:2H2 + O2 == 2H2O碱性条件下: 电解质溶液的酸碱性对电极反应的影响负极:2H2 – 4e- == 4H+正极:O2 + 4H+ + 4e- == 2H2O酸性条件下:负极:2H2 + 4OH-–4e- == 4H2O正极:O2 + 2H2O + 4e- == 4OH-(有效地防止电解质溶液对外壳的腐蚀)总反应:2H2 + O2 = 2H2O总反应:2H2 + O2 = 2H2O改变燃料正极:2O2+4H2O+8e-==8OH-负极:CH4+10OH-–8e-==CO32-+7H2O原理:CH4 +2O2 == CO2 + 2H2O?总反应:碱性介质:燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。使用燃料电池的汽车其他电池空气电池废电池对环境的危害电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环境造成严重的污染。上世纪50年代,震惊世界的日本“水俣病”就是因汞中毒引起的。减少污染 节约资源废电池污染治理刻不容缓1.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极B2.某原电池总反应的离子方程式为2Fe3++Fe==3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu 、负极为Fe,电解质溶液为FeCl3溶液
B.正极为C 、负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Fe 、负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag 、负极为Fe,电解质溶液为CuSO4溶液CD3.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
A.铁圈和银圈左右摇摆不定
B.保持平衡状态
C.铁圈向下倾斜
D.银圈向下倾斜D
2.知道常见的化学电源的种类。
3.掌握简单原电池的电极反应。 本课首先让学生根据一些生活中的一些常用电池直接引入主题内容。本课着重是介绍化学电源的分类,学生要清楚化学电源的三种分类——一次电池、充电电池、燃料电池。并要清楚知道它们代表电池的结构特点和电极反应。
在讲解电源分类的时候,注意电池的基本结构,从而分析工作原理。通过图文的形式展现出各类电池的具体结构特点,要知道电池的工作原理就得知道电极反应,同时要注意电解质溶液对电池和电极反应的影响。干电池蓄电池锂离子电池燃料电池碱性电池一次性电池:干电池二次电池(充电电池):铅蓄电池燃料电池:氢氧燃料电池1.干电池(锌锰电池)总反应:??锌锰干电池即使不用,放置过久,也会失效(作为电解质的糊状NH4Cl显酸性),为了充分而有效地利用锌锰干电池,在购买、保存和使用方面你有何经验与建议?请与同学交流分享。碱性电池总反应:
Pb+PbO2+2H2SO4==2PbSO4+2H2O ??2.充电电池注意:PbSO4难溶于水铅蓄电池构造示意图锂离子电池:它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。汽车用蓄电池锂离子电池优点:可反复使用充电电池与一次电池相比有何优点?如何科学合理地使用充电电池?请与同学们讨论、交流。3.燃料电池正极:O2 + 2H2O + 4e- == 4OH-负极:2H2 – 4e- == 4H+(1)氢氧燃料电池总反应:2H2 + O2 == 2H2O碱性条件下: 电解质溶液的酸碱性对电极反应的影响负极:2H2 – 4e- == 4H+正极:O2 + 4H+ + 4e- == 2H2O酸性条件下:负极:2H2 + 4OH-–4e- == 4H2O正极:O2 + 2H2O + 4e- == 4OH-(有效地防止电解质溶液对外壳的腐蚀)总反应:2H2 + O2 = 2H2O总反应:2H2 + O2 = 2H2O改变燃料正极:2O2+4H2O+8e-==8OH-负极:CH4+10OH-–8e-==CO32-+7H2O原理:CH4 +2O2 == CO2 + 2H2O?总反应:碱性介质:燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。使用燃料电池的汽车其他电池空气电池废电池对环境的危害电池中含有汞、镉、铅等有毒金属。随意丢弃废电池会对环境造成严重的污染。上世纪50年代,震惊世界的日本“水俣病”就是因汞中毒引起的。减少污染 节约资源废电池污染治理刻不容缓1.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极B2.某原电池总反应的离子方程式为2Fe3++Fe==3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu 、负极为Fe,电解质溶液为FeCl3溶液
B.正极为C 、负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Fe 、负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag 、负极为Fe,电解质溶液为CuSO4溶液CD3.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
A.铁圈和银圈左右摇摆不定
B.保持平衡状态
C.铁圈向下倾斜
D.银圈向下倾斜D
