人教版高一化学教学课件《第二章第三节 氧化还原反应》 (共12张PPT)
文档属性
| 名称 | 人教版高一化学教学课件《第二章第三节 氧化还原反应》 (共12张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 603.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-26 00:00:00 | ||
图片预览





文档简介
课件12张PPT。 2-3 氧化还原反应判断下列反应类型?是否是氧化还原反应?
1.CuO+H2====Cu+H2O
2.CaCO3+2HCl=====CaCl2+H2O+CO2↑
3.2Na+Cl2=====2NaCl
4.Na2O+H2O====2NaOH初始诊断练习温故:CuO失去氧,被还原,发生还原反应,氧化剂。H2得到氧,被氧化,发生氧化反应,还原剂。 在这个反应中氧化铜失去了氧,发生还原反应,又有氢气得到了氧,发生氧化反应。因此,氧化反应和还原反应是同时发生的。我们称这类反应为氧化还原反应。
分析下面氧化还原反应中各种元素的化合价在反应前后的变化情况,讨论氧化还原反应与元素化合价的升降有什么关系。思考与交流:2CuO + C 2Cu + CO2↑+200+4H2O + C H2 + CO+100+2高温高温CuO + H2 Cu + H2O+200+1△Fe +CuSO4 == FeSO4 +Cu
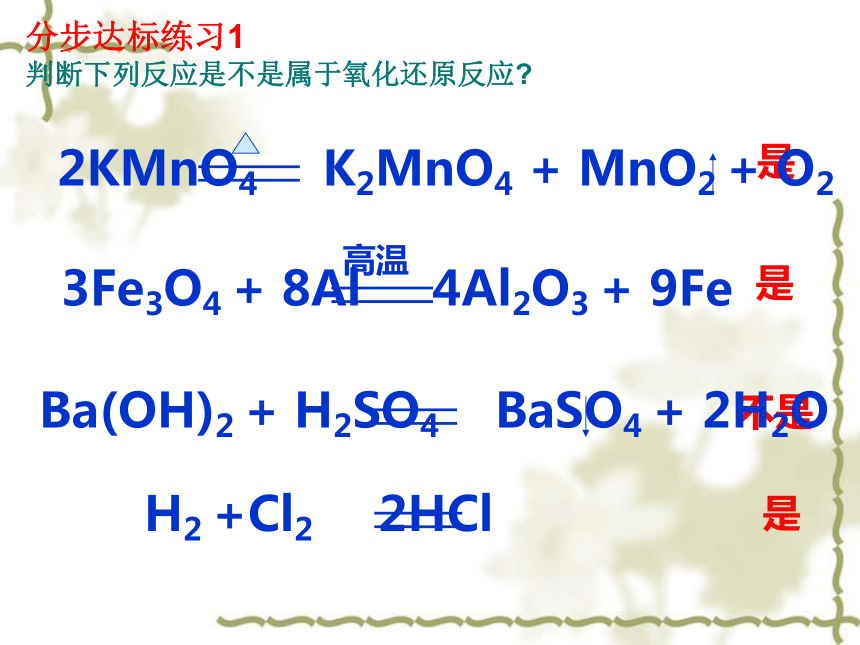
0 +2 +2 0 一、氧化还原反应的概念分步达标练习1 判断下列反应是不是属于氧化还原反应?是是不是是在氧化还原反应中为什么会发生化合价的升降?氧化还原反应的实质是什么呢?氯化钠形成示意图氯化氢形成示意图思考:
1、对于氧化还原反应,它的实质究竟是什么?实质:有电子的转移(得失或偏移)特征:有化合价的升降2、氧化还原反应与四大基本反应的关系?小结本质失电子(偏离)得电子(偏向)特征化合价升高化合价降低概念被氧化还原剂被还原氧化剂氧化反应还原反应1.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu B.Fe2O3+3CO==2Fe+3CO2
C.AgNO3+NaCl=AgCl+NaNO3 D.2KMnO4==== K2MnO4 +MnO2 +O2↑
2.下列属于氧化还原反应的是( )
A.CaCO3==CaO+CO2↑ B.Na2O+H2O=2NaOH
C.Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
D.MnO2+4HCl==MnCl2+Cl2↑+2H2O
3.下列变化需要加入氧化剂才能实现的是( )
A.NaOH→NaCl B. H2SO4→H2 C. HCl→Cl2 D. CaCO3→CO2
4.在下列反应中,水既不作氧化剂,又不作还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑ B. Na2O+H2O=2NaOH
C.2 H2O ===2H2↑+O2↑ D.C+H2O==CO+H2
5.下列变化过程一定属于还原反应的是( )
A. HCl→MgCl2 B. Na→Na+ C.CO→CO2 D.Fe3+→Fe2+达标练习再见
1.CuO+H2====Cu+H2O
2.CaCO3+2HCl=====CaCl2+H2O+CO2↑
3.2Na+Cl2=====2NaCl
4.Na2O+H2O====2NaOH初始诊断练习温故:CuO失去氧,被还原,发生还原反应,氧化剂。H2得到氧,被氧化,发生氧化反应,还原剂。 在这个反应中氧化铜失去了氧,发生还原反应,又有氢气得到了氧,发生氧化反应。因此,氧化反应和还原反应是同时发生的。我们称这类反应为氧化还原反应。
分析下面氧化还原反应中各种元素的化合价在反应前后的变化情况,讨论氧化还原反应与元素化合价的升降有什么关系。思考与交流:2CuO + C 2Cu + CO2↑+200+4H2O + C H2 + CO+100+2高温高温CuO + H2 Cu + H2O+200+1△Fe +CuSO4 == FeSO4 +Cu
0 +2 +2 0 一、氧化还原反应的概念分步达标练习1 判断下列反应是不是属于氧化还原反应?是是不是是在氧化还原反应中为什么会发生化合价的升降?氧化还原反应的实质是什么呢?氯化钠形成示意图氯化氢形成示意图思考:
1、对于氧化还原反应,它的实质究竟是什么?实质:有电子的转移(得失或偏移)特征:有化合价的升降2、氧化还原反应与四大基本反应的关系?小结本质失电子(偏离)得电子(偏向)特征化合价升高化合价降低概念被氧化还原剂被还原氧化剂氧化反应还原反应1.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu B.Fe2O3+3CO==2Fe+3CO2
C.AgNO3+NaCl=AgCl+NaNO3 D.2KMnO4==== K2MnO4 +MnO2 +O2↑
2.下列属于氧化还原反应的是( )
A.CaCO3==CaO+CO2↑ B.Na2O+H2O=2NaOH
C.Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
D.MnO2+4HCl==MnCl2+Cl2↑+2H2O
3.下列变化需要加入氧化剂才能实现的是( )
A.NaOH→NaCl B. H2SO4→H2 C. HCl→Cl2 D. CaCO3→CO2
4.在下列反应中,水既不作氧化剂,又不作还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑ B. Na2O+H2O=2NaOH
C.2 H2O ===2H2↑+O2↑ D.C+H2O==CO+H2
5.下列变化过程一定属于还原反应的是( )
A. HCl→MgCl2 B. Na→Na+ C.CO→CO2 D.Fe3+→Fe2+达标练习再见
