1.2 物质的酸碱性
图片预览



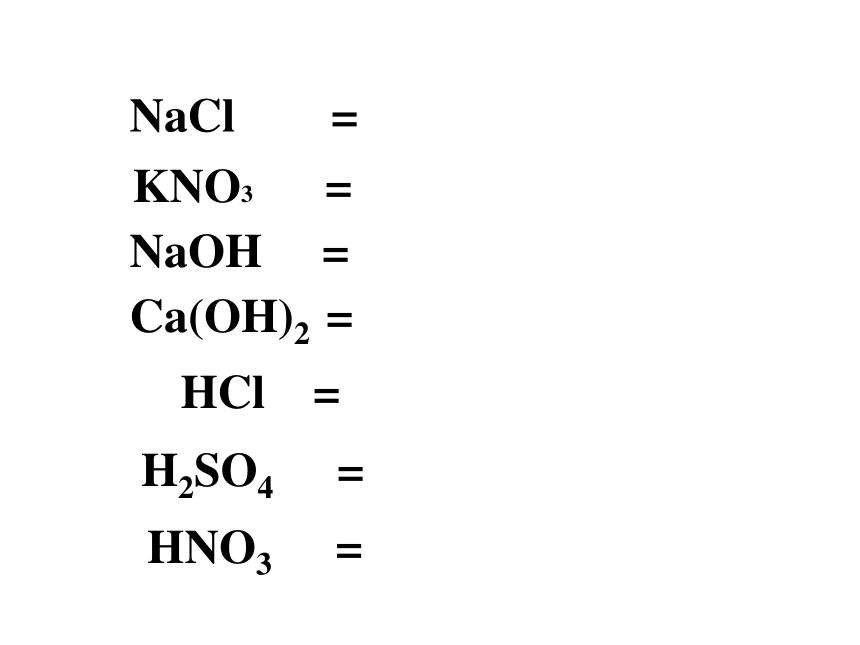




文档简介
课件22张PPT。第2节 物质的酸碱性1.带电的原子或原子团叫做离子。
如:Na+、Clˉ、 K+ 、NO3ˉ
①带正电荷的叫阳离子
如Na+、 K+
②带负电荷的叫阴离子
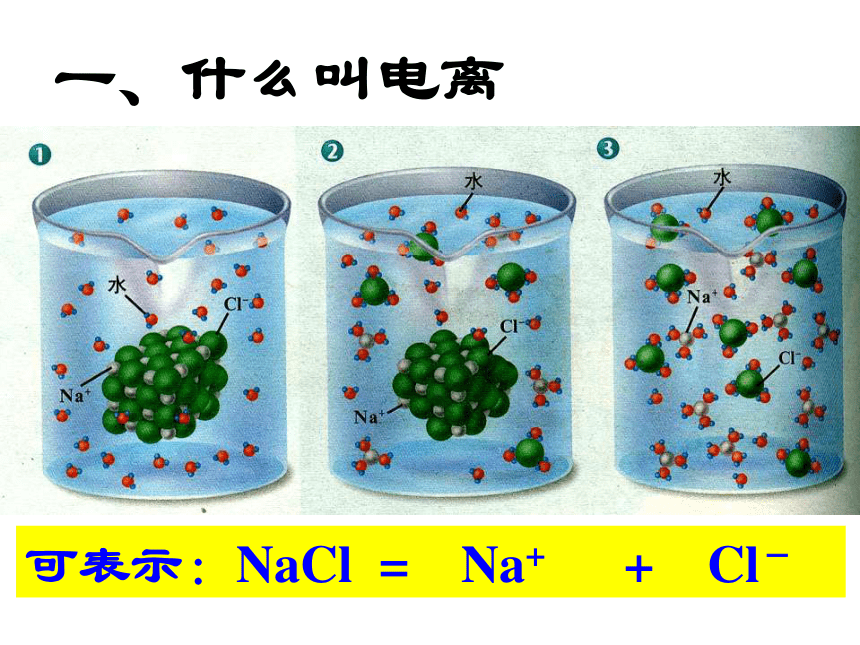
如Clˉ、NO3ˉ复习:一、什么叫电离可表示:NaCl = Na+ + Cl-1.电离的定义:
一些物质溶解于水或受热熔化时,产生自由移动的离子的过程叫做电离。盐酸:
硝酸:
硫酸:HCl = H+ + Cl-2.电离方程式:HNO3 = H+ + NO3-H2SO4 = 2H+ + SO42-
电离通式:酸 H+ + 酸根阴离子 一、什么是酸电离时产生的阳离子只有氢离子的化合物叫做酸.思考:电离产物的共同之处是什么?NaOH = Na+ + OH– Ca(OH)2= Ca2+ + 2OH– Ba(OH)2 = Ba2+ + 2OH– KOH = K+ + OH–3.碱的涵义:碱是电离时产生的阴离子只有OH-的化合物。二.碱的电离通式:碱= 金属离子(NH4+) + OH–三、根据下列物质的电离方程式:氯化钠、硫酸亚铁、硝酸钾、碳酸钡、氯化铵NaCl === Na+ + Cl-
FeSO4 === Fe2+ + SO42 —
KNO3 === K+ + NO3-
BaCO3 === Ba2+ + CO32-
NH4Cl === NH4+ + Cl-
请你找出上列电离方程式的共同点。电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子。①电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物,叫做盐。盐的电离通式:
盐=金属离子(NH4+)+酸根离子碱=金属离子(NH4+)+OH–酸 = H+ + 酸根阴离子胃酸、醋、葡萄、酸梅、橘子等说一说:生活中有哪些东西是酸的? 1.我们熟悉的有酸味的物质有:(1)人体中的胃液是酸的。(内有盐酸)(2)常见的水果如柠檬、苹果、杏、橘子等都含有酸味物质。(3)常见的饮料如牛奶、雪碧、可乐中都含有酸味物质。(4)常见的调味品如醋是酸的。(醋酸)2.上述物质中都含有一类特殊物质,那就是酸。如胃液中含有具有酸味的物质是盐酸。柠檬等水果中具有酸味的物质是柠檬酸。3、生活中的碱性物质:如石灰水、氨水中都含有的碱。在农业上改良酸性土壤的熟石灰,治疗胃酸过多的氢氧化铝等都是碱。那么如何来判断物质的酸碱性呢?用酸碱指示剂、 pH试纸可测定溶液酸碱性。 三、酸碱指示剂 简称:指示剂在酸性或碱性溶液里能显示出不同颜色的物质叫做酸碱指示剂。1 .定义:2.常见的酸碱指示剂有:紫色石蕊试液和无色酚酞试液。3.作用:可以定性地测量溶液的酸碱性。5.常见指示剂及其在酸性、碱性溶液中的颜色红色红色红色无色蓝色蓝色不变色不变色溶液的酸碱性的强弱程度(定量)1、pH是反映物质酸碱性强弱的指标。它的范围通常在0—14之间, pH越低,酸性越强; pH越高,碱性越强; pH等于7的物质呈中性。
2、测定物质酸碱性强弱最常用、最简单的方法是使用pH试纸。
3、粗略测定方法:用洁净的玻璃棒蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,从而确定被测溶液的pH。
4、精确测定:用酸度计①pH试纸能显示酸碱性的强弱程度,(定量)而酸碱指示剂则只能指示溶液是显酸性还是碱性还是中性。(定性)结论②酸、碱性溶液能使指示剂变色,其中酸性溶液能使紫色石蕊试液变红色,使无色酚酞试液不变色。
碱性溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。练习1.下列各组物质中,都属于酸性物质的是( )A .人的血液和酸梅 B .硫酸和强碱C .牛奶和可乐 D .人的胃液和洗衣粉C2.下列溶液的酸碱度(pH),其中酸性最强的是( )A. 1 B.3 C.7 D.12A3.判断下列说法正误(1)酸是酸性物质 。( )(2)酸性物质就是酸。( )√×4.测定溶液酸碱性强弱最常见、最简单的办法是使用( )。测定方法是:用洁净的( )蘸取被测溶液,滴在( )上,然后将显示的颜色与( )对照,从最接近的颜色来确定被测溶液的酸碱度。当pH为7时,溶液呈( )性,pH越小,( )越强。pH试纸玻璃棒pH试纸标准比色卡中酸性5.下列各组离子属于酸电离产生的是( )A.H+、NO3-、SO42-B. OH-、Ba2+C. Na+、H+、SO42-D.Na+、Cl-、Ba2+A6.写出下列物质的电离方程式. (1)H2SO4 =(2) MgCl2 =(3) Ba(OH)2 =(4) HnRO2n+1 =2H+ + SO42-Mg2+ + 2Cl-Ba2+ + 2OH-nH+ + RO2n+1 n-7. 某一无色溶液pH=2,该溶液呈( )性,它能使紫色石蕊试液变( )色,使无色酚酞试液( ),使蓝色石蕊试纸变( )色。 酸红不变色红8. 下列物质不属于酸的是( )
A.HNO3 B.NaHCO3 C.H3PO4
D.HI E.H2S
B
如:Na+、Clˉ、 K+ 、NO3ˉ
①带正电荷的叫阳离子
如Na+、 K+
②带负电荷的叫阴离子
如Clˉ、NO3ˉ复习:一、什么叫电离可表示:NaCl = Na+ + Cl-1.电离的定义:
一些物质溶解于水或受热熔化时,产生自由移动的离子的过程叫做电离。盐酸:
硝酸:
硫酸:HCl = H+ + Cl-2.电离方程式:HNO3 = H+ + NO3-H2SO4 = 2H+ + SO42-
电离通式:酸 H+ + 酸根阴离子 一、什么是酸电离时产生的阳离子只有氢离子的化合物叫做酸.思考:电离产物的共同之处是什么?NaOH = Na+ + OH– Ca(OH)2= Ca2+ + 2OH– Ba(OH)2 = Ba2+ + 2OH– KOH = K+ + OH–3.碱的涵义:碱是电离时产生的阴离子只有OH-的化合物。二.碱的电离通式:碱= 金属离子(NH4+) + OH–三、根据下列物质的电离方程式:氯化钠、硫酸亚铁、硝酸钾、碳酸钡、氯化铵NaCl === Na+ + Cl-
FeSO4 === Fe2+ + SO42 —
KNO3 === K+ + NO3-
BaCO3 === Ba2+ + CO32-
NH4Cl === NH4+ + Cl-
请你找出上列电离方程式的共同点。电离出的阳离子都是金属离子或铵根离子,阴离子都是酸根阴离子。①电离时能产生金属阳离子(或铵根离子)和酸根阴离子的化合物,叫做盐。盐的电离通式:
盐=金属离子(NH4+)+酸根离子碱=金属离子(NH4+)+OH–酸 = H+ + 酸根阴离子胃酸、醋、葡萄、酸梅、橘子等说一说:生活中有哪些东西是酸的? 1.我们熟悉的有酸味的物质有:(1)人体中的胃液是酸的。(内有盐酸)(2)常见的水果如柠檬、苹果、杏、橘子等都含有酸味物质。(3)常见的饮料如牛奶、雪碧、可乐中都含有酸味物质。(4)常见的调味品如醋是酸的。(醋酸)2.上述物质中都含有一类特殊物质,那就是酸。如胃液中含有具有酸味的物质是盐酸。柠檬等水果中具有酸味的物质是柠檬酸。3、生活中的碱性物质:如石灰水、氨水中都含有的碱。在农业上改良酸性土壤的熟石灰,治疗胃酸过多的氢氧化铝等都是碱。那么如何来判断物质的酸碱性呢?用酸碱指示剂、 pH试纸可测定溶液酸碱性。 三、酸碱指示剂 简称:指示剂在酸性或碱性溶液里能显示出不同颜色的物质叫做酸碱指示剂。1 .定义:2.常见的酸碱指示剂有:紫色石蕊试液和无色酚酞试液。3.作用:可以定性地测量溶液的酸碱性。5.常见指示剂及其在酸性、碱性溶液中的颜色红色红色红色无色蓝色蓝色不变色不变色溶液的酸碱性的强弱程度(定量)1、pH是反映物质酸碱性强弱的指标。它的范围通常在0—14之间, pH越低,酸性越强; pH越高,碱性越强; pH等于7的物质呈中性。
2、测定物质酸碱性强弱最常用、最简单的方法是使用pH试纸。
3、粗略测定方法:用洁净的玻璃棒蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,从而确定被测溶液的pH。
4、精确测定:用酸度计①pH试纸能显示酸碱性的强弱程度,(定量)而酸碱指示剂则只能指示溶液是显酸性还是碱性还是中性。(定性)结论②酸、碱性溶液能使指示剂变色,其中酸性溶液能使紫色石蕊试液变红色,使无色酚酞试液不变色。
碱性溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。练习1.下列各组物质中,都属于酸性物质的是( )A .人的血液和酸梅 B .硫酸和强碱C .牛奶和可乐 D .人的胃液和洗衣粉C2.下列溶液的酸碱度(pH),其中酸性最强的是( )A. 1 B.3 C.7 D.12A3.判断下列说法正误(1)酸是酸性物质 。( )(2)酸性物质就是酸。( )√×4.测定溶液酸碱性强弱最常见、最简单的办法是使用( )。测定方法是:用洁净的( )蘸取被测溶液,滴在( )上,然后将显示的颜色与( )对照,从最接近的颜色来确定被测溶液的酸碱度。当pH为7时,溶液呈( )性,pH越小,( )越强。pH试纸玻璃棒pH试纸标准比色卡中酸性5.下列各组离子属于酸电离产生的是( )A.H+、NO3-、SO42-B. OH-、Ba2+C. Na+、H+、SO42-D.Na+、Cl-、Ba2+A6.写出下列物质的电离方程式. (1)H2SO4 =(2) MgCl2 =(3) Ba(OH)2 =(4) HnRO2n+1 =2H+ + SO42-Mg2+ + 2Cl-Ba2+ + 2OH-nH+ + RO2n+1 n-7. 某一无色溶液pH=2,该溶液呈( )性,它能使紫色石蕊试液变( )色,使无色酚酞试液( ),使蓝色石蕊试纸变( )色。 酸红不变色红8. 下列物质不属于酸的是( )
A.HNO3 B.NaHCO3 C.H3PO4
D.HI E.H2S
B
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
