第二章 化学反应速率和化学平衡——单元检测题二(含解析)
文档属性
| 名称 | 第二章 化学反应速率和化学平衡——单元检测题二(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 277.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-28 00:00:00 | ||
图片预览


文档简介
第二章 化学反应速率和化学平衡——单元检测题二(含解析)
第I卷(选择题,共45分)
1.反应CH3OH ( l )+ NH3( g ) = CH3NH2( g ) + H2O ( g )在某温度自发向右进行,若反应|ΔH|= 17kJ. mol—1,|ΔH-TΔS|= 17kJ. mol—1,则下列正确的是( )
A.ΔH >0,ΔH-TΔS<0 B. ΔH <0,ΔH-TΔS>0
C.ΔH >0,ΔH-TΔS>0 D.ΔH <0,ΔH-TΔS<0
2.下列关于化学反应的速率和限度的说法正确的是( )
A.化学反应速率通常只能用反应物浓度的减少量表示
B.影响化学反应速率的条件并不只是温度和催化剂
C.化学平衡状态指的是反应物和生成物浓度相等时的状态
D.催化剂都能加快化学反应速率,提高原料利用率或转化率
3.一定量的盐酸和过量的铁粉反应,为了减缓反应速率,且不影响生成氢气的量,可向盐酸中加入适量的
A.KNO3 溶液 B.K2CO3溶液
C.CuSO4固体 D.CH3COONa固体
4.100mL 6mol/L硫酸与过量锌粉反应,在一定条件下为了减慢反应速率,又不影响生成H2的总量,可向反应物中加( )2-1-c-n-j-y
A.Na2SO4溶液 B.Na2CO3固体
C.NaNO3溶液 D.CH3COONa固体
5.在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为(????????)。
A.0.50mol/L B.0.60mol/L C.0.45mol/L D.0.55mol/L
6.下列说法中正确的是( )
A. 和与溶液反应速率相同
B. 大理石块与大理石粉分别同盐酸反应速率相同
C. 在相同条件下分别与盐酸反应,其反应速率相同
D. 和与相同形状和大小的大理石反应,速率相同
7.已知C(s)+ CO2(g) 2CO(g)正反应为吸热反应,下列措施能使正反应速率加快的是( )21教育名师原创作品
①增加少量C(s) ②升高温度 ③容器不变,再通入CO2 ④缩小体积增大压强
8.在一密闭容器中,反应aA(g) ?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
9.对于反应2HI(g)H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是(???? )
A.混合气体的颜色不再变化
B.温度和体积一定时,容器内压强不再变化
C.1molH-H键生成的同时有2molH-I键断裂
D.各物质的物质的量浓度之比为2∶1∶1
10.某温度下,在恒容密闭容器中充入NO2,发生反应2NO2(g( N2O4(g( ΔH <0,达到平衡后,下列说法不正确的是【来源:21cnj*y.co*m】
A.再充入少量NO2,达平衡后NO2的转化率升高
B.再充入少量NO2,达平衡后NO2的体积分数增大
C.再充入少量N2O4,达平衡后NO2的体积分数减小
D.升高温度,体系的颜色加深
11.在一定条件下,将1mol CO和2mol 水蒸气混合后发生如下变化:
CO(g) + H2O(g) ?CO2(g) + H2(g),?若反应达平衡时测得CO转化率为40%,则
该条件下该反应的平衡常数为(????)21·cn·jy·com
A.0.25 B.0.17 C.0.44 D.1.0
12.可逆反应N2(g)+3H2(g)2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是(?????)
①单位时间内生成n mol N2的同时,生成3n mol H2
②断开1mol H-H键的同时断开2 molN-H键
③用N2、H2、NH3的浓度变化表示的反应速率之比为1:3:2
④混合气体的压强不再改变
⑤混合气体的密度不再改变
A.②④ B.①④ C.①③④ D.②③④⑤
13.现有下列两个图像:
下列反应中符合上述图像的是(????)
A.2SO3(g)2SO2(g)+O2(g) ΔH>0
B.N2(g)+3H2(g)2NH3(g) ΔH<0
C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0
D.H2(g)+CO(g)C(s)+H2O(g) ΔH>0
14.已知某化学反应的平衡常数表达式为,在不同的温度下该反应的平衡常数值分别为:
t℃
700
800
830
1000
1200
K
1.67
1.11
1.00
0.60
0.38
有关叙述错误的是
A.该反应的化学方程式是:CO(g)+H2O(g) CO2(g)+H2(g)
B.该反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830 ℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态21教育网
D.若平衡浓度关系符合=,可判断此时温度是1000 ℃
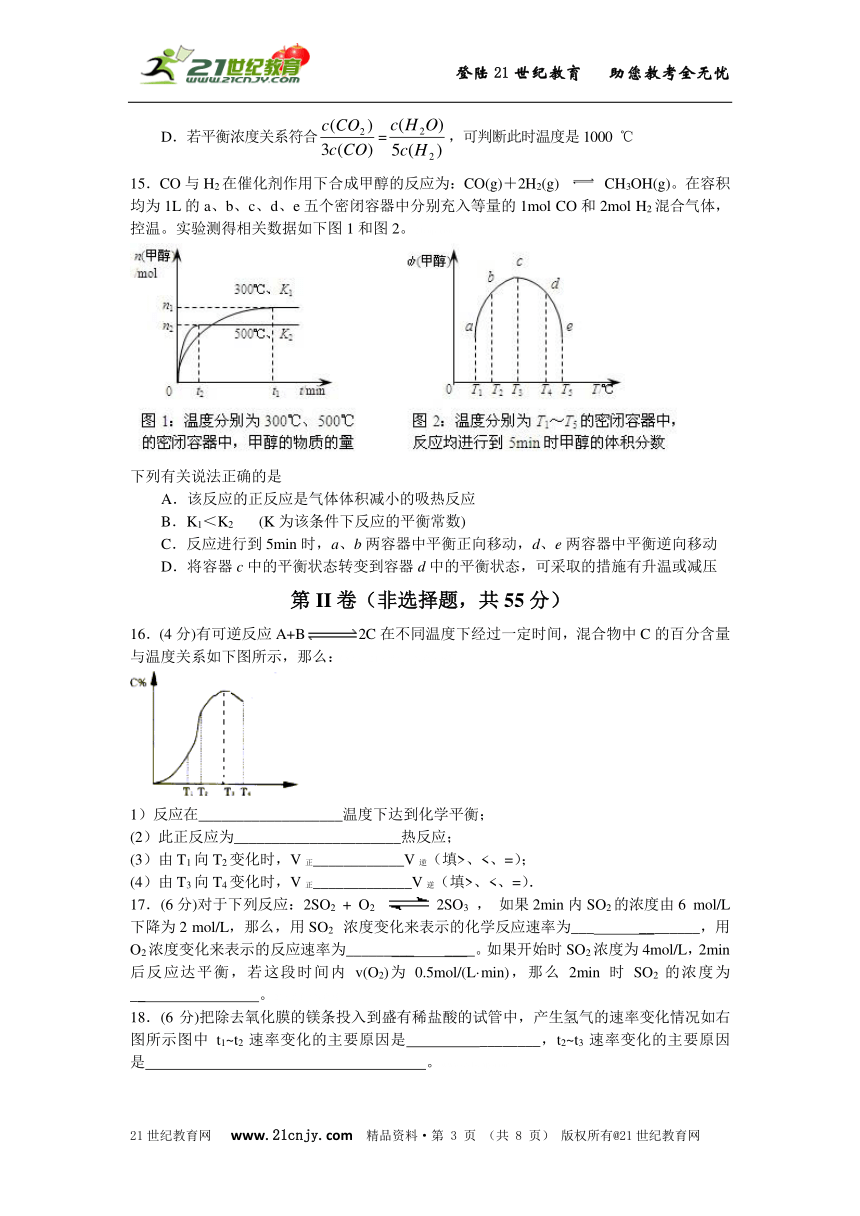
15.CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。21cnjy.com
下列有关说法正确的是
A.该反应的正反应是气体体积减小的吸热反应
B.K1<K2 (K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
第II卷(非选择题,共55分)
16.(4分)有可逆反应A+B2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么:【来源:21·世纪·教育·网】
1)反应在___________________温度下达到化学平衡;
(2)此正反应为______________________热反应;
(3)由T1向T2变化时,V正____________V逆(填>、<、=);
(4)由T3向T4变化时,V正_____________V逆(填>、<、=).
17.(6分)对于下列反应:2SO2 + O2 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2 浓度变化来表示的化学反应速率为___ ________,用O2浓度变化来表示的反应速率为_________ ____。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为__ 。21·世纪*教育网
18.(6分)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如右图所示图中t1~t2速率变化的主要原因是 ________,t2~t3速率变化的主要原因是 。www-2-1-cnjy-com
19.(7分)反应3Fe(S)+4H2O====Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:【出处:21教育名师】
①增加Fe的量,其正反应速率的变化是 (填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
③保持体积不变,充入N2使体系压强增大,其正反应速率 ,逆反应速率 。
④保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。
20.(8分)可逆反应:aA(g)+ bB(g)cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2 (填大或小);
(2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);(4)正反应为 反应。
21.(18分)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反应:3A(g)+B(g) xC(g)。请填写下列空白:【版权所有:21教育】
(1)若容器体积固定为2 L,反应2min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①2min内,A的平均反应速率为_______________,x= ;
②4min后,C的浓度___________0.8 mol/L (填“大于”、“等于” 或“小于”);
③已知平衡混合物中C的体积分数为25%,则B的转化率________;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量分别为a、b、c,它们之间应该满足的关系式为________ 、
。
(2)若维持容器压强不变:
①达到平衡时C的体积分数__________25%(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________mol A气体和__________mol B气体。(不要求写计算过程)
22.(6分)在一个容积为500毫升的密闭容器中,充入5molH2和2molCO,在一定温度和一定压强下发生如下反应:2H2(g )+CO(g) CH3OH(g),经过5分钟后达到平衡状态,若此时测得CH3OH蒸汽的浓度为2mol/L,求:21*cnjy*com
(1)以H2的浓度变化表示的该反应的速率;
(2)达到平衡时CO的转化率;
(3)该温度下的K
参考答案及解析
1.A
【解析】△G=ΔH-TΔS<0 时,反应自发进行。
2.B
【解析】A不正确,也可以是生成物浓度的增加。在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,C不正确。催化剂能影响反应速率,但不能影响平衡状态,D不正确。答案选B。
3.D
【解析】为了减缓反应速率,且不影响生成氢气的量,所以所加入的物质不能消耗氢离子,所以B错,因为会生成CO2,而A中KNO3 溶液,会形成“氢离子。故选D。
+硝酸根”组合,强氧化性离子组,消耗大量氢离子而生成氮氧化物,所以A错;加入CuSO4固体,会形成铁铜原电池,加快反应速率。C错;加入CH3COONa固体后,氢离子和醋酸根结合会形成弱酸醋酸,使氢离子浓度减小,反应速率减慢,随着反应进行,又会促进醋酸的电离,氢离子又会全部释放,所以不影响生成氢气的量。
4.AD21世纪教育网版权所有
【解析】Na2SO4溶液、NaNO3溶液 加入相当于加水,都可以减慢速率。Na2CO3固体与硫酸反应,影响氢气的总量,B错误。CH3COONa固体加入把强酸变成了弱酸,减慢了速率,又不影响生成H2的总量。AD正确。
体参加和生成,所以增大压强,反应速率加快,④可以。答案是D。
8.C
【解析】如果化学平衡不移动,B的浓度是原来的50%,题中B的浓度是原来的60%,说明化学平衡正向移动了。A项:化学反应正向移动,故错;B项:化学反应正向移动,物质A的转化率增大了,故错;D项:增大体积,平衡向体积增大的方向移动,a9.A
【解析】在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色的深浅和浓度有关系,所以选项A可以说明。反应前后气体的体积不变,因此气体的总物质的量和压强始终是不变的,B不能说明。C中反应速率的方向是相同,速率之比是相应的化学计量数之比,因此C中的关系始终是成立的,C不能说明。密平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,D不能说明,因此答案选A。
10.B
【解析】由于反应物和生成物都是一种,所以不论加入NO2还是N2O4都是洗涤液增大压强,平衡向正反应方向进行,所以选项B不正确,A、C都是正确的。正反应是放热反应,升高温度,平衡向逆反应方向进行,NO2的浓度增加,颜色加深,答案选B。
11.B
【解析】设容器体积为VL,平衡时CO、H2O、CO2、H2物质的量浓度分别为0.6/Vmol/L、1.6/Vmol/L、0.4/Vmol/L、0.4/Vmol/L,所以平衡常数K=c(CO2)·c(H2)/c(CO)·c(H2O)=1/6。
12.Awww.21-cn-jy.com
【解析】化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变。
①同位逆反应速率,故错;③无论是否达到平衡状态,化学反应速率之比都等于化学计量数B:随温度升高,K减小,即平衡左移,正反应是放热反应。
C:由方程式可计算出此时=4/9<1,所以并没有处于在平衡状态。
D:由导出为0.6,结合表格数据可知此时温度是1000 ℃
故选项C描述错误
15.D
【解析】由图1,得:降温,n(甲醇)增大,说明平衡右移,则正向为放热的,故A错误;
由图2,得:T1<T2,而升温,平衡左移,K值减小,应K1>K2,故B错误;
图2中,不一定是处于平衡状态,则无法判断,故C错误;
由图2,知:T4>T3,故c到d要升温,也就是,平衡要左移,减压也可是平衡左移,故D正确
16.(1)T3;(2)放;(3)>;(4)<
【解析】根据图像可知随着温度的升高,生成物C的含量逐渐增大,这说明此时反应并没有达到平衡状态,所以正反应速率大于逆反应速率。当C的含量达到最高时,反应即达到化学平衡状态。平衡后温度继续升高,C的含量反而降低,所以温度升高平衡向逆反应方向移动,说明逆反应速率大于正反应速率,正反应是放热反应。
17.v(SO2)=2mol/(L.min) v(O2)=1mol/(L·min) c(SO2)=2mol/L
【解析】化学反应速率通常由单位时间内浓度的变化量来表示,用SO2 浓度变化来表示的化学反应速率为。因为速率之比是相应的化学计量数之比,所以用O2浓度变化来表示的反应速率为1mol/(L·min);在这段时间内用SO2 浓度变化来表示的化学反应速率为1mol/(L·min),即其浓度变化了2mol/L,所以2min时SO2的浓度为4mol/L-2mol/L=2mol/L。
18.镁条与盐酸的反应是放热反应,溶液温度升高,反应速率加快;盐酸浓度减小,反应速率减慢。
【解析】反应在刚开始时,浓度大,所以反应速率会快,但是随着反应的不断进行,反应物的浓度会逐渐减小,反应速率也会减小。
19.①不变 ②增大;增大 ③不变;不变 ④减小;减小。
所以A的反应速率是=0.3mol/(L·min);同时生成C是0.8mol,所以根据变化量之比是相应的化学计量数之比可知,x=2。
②由于随着反应的进行,反应物的浓度逐渐降低,因此反应速率逐渐降低,所以4min后,C的浓度小于0.8 mol/L。
③设平衡时消耗B设bmol,则消耗A是3bmol,生成C是2bmol,则,解得b=0.4mol因此转化率是40%。
④这是恒温恒容条件下的等效平衡,即无论如何进行配比,只要把一端按不可逆反应形式完全转化为另一端的物质后,相当于完全等同的起始量即可。所以a、b、c之间应该满足的关系式为。2·1·c·n·j·y
(2)①由于在反应过程中,体积是减小的,所以压强也是减小。所以如果在反应过程中保持恒压,则达到平衡时C的体积分数大于25%。 21*cnjy*com
②由于是温度和压强不变,所以满足等效平衡的条件是折算之后A和B的物质的量之比等于3︰1,因此欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入6molA气体和
第I卷(选择题,共45分)
1.反应CH3OH ( l )+ NH3( g ) = CH3NH2( g ) + H2O ( g )在某温度自发向右进行,若反应|ΔH|= 17kJ. mol—1,|ΔH-TΔS|= 17kJ. mol—1,则下列正确的是( )
A.ΔH >0,ΔH-TΔS<0 B. ΔH <0,ΔH-TΔS>0
C.ΔH >0,ΔH-TΔS>0 D.ΔH <0,ΔH-TΔS<0
2.下列关于化学反应的速率和限度的说法正确的是( )
A.化学反应速率通常只能用反应物浓度的减少量表示
B.影响化学反应速率的条件并不只是温度和催化剂
C.化学平衡状态指的是反应物和生成物浓度相等时的状态
D.催化剂都能加快化学反应速率,提高原料利用率或转化率
3.一定量的盐酸和过量的铁粉反应,为了减缓反应速率,且不影响生成氢气的量,可向盐酸中加入适量的
A.KNO3 溶液 B.K2CO3溶液
C.CuSO4固体 D.CH3COONa固体
4.100mL 6mol/L硫酸与过量锌粉反应,在一定条件下为了减慢反应速率,又不影响生成H2的总量,可向反应物中加( )2-1-c-n-j-y
A.Na2SO4溶液 B.Na2CO3固体
C.NaNO3溶液 D.CH3COONa固体
5.在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为(????????)。
A.0.50mol/L B.0.60mol/L C.0.45mol/L D.0.55mol/L
6.下列说法中正确的是( )
A. 和与溶液反应速率相同
B. 大理石块与大理石粉分别同盐酸反应速率相同
C. 在相同条件下分别与盐酸反应,其反应速率相同
D. 和与相同形状和大小的大理石反应,速率相同
7.已知C(s)+ CO2(g) 2CO(g)正反应为吸热反应,下列措施能使正反应速率加快的是( )21教育名师原创作品
①增加少量C(s) ②升高温度 ③容器不变,再通入CO2 ④缩小体积增大压强
8.在一密闭容器中,反应aA(g) ?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
9.对于反应2HI(g)H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是(???? )
A.混合气体的颜色不再变化
B.温度和体积一定时,容器内压强不再变化
C.1molH-H键生成的同时有2molH-I键断裂
D.各物质的物质的量浓度之比为2∶1∶1
10.某温度下,在恒容密闭容器中充入NO2,发生反应2NO2(g( N2O4(g( ΔH <0,达到平衡后,下列说法不正确的是【来源:21cnj*y.co*m】
A.再充入少量NO2,达平衡后NO2的转化率升高
B.再充入少量NO2,达平衡后NO2的体积分数增大
C.再充入少量N2O4,达平衡后NO2的体积分数减小
D.升高温度,体系的颜色加深
11.在一定条件下,将1mol CO和2mol 水蒸气混合后发生如下变化:
CO(g) + H2O(g) ?CO2(g) + H2(g),?若反应达平衡时测得CO转化率为40%,则
该条件下该反应的平衡常数为(????)21·cn·jy·com
A.0.25 B.0.17 C.0.44 D.1.0
12.可逆反应N2(g)+3H2(g)2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是(?????)
①单位时间内生成n mol N2的同时,生成3n mol H2
②断开1mol H-H键的同时断开2 molN-H键
③用N2、H2、NH3的浓度变化表示的反应速率之比为1:3:2
④混合气体的压强不再改变
⑤混合气体的密度不再改变
A.②④ B.①④ C.①③④ D.②③④⑤
13.现有下列两个图像:
下列反应中符合上述图像的是(????)
A.2SO3(g)2SO2(g)+O2(g) ΔH>0
B.N2(g)+3H2(g)2NH3(g) ΔH<0
C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0
D.H2(g)+CO(g)C(s)+H2O(g) ΔH>0
14.已知某化学反应的平衡常数表达式为,在不同的温度下该反应的平衡常数值分别为:
t℃
700
800
830
1000
1200
K
1.67
1.11
1.00
0.60
0.38
有关叙述错误的是
A.该反应的化学方程式是:CO(g)+H2O(g) CO2(g)+H2(g)
B.该反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830 ℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态21教育网
D.若平衡浓度关系符合=,可判断此时温度是1000 ℃
15.CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。21cnjy.com
下列有关说法正确的是
A.该反应的正反应是气体体积减小的吸热反应
B.K1<K2 (K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压
第II卷(非选择题,共55分)
16.(4分)有可逆反应A+B2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么:【来源:21·世纪·教育·网】
1)反应在___________________温度下达到化学平衡;
(2)此正反应为______________________热反应;
(3)由T1向T2变化时,V正____________V逆(填>、<、=);
(4)由T3向T4变化时,V正_____________V逆(填>、<、=).
17.(6分)对于下列反应:2SO2 + O2 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2 浓度变化来表示的化学反应速率为___ ________,用O2浓度变化来表示的反应速率为_________ ____。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为__ 。21·世纪*教育网
18.(6分)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如右图所示图中t1~t2速率变化的主要原因是 ________,t2~t3速率变化的主要原因是 。www-2-1-cnjy-com
19.(7分)反应3Fe(S)+4H2O====Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:【出处:21教育名师】
①增加Fe的量,其正反应速率的变化是 (填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
③保持体积不变,充入N2使体系压强增大,其正反应速率 ,逆反应速率 。
④保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。
20.(8分)可逆反应:aA(g)+ bB(g)cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2 (填大或小);
(2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);(4)正反应为 反应。
21.(18分)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反应:3A(g)+B(g) xC(g)。请填写下列空白:【版权所有:21教育】
(1)若容器体积固定为2 L,反应2min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①2min内,A的平均反应速率为_______________,x= ;
②4min后,C的浓度___________0.8 mol/L (填“大于”、“等于” 或“小于”);
③已知平衡混合物中C的体积分数为25%,则B的转化率________;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量分别为a、b、c,它们之间应该满足的关系式为________ 、
。
(2)若维持容器压强不变:
①达到平衡时C的体积分数__________25%(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________mol A气体和__________mol B气体。(不要求写计算过程)
22.(6分)在一个容积为500毫升的密闭容器中,充入5molH2和2molCO,在一定温度和一定压强下发生如下反应:2H2(g )+CO(g) CH3OH(g),经过5分钟后达到平衡状态,若此时测得CH3OH蒸汽的浓度为2mol/L,求:21*cnjy*com
(1)以H2的浓度变化表示的该反应的速率;
(2)达到平衡时CO的转化率;
(3)该温度下的K
参考答案及解析
1.A
【解析】△G=ΔH-TΔS<0 时,反应自发进行。
2.B
【解析】A不正确,也可以是生成物浓度的增加。在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,C不正确。催化剂能影响反应速率,但不能影响平衡状态,D不正确。答案选B。
3.D
【解析】为了减缓反应速率,且不影响生成氢气的量,所以所加入的物质不能消耗氢离子,所以B错,因为会生成CO2,而A中KNO3 溶液,会形成“氢离子。故选D。
+硝酸根”组合,强氧化性离子组,消耗大量氢离子而生成氮氧化物,所以A错;加入CuSO4固体,会形成铁铜原电池,加快反应速率。C错;加入CH3COONa固体后,氢离子和醋酸根结合会形成弱酸醋酸,使氢离子浓度减小,反应速率减慢,随着反应进行,又会促进醋酸的电离,氢离子又会全部释放,所以不影响生成氢气的量。
4.AD21世纪教育网版权所有
【解析】Na2SO4溶液、NaNO3溶液 加入相当于加水,都可以减慢速率。Na2CO3固体与硫酸反应,影响氢气的总量,B错误。CH3COONa固体加入把强酸变成了弱酸,减慢了速率,又不影响生成H2的总量。AD正确。
体参加和生成,所以增大压强,反应速率加快,④可以。答案是D。
8.C
【解析】如果化学平衡不移动,B的浓度是原来的50%,题中B的浓度是原来的60%,说明化学平衡正向移动了。A项:化学反应正向移动,故错;B项:化学反应正向移动,物质A的转化率增大了,故错;D项:增大体积,平衡向体积增大的方向移动,a
【解析】在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色的深浅和浓度有关系,所以选项A可以说明。反应前后气体的体积不变,因此气体的总物质的量和压强始终是不变的,B不能说明。C中反应速率的方向是相同,速率之比是相应的化学计量数之比,因此C中的关系始终是成立的,C不能说明。密平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,D不能说明,因此答案选A。
10.B
【解析】由于反应物和生成物都是一种,所以不论加入NO2还是N2O4都是洗涤液增大压强,平衡向正反应方向进行,所以选项B不正确,A、C都是正确的。正反应是放热反应,升高温度,平衡向逆反应方向进行,NO2的浓度增加,颜色加深,答案选B。
11.B
【解析】设容器体积为VL,平衡时CO、H2O、CO2、H2物质的量浓度分别为0.6/Vmol/L、1.6/Vmol/L、0.4/Vmol/L、0.4/Vmol/L,所以平衡常数K=c(CO2)·c(H2)/c(CO)·c(H2O)=1/6。
12.Awww.21-cn-jy.com
【解析】化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变。
①同位逆反应速率,故错;③无论是否达到平衡状态,化学反应速率之比都等于化学计量数B:随温度升高,K减小,即平衡左移,正反应是放热反应。
C:由方程式可计算出此时=4/9<1,所以并没有处于在平衡状态。
D:由导出为0.6,结合表格数据可知此时温度是1000 ℃
故选项C描述错误
15.D
【解析】由图1,得:降温,n(甲醇)增大,说明平衡右移,则正向为放热的,故A错误;
由图2,得:T1<T2,而升温,平衡左移,K值减小,应K1>K2,故B错误;
图2中,不一定是处于平衡状态,则无法判断,故C错误;
由图2,知:T4>T3,故c到d要升温,也就是,平衡要左移,减压也可是平衡左移,故D正确
16.(1)T3;(2)放;(3)>;(4)<
【解析】根据图像可知随着温度的升高,生成物C的含量逐渐增大,这说明此时反应并没有达到平衡状态,所以正反应速率大于逆反应速率。当C的含量达到最高时,反应即达到化学平衡状态。平衡后温度继续升高,C的含量反而降低,所以温度升高平衡向逆反应方向移动,说明逆反应速率大于正反应速率,正反应是放热反应。
17.v(SO2)=2mol/(L.min) v(O2)=1mol/(L·min) c(SO2)=2mol/L
【解析】化学反应速率通常由单位时间内浓度的变化量来表示,用SO2 浓度变化来表示的化学反应速率为。因为速率之比是相应的化学计量数之比,所以用O2浓度变化来表示的反应速率为1mol/(L·min);在这段时间内用SO2 浓度变化来表示的化学反应速率为1mol/(L·min),即其浓度变化了2mol/L,所以2min时SO2的浓度为4mol/L-2mol/L=2mol/L。
18.镁条与盐酸的反应是放热反应,溶液温度升高,反应速率加快;盐酸浓度减小,反应速率减慢。
【解析】反应在刚开始时,浓度大,所以反应速率会快,但是随着反应的不断进行,反应物的浓度会逐渐减小,反应速率也会减小。
19.①不变 ②增大;增大 ③不变;不变 ④减小;减小。
所以A的反应速率是=0.3mol/(L·min);同时生成C是0.8mol,所以根据变化量之比是相应的化学计量数之比可知,x=2。
②由于随着反应的进行,反应物的浓度逐渐降低,因此反应速率逐渐降低,所以4min后,C的浓度小于0.8 mol/L。
③设平衡时消耗B设bmol,则消耗A是3bmol,生成C是2bmol,则,解得b=0.4mol因此转化率是40%。
④这是恒温恒容条件下的等效平衡,即无论如何进行配比,只要把一端按不可逆反应形式完全转化为另一端的物质后,相当于完全等同的起始量即可。所以a、b、c之间应该满足的关系式为。2·1·c·n·j·y
(2)①由于在反应过程中,体积是减小的,所以压强也是减小。所以如果在反应过程中保持恒压,则达到平衡时C的体积分数大于25%。 21*cnjy*com
②由于是温度和压强不变,所以满足等效平衡的条件是折算之后A和B的物质的量之比等于3︰1,因此欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入6molA气体和
