鲁教版八年级化学全册单元测试《第3单元 物质构成的奥秘》(1)(解析版)
文档属性
| 名称 | 鲁教版八年级化学全册单元测试《第3单元 物质构成的奥秘》(1)(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 173.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-02 10:44:44 | ||
图片预览




文档简介
《第3单元
物质构成的奥秘》(1)
一、选择题(下列各题只有一个正确选项,每小题2分,共计20分)
1.小华用凉开水养鱼,不久鱼儿全死了.下列解释合理的是( )
A.凉开水中几乎不含氧元素
B.凉开水中几乎不含氧原子
C.凉开水中几乎不含水分子
D.凉开水中几乎不含氧气
2.下列符号只具有微观意义的是( )
A.H2
B.H2SO4
C.2H2O
D.C2H2
3.氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等领域.已知氮、硅的原子结构示意图依次为.请推测,氮化硅的化学式(分子式)为( )
A.Si3N4
B.Si4N3
C.Si3N7
D.Si7N3
4.下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )
A.它们结合其他原子的个数相同
B.它们的质子数不同
C.它们的最外层电子数相同
D.它们的核外电子数不同
5.我国在1993年成功制取了一种由相对原子质量为18、核电荷数为8的氧原子构成的双原子分子气体,下列说法正确的是( )
A.这种气体的相对分子质量是32
B.这种氧原子和氢原子构成的水分子,其相对分子质量为20
C.这种氧原子的核内质子数为10
D.这种氧原子的核外电子数为10
6.测得某溶液中仅含有Na+、Mg2+、SO42﹣、Cl﹣四种离子,其中离子个数比为Na+:Mg2+:Cl﹣=4:5:8,若设Na+为4n个,则SO42﹣的离子数为( )
A.2n
B.3n
C.6n
D.8n
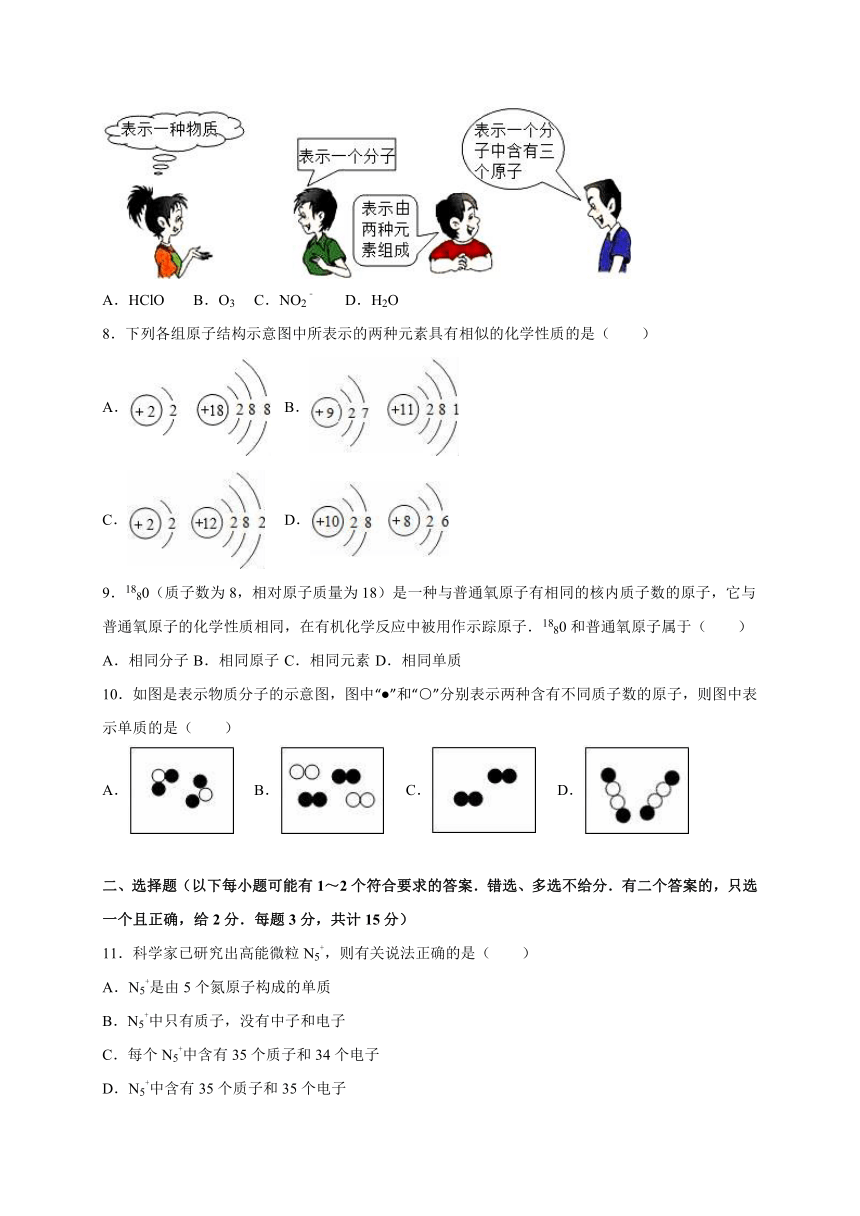
7.如图,这四位同学描述的可能是下面的同一个化学符号( )
A.HClO
B.O3
C.NO2﹣
D.H2O
8.下列各组原子结构示意图中所表示的两种元素具有相似的化学性质的是( )
A.
B.
C.
D.
9.1880(质子数为8,相对原子质量为18)是一种与普通氧原子有相同的核内质子数的原子,它与普通氧原子的化学性质相同,在有机化学反应中被用作示踪原子.1880和普通氧原子属于( )
A.相同分子
B.相同原子
C.相同元素
D.相同单质
10.如图是表示物质分子的示意图,图中“●”和“○”分别表示两种含有不同质子数的原子,则图中表示单质的是( )
A.
B.
C.
D.
二、选择题(以下每小题可能有1~2个符合要求的答案.错选、多选不给分.有二个答案的,只选一个且正确,给2分.每题3分,共计15分)
11.科学家已研究出高能微粒N5+,则有关说法正确的是( )
A.N5+是由5个氮原子构成的单质
B.N5+中只有质子,没有中子和电子
C.每个N5+中含有35个质子和34个电子
D.N5+中含有35个质子和35个电子
12.十九世纪初,意大利科学家阿伏伽德罗在总结前人工作的基础上,提出了分子概念,认为:①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;④分子是保持物质化学性质的最小粒子;⑤分子的质量等于构成它的原子的质量之和;⑥分子在不停地运动.从你所学知识看,上述观点中存在明显不足的是( )
A.①③
B.①②⑤
C.④⑤⑥
D.③⑤
13.由碳、氧元素组成的气体中,碳与氧的质量比为3:5,则该气体可能是( )
A.由CO2
或CO单独组成的纯净物
B.由CO和CO2
共同组成的混合物
C.由CO和O2
共同组成的混合物
D.由O2和CO2
共同组成的混合物
14.核外电子数相同,核内质子数不同的两种粒子,它们可能是( )
A.一种元素的原子和另一种元素的离子
B.同种元素的原子和离子
C.两种不同元素的原子
D.两种不同元素的离子
15.由如图所示粒子结构示意图得出的结论中,错误的是( )
A.①、②分别与④、⑤反应均能形成与③电子层结构相同的粒子
B.上述粒子间能形成AB型、AB2型、A2B型化合物
C.上述粒子形成化合物前后,质子总数、电子总数均发生改变,而质量不变
D.上述粒子形成化合物前后,在化合物中均能显示可变化合价
三、简答题
16.古希腊著名学者亚里士多德曾提出过“四元素说”,认为火、空气、土、水是构成世界万物的基本元素,它们两两作用产生物质的基本性质﹣﹣热、冷、干、湿,如图所示.你认为“空气”和“水”是元素吗?为什么?
17.对“原子在化学反应中不可再分”这一句话,在学完了原子结构和核外电子排布知识后,你是怎样理解的?
四、填空题
18.用化学符号表示:3个氮原子______,+3价的铝元素______,n个水分子______,2个铁离子______,2个铵根离子______.
19.欢迎参加我们的化学俱乐部,请你写出符合与下列特征提示相关的物质名称
提示1
提示2
提示3
物质名称
物质1
液体
银白色
温度计
______
物质2
碳元素
很硬
昂贵
______
物质3
空气
植物根系
保护气
______
物质4
无色
光合作用
人工降雨
______
20.化学与我们的生活密切相关,日常生活中的化学知识有很多.想想看,你知道生活中常用的以下物质分别含有什么化学成分?
①“干冰”常用于人工降雨,干冰中的“冰”是指______;(填化学式)
②管道煤气中含有使人中毒的成分,该有毒气体是指______;(填化学式)
③碘酒是生活中常用的皮肤消毒剂,碘酒中的“酒”是指______;(填名称)
④天然气是常用的气体燃料,天然气中的“气”主要是指______;(填化学式)
21.图是从空气中分离氧气的示意图:请你写出从图中所获得的有关物质组成、结构、性质、变化等信息各一条:
组成:______
结构:______
性质:______
变化:______.
22.如图是四种粒子的结构示意图:序号填空:
(1)电子层排布相同的是______;
(2)属于同种元素的是______;
(3)表示阳离子的是______;
(4)属于非金属元素原子的是______.
23.科学家发现,细胞膜中存在着某种只允许水分子出入的通道﹣﹣﹣﹣水通道.右图是2003年诺贝尔化学奖获得者彼得 阿格雷公布的世界上第一张水通道蛋白的示意图.
(1)如图水通道中的每个“”表示:①______;
②______.
(2)根据示意图,由于水通道中间的正电荷对H+离子有______作用,所以,H+离子不能通过该水通道.
24.俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.表为元素周期表的部分示意图,表中数字为各元素原子的质子数,利用下表回答相关问题:
(1)用符号表示:带两个单位负电荷且质子数为8的离子______(写一种).AB2型化合物______、______(写两种).
(2)去年底重庆开县发生天然气“井喷”事件.喷出的气体中有一种有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸,请用符号和数字表示:3个A2B分子______.
(3)研究表中各元素原子的质子数,可发现元素从左向右的排列规律是______,请预测质子数为20的元素在表中的位置______(填①、②、③).
(4)已知元素周期表中原子序数等于质子数.请从元素种类、质子数分析第二、第三周期的元素分布,有什么规律?______.
五、实验与探究题
25.
NaOH溶液可使无色酚酞变红.我们知道NaOH溶液中含有Na+离子、OH﹣离子、H2O分子,如要探究是哪种微粒使酚酞变红,请填写如表内容:
实验步骤
现象
分析推理过程
结论
______
______
______
______
六、计算题
26.自然界生命体的有机物组成除C、H、O外还有其他元素,如藻类物质(化学式可表示为C106H263O110N16P)的组成中就含有N和P.α﹣丙氨酸是组成人体蛋白质的氨基酸之一,其分子结构如图所示:
(1)写出α﹣丙氨酸的化学式.
(2)α﹣丙氨酸中氮元素的质量分数是多少?
《第3单元
物质构成的奥秘》(1)
参考答案与试题解析
一、选择题(下列各题只有一个正确选项,每小题2分,共计20分)
1.小华用凉开水养鱼,不久鱼儿全死了.下列解释合理的是( )
A.凉开水中几乎不含氧元素
B.凉开水中几乎不含氧原子
C.凉开水中几乎不含水分子
D.凉开水中几乎不含氧气
【考点】氧气的物理性质;氧气的用途.
【分析】为什么凉开水不能养鱼,而一般的水则可以?通过比较凉开水与一般水的区别入手,从而认识到鱼儿是由于缺氧而死.
【解答】解:
A、说法错误,水是有氢氧两种元素组成的.
B、错误,水中含有许多水分子,每个水分子里都有氧原子.
C、凉开水也是水,也是由水分子构成的.
D、凉开水经过沸腾,水中不含有氧气,导致金鱼缺氧.
【点评】温度升高,气体在水中的溶解度下降,水中的氧气就逐渐减少.压强减小,气体在水中的溶解度也减少.
2.下列符号只具有微观意义的是( )
A.H2
B.H2SO4
C.2H2O
D.C2H2
【考点】化学符号及其周围数字的意义.
【分析】化学式具有两方面的意义,一方面表示宏观意义,而另一方面表示微观意义.而在化学式的前面加上相应的数字,它只表示微观意义.
【解答】解:化学式即表示宏观意义,也可表示微观意义.即可表示这种物质,也可表示这种物质的一个分子.所以ABD具有两方面的意义.而在化学式的前面加数字,如C只表示2个水分子.只表示微观意义.
故选C
【点评】初中所接触到的化学式、离子符号、元素符号等都具有两方面的意义,即可表宏观,又可表微观.而在这些符号的前面加相应的数字只表示微观.
3.氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等领域.已知氮、硅的原子结构示意图依次为.请推测,氮化硅的化学式(分子式)为( )
A.Si3N4
B.Si4N3
C.Si3N7
D.Si7N3
【考点】有关化学式的计算和推断;核外电子在化学反应中的作用;化合价规律和原则.
【专题】结合课本知识的信息.
【分析】根据氮、硅的原子结构示意图,分析得出元素的化合价,然后利用化合价来书写化学式.
【解答】解:由氮原子的结构示意图,可以看出最外层电子数为5,容易得到3个电子,则N元素的化合价为﹣3价;由硅原子的结构示意图,可以看出最外层电子数为4,一般不容易失去也不容易得到电子,但可以与其它元素以共用电子对形成化合物,则元素的化合价为+4价,则,化合价不能约分可直接交叉,使化合物中正负化合价的代数和为0,得化学式为Si3N4,
故选A.
【点评】本题考查学生利用化合价来书写物质的化学式,学生应能根据原子结构得出元素在形成化合物时的化合价,然后可利用化合价和化合价的原则来书写化学式.
4.下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )
A.它们结合其他原子的个数相同
B.它们的质子数不同
C.它们的最外层电子数相同
D.它们的核外电子数不同
【考点】原子和离子的相互转化.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据Fe、Fe2+、Fe3+三种粒子可以看出:它们都是铁元素形成的不同微粒,则它们的质子数相同,它们的电子数不同,化学性质不同.
【解答】解:A、因Fe、Fe2+、Fe3+三种粒子的核外电子数不同,最外层电子数也不同,所以化学性质不同,它们结合其他原子的个数不相同.故A说法不正确;
B、它们是同种元素形成的微粒,核电荷数相同,则质子数相同.故B说法不正确;
C、因金属原子失去电子变为金属阳离子,且Fe2+、Fe3+带电荷不同,则原子变为离子失去的电子数不同,则三种粒子的核外电子数不同,最外层电子数不同,故C说法不正确;
D、由以上分析可知,它们的核外电子数不同,故D说法正确.
故选D.
【点评】本题考查原子和离子的相互转化,学生应注意单原子形成的微粒中质子数与电子数的关系,抓住质子数是判断元素的关键.
5.我国在1993年成功制取了一种由相对原子质量为18、核电荷数为8的氧原子构成的双原子分子气体,下列说法正确的是( )
A.这种气体的相对分子质量是32
B.这种氧原子和氢原子构成的水分子,其相对分子质量为20
C.这种氧原子的核内质子数为10
D.这种氧原子的核外电子数为10
【考点】相对分子质量的概念及其计算;原子的有关数量计算.
【专题】化学式的计算.
【分析】根据相对分子质量为构成分子的各原子的相对原子质量之和,原子中:核电荷数=核内质子数=核外电子数,结合题意进行分析解答.
【解答】解:由题意,我国在1993年成功制取了一种由相对原子质量为18、核电荷数为8的氧原子构成的双原子分子气体.
A、这种气体的相对分子质量是18×2=36,故选项说法错误.
B、这种氧原子和氢原子构成的水分子,其相对分子质量为1×2+18=20,故选项说法正确.
C、原子中:核电荷数=核内质子数,这种氧原子的核电荷数为8,其核内质子数为8,故选项说法错误.
D、原子中:核电荷数=核内质子数=核外电子数,这种氧原子的核电荷数为8,其核外电子数为8,故选项说法错误.
故选B.
【点评】本题难度不大,解题的关键是掌握并灵活运用化学式的有关计算、原子中核电荷数=核内质子数=核外电子数.
6.测得某溶液中仅含有Na+、Mg2+、SO42﹣、Cl﹣四种离子,其中离子个数比为Na+:Mg2+:Cl﹣=4:5:8,若设Na+为4n个,则SO42﹣的离子数为( )
A.2n
B.3n
C.6n
D.8n
【考点】有关元素化合价的计算.
【专题】化学式的计算.
【分析】由溶液中离子个数比为Na+:Mg2+:Cl﹣=4:5:8,若Na+为4n个,则Mg2+与Cl﹣个数分别为5n与8n个;根据溶液中阴阳离子所带电荷总数相等,计算溶液中SO42﹣的离子数.
【解答】解:由于溶液中离子个数比为Na+:Mg2+:Cl﹣=4:5:8,若Na+为4n个,则Mg2+与Cl﹣个数分别为5n与8n个;
根据溶液中阴阳离子所带电荷总数相等,由溶液中SO42﹣的离子数==3n
故选B.
【点评】溶液中虽然含有带正电的阳离子和带负电的阴离子,但阴阳离子所带电荷总数相等、电性相反,因此整个溶液不现电性.
7.如图,这四位同学描述的可能是下面的同一个化学符号( )
A.HClO
B.O3
C.NO2﹣
D.H2O
【考点】化学符号及其周围数字的意义;化学式的书写及意义.
【专题】物质的微观构成与物质的宏观组成;化学用语和质量守恒定律.
【分析】化学式可以表示一种物质,该物质的元素组成,该物质的分子构成,该分子的原子构成.
【解答】解:A、HClO中含有氢、氯、氧三种元素,不符合第三位同学的描述,因此排除选项A.
B、O3中只含氧元素,不符合第三位同学的描述,因此排除选项B.
C、NO2﹣表示一种离子,不能表示物质,不符合第一位同学的描述,因此排除选项C.
D、只有H2O能表示水这种物质,能表示1个水分子,能表示水由氢、氧两种元素组成,还能表示1个水分子中含有1个氧原子和2个氢原子共3个原子.因此选项D正确.
故选D.
【点评】本题主要考查化学式的含义,解答时要注意理解宏观组成和微观构成的区别.
8.下列各组原子结构示意图中所表示的两种元素具有相似的化学性质的是( )
A.
B.
C.
D.
【考点】原子结构示意图与离子结构示意图;核外电子在化学反应中的作用.
【专题】微观粒子模拟图型.
【分析】元素的化学性质取决于该元素原子的最外层电子数,最外层电子数小于4,易失电子;最外层电子数大于4,易得电子;最外层电子数为8(He除外),性质稳定.
【解答】解:A、质子数为2的原子为He原子,质子数为18的原子为Ar原子,二者都是稀有气体元素,化学性质都表现为稳定;
B、质子数为9的原子最外层有7个电子,不稳定,易得1个电子而形成稳定结构;质子数为11的原子最外层有1个电子,不稳定,易失去最外层的1个电子而形成稳定结构;化学性质迥然不同;
C、虽然两种元素的原子的最外层电子数相同,但它们的化学性质却完全不同.质子数为2的He为稀有气体元素,化学性质稳定;而质子数为12的原子最外层电子数为2,不稳定,易失最外层的2个电子形成稳定结构;
D、质子数为10的原子,最外层电子达8电子稳定结构,性质稳定;质子数为8的原子最外层电子数为6,不稳定,易得2个电子形成稳定结构.两种元素化学性质无相似处.
故选:A.
【点评】最外层电子数为8称为稳定结构(He除外),具有这种结构的粒子化学性质稳定.
9.1880(质子数为8,相对原子质量为18)是一种与普通氧原子有相同的核内质子数的原子,它与普通氧原子的化学性质相同,在有机化学反应中被用作示踪原子.1880和普通氧原子属于( )
A.相同分子
B.相同原子
C.相同元素
D.相同单质
【考点】元素的概念.
【专题】压轴实验题;物质的微观构成与物质的宏观组成.
【分析】根据元素的含义可知质子数决定元素种类进行解答.
【解答】解:质子数决定元素种类,1880的质子数为8,普通氧原子的质子数也为8,所以为同种元素的不同原子.
故选:C.
【点评】同种元素的原子,其中子数可能不同,但不影响它的化学性质.
10.如图是表示物质分子的示意图,图中“●”和“○”分别表示两种含有不同质子数的原子,则图中表示单质的是( )
A.
B.
C.
D.
【考点】单质和化合物的判别.
【专题】物质的分类.
【分析】同种原子构成的分子为单质分子,不同种原子构成的分子为化合物分子;同种物质的分子构成纯净物,不同物质的分子构成的混合物,确定为纯净物后,再判断分子是否为同种原子构成,据此回答问题即可;
【解答】解:A、图中两个分子构成相同,为同种物质的分子,该图所表示物质为纯净物;并且该分子由两种不同的原子构成,为化合物的分子;
B、图中四个分子构成不同,为两种不同物质的分子,是两种不同物质的单质,该图所示物质为混合物;
C、图中两个分子构成相同,为同种物质的分子,且该分子由同种原子构成,所以该图示表示的是单质;
D、图所示物质为化合物;图中两个分子构成相同,为同种物质的分子,该图所表示物质为纯净物;并且该分子由两种不同和原子构成,为化合物的分子;图所示物质为化合物.
故选C.
【点评】分子同原子构成,构成相同的分子为同种物质的分子,同种物质的分子构成的物质为纯净物;不同种原子构成的分子为化合物分子,同种原子构成的分子为单质分子.
二、选择题(以下每小题可能有1~2个符合要求的答案.错选、多选不给分.有二个答案的,只选一个且正确,给2分.每题3分,共计15分)
11.科学家已研究出高能微粒N5+,则有关说法正确的是( )
A.N5+是由5个氮原子构成的单质
B.N5+中只有质子,没有中子和电子
C.每个N5+中含有35个质子和34个电子
D.N5+中含有35个质子和35个电子
【考点】原子的定义与构成;原子和离子的相互转化.
【专题】结合课本知识的信息;压轴实验题.
【分析】先从N5+的表示方法得到它是一个带有一个单位正电荷的离子,再根据氮原子核内有7个质子和离子带电的原理分析出N5+中的质子数和电子数,从而判断正确答案.
【解答】解:从N5+的表示方法可看出它是一个带有一个单位正电荷的离子,其中每个氮原子核内有7个质子,当原子的核内质子数和电子数相等时,原子不显电性,而N5+带有一个单位的正电荷,所以N5+中含有35个质子和34个电子.所以只有选项C正确.
故选:C.
【点评】主要考查了原子的构成和原子和离子之间的相互转化.离子是由于质子和电子的数目相等而不带电.
12.十九世纪初,意大利科学家阿伏伽德罗在总结前人工作的基础上,提出了分子概念,认为:①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;④分子是保持物质化学性质的最小粒子;⑤分子的质量等于构成它的原子的质量之和;⑥分子在不停地运动.从你所学知识看,上述观点中存在明显不足的是( )
A.①③
B.①②⑤
C.④⑤⑥
D.③⑤
【考点】分子、原子、离子、元素与物质之间的关系;分子和原子的区别和联系.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据所学的分子和原子的性质进行分析,分子是保持物质化学性质的微粒;原子是化学变化中最小的微粒;带电的原子或原子团称为离子.
【解答】解:构成物质的微粒有分子、原子和离子,故①不正确;分子是由原子构成的,故②正确;金属和稀有气体都是由原子直接构成的,故原子可以独立存在,故③不正确;分子是保持物质化学性质的最小粒子,故④正确;分子的质量等于构成它的原子的质量之和,故⑤正确;分子是不停的运动着的,故⑥正确;故存在明显不足的是①③.
故选A.
【点评】由分子构成的物质其化学性质由分子保持,由原子构成的物质其化学性质由原子保持.
13.由碳、氧元素组成的气体中,碳与氧的质量比为3:5,则该气体可能是( )
A.由CO2
或CO单独组成的纯净物
B.由CO和CO2
共同组成的混合物
C.由CO和O2
共同组成的混合物
D.由O2和CO2
共同组成的混合物
【考点】有关化学式的计算和推断;元素质量比的计算.
【专题】化学式的计算.
【分析】根据物质的化学式,可以计算组成元素的质量比,根据组成元素的质量比可以判断气体的组成情况.
【解答】解:二氧化碳、一氧化碳中碳元素和氧元素质量比分别是:12:32=3:8,12:16=3:4,
A、由CO2
或CO单独组成的纯净物中碳元素和氧元素质量比是3:8,或3:4,该选项不正确;
B、由CO和CO2
共同组成的混合物中碳与氧的质量比可能为3:5,该选项正确;
C、由CO和O2
共同组成的混合物中,由于一氧化碳中碳元素和氧元素质量比是3:4,因此碳与氧的质量比可能为3:5,该选项正确;
D、由O2和CO2
共同组成的混合物中,由于二氧化碳中碳元素和氧元素的质量比是3:8,因此混合物中碳元素和氧元素质量比小于3:8,该选项不正确.
故选:BC.
【点评】本题主要考查根据物质的化学式计算组成元素的元素质量比方面的问题,计算时要注意准确性.
14.核外电子数相同,核内质子数不同的两种粒子,它们可能是( )
A.一种元素的原子和另一种元素的离子
B.同种元素的原子和离子
C.两种不同元素的原子
D.两种不同元素的离子
【考点】原子和离子的相互转化;元素的概念.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据不同种元素最本质的区别是质子数不同,可推断:不同质子数,说明肯定不是同种元素的粒子;相同电子数即“核外电子数相同”,说明它们核外电子结构相同,而它们的质子数不同,说明肯定不是两种不同元素的原子的两种粒子;据此即可判定正确的选项.
【解答】解:A、一种元素的原子和另一种元素的离子,符合不同质子数、相同电子数的两种粒子,故A正确;
B、同一元素,质子数就一定相同,故B错误;
C、不同元素的原子,电子数肯定不同,故C错误;
D、不同元素的离子,如Na+
和
Mg2+,都是离子,而且质子数不同,而电子数相同,故D正确.
故选AD.
【点评】解答本题必须理解不同质子数、相同电子数的含义,才能正确解答.
15.由如图所示粒子结构示意图得出的结论中,错误的是( )
A.①、②分别与④、⑤反应均能形成与③电子层结构相同的粒子
B.上述粒子间能形成AB型、AB2型、A2B型化合物
C.上述粒子形成化合物前后,质子总数、电子总数均发生改变,而质量不变
D.上述粒子形成化合物前后,在化合物中均能显示可变化合价
【考点】原子结构示意图与离子结构示意图.
【专题】化学用语和质量守恒定律.
【分析】由粒子结构示意图可知:粒子①核内8个质子,最外层6个电子,易得2个电子;粒子②核内9个质子,最外层7个电子,易得1个电子;粒子③核内10个质子,核外电子结构为2、8结构;粒子④核内11个质子,最外层1个电子,易失去该层上的1个电子;粒子⑤核内12个质子,最外层2个电子,易失去该层上的2个电子;
根据五种粒子的结构示意图所反映的粒子构成,利用元素化学性质决定于最外层电子数等对选项中的结论进行评价.
【解答】解:A、由粒子①、②、④、⑤的最外层电子数可知,在反应中,粒子①易得2个电子、粒子②易得1个电子、粒子④易失去该层上的1个电子、粒子⑤易失去该层上的2个电子而形成与粒子③核外电子结构为2、8结构相同的粒子;故A正确;
B、根据在反应中,粒子①易得2个电子、粒子②易得1个电子、粒子④易失去该层上的1个电子、粒子⑤易失去该层上的2个电子,利用化合物中得失电子总数相等,粒子①与粒子⑤、粒子②与粒子④可形成AB型化合物;粒子⑤与粒子②可结合成AB2型化合物;粒子④与粒子①可结合成A2B型化合物;故B正确;
C、由于化学反应中原子的种类以及个数不会变化,只是发生了电子的转移,所以上述粒子形成化合物前后,质子总数、电子总数均不发生改变,故C不正确;
D、依据对①﹣⑤原子所表示的元素情况可知:在含有F、Na、Mg元素的化合物中一般存在固定化合价,Ne化学性质相对稳定一般很难形成化合物,而氧元素可能存在可变的化合价;故D不正确;
故选CD.
【点评】质子数等于核外电子数的粒子结构图为原子的结构示意图,在原子结构示意图中,最外层电子层数大于4,易得电子;最外层电子数小于4,易失去最外层上的电子.
三、简答题
16.古希腊著名学者亚里士多德曾提出过“四元素说”,认为火、空气、土、水是构成世界万物的基本元素,它们两两作用产生物质的基本性质﹣﹣热、冷、干、湿,如图所示.你认为“空气”和“水”是元素吗?为什么?
【考点】元素的概念.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称进行分析解答本题.
【解答】解:元素是具有相同核电荷数(即核内质子数)的一类原子的总称,而“空气”“水”分别是由不同种元素组成的物质.
故答案为:不是;元素是具有相同核电荷数同一类原子的总称,而“空气”、“水”是由不同种元素组成的物质.
【点评】本题考查学生根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称进行分析解题的能力
17.对“原子在化学反应中不可再分”这一句话,在学完了原子结构和核外电子排布知识后,你是怎样理解的?
【考点】原子的定义与构成.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据已有的原子的构成的知识进行分析解答即可.
【解答】解:原子可以分为原子核和核外电子,原子在化学变化中原子核不发生改变,所以原子种类就不发生改变,而核外电子可以得失,故答案为:原子在化学变化中原子核不发生改变,所以原子种类就不发生改变,而核外电子可以得失.
【点评】本题考查的是原子结构的知识,完成此题,可以依据已有的知识进行.
四、填空题
18.用化学符号表示:3个氮原子 3N ,+3价的铝元素 ,n个水分子 nH2O ,2个铁离子 2Fe3+ ,2个铵根离子 2NH4+ .
【考点】化学符号及其周围数字的意义.
【专题】化学用语和质量守恒定律.
【分析】原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.
化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后.
分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字.
离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
【解答】解:由原子的表示方法:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,则3个氮原子可表示为:3N.
由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故+3价的铝元素可表示为:.
由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则n个水分子可表示为:nH2O.
由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.2个铁离子、2个铵根离子分别可表示为2Fe3+、2NH4+.
故答案为:3N;;nH2O;2Fe3+;2NH4+.
【点评】本题难度不大,掌握常见化学用语(原子符号、分子符号、化合价、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.
19.欢迎参加我们的化学俱乐部,请你写出符合与下列特征提示相关的物质名称
提示1
提示2
提示3
物质名称
物质1
液体
银白色
温度计
水银
物质2
碳元素
很硬
昂贵
金刚石
物质3
空气
植物根系
保护气
氮气
物质4
无色
光合作用
人工降雨
二氧化碳
【考点】金属的物理性质及用途;常见气体的用途;二氧化碳的用途;碳单质的物理性质及用途.
【专题】物质的性质与用途.
【分析】(1)根据水银的物理性质和用途进行分析判断;
(2)根据金刚石的物理性质和用途进行分析判断;
(3)根据氮气的物理性质和用途进行分析判断;
(4)根据二氧化碳性质和用途进行分析判断.
【解答】解:(1)温度计中填充的银白色的液体是水银,故填:水银;
(2)金刚石是由碳元素组成的,硬度最大的天然物质,由金刚石制成的钻石价格昂贵,故填:金刚石;
(3)氮气中空气的成份之一,化学性质稳定常作保护气,而且某些植物的根瘤菌可直接吸收氮气,故填:氮气;
(4)二氧化碳是无色无味的气体,是光合作用的原料之一,二氧化碳的固体干冰可进行人工降雨,故填:二氧化碳.
【点评】此题考查与日常生产、生活联系紧密的一些物质的性质和用途,化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一,注意用课本知识去解决并分析现实生活中的一些具体情况,加深对知识的理解.
20.化学与我们的生活密切相关,日常生活中的化学知识有很多.想想看,你知道生活中常用的以下物质分别含有什么化学成分?
①“干冰”常用于人工降雨,干冰中的“冰”是指 CO2 ;(填化学式)
②管道煤气中含有使人中毒的成分,该有毒气体是指 CO ;(填化学式)
③碘酒是生活中常用的皮肤消毒剂,碘酒中的“酒”是指 酒精 ;(填名称)
④天然气是常用的气体燃料,天然气中的“气”主要是指 CH4 ;(填化学式)
【考点】化学式的书写及意义;甲烷、乙醇等常见有机物的性质和用途.
【专题】物质的性质与用途;化学用语和质量守恒定律.
【分析】首先根据题意确定物质的化学名称,然后根据书写化学式的方法和步骤写出物质的化学式即可.
【解答】解:①“干冰”常用于人工降雨,干冰中的“冰”是指固态的二氧化碳,其化学式为:CO2.
②管道煤气中含有使人中毒的成分,该有毒气体是指一氧化碳,其化学式为:CO.
③碘酒是生活中常用的皮肤消毒剂,碘酒中的“酒”是指酒精.
④天然气是常用的气体燃料,天然气中的“气”主要是指甲烷,其化学式为:CH4.
故答案为:①CO2;
②CO;
③酒精;④CH4.
【点评】本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在.
21.图是从空气中分离氧气的示意图:请你写出从图中所获得的有关物质组成、结构、性质、变化等信息各一条:
组成: 空气是由氮气、氧气等组成的混合物
结构: 氮气是由氮气分子构成的
性质: 氮气的沸点比氧气低
变化: 分离液态空气制氧气是物理变化 .
【考点】微粒观点及模型图的应用;化学变化和物理变化的判别;化学性质与物理性质的差别及应用.
【专题】微观粒子模拟图型.
【分析】可以根据图中提供的信息和物质的组成、结构、性质、变化等方面进行分析、判断,从而得出正确的结论.
【解答】解:组成方面:空气是由氮气、氧气等组成的混合物.故填:空气是由氮气、氧气等组成的混合物.
结构方面:氮气是由氮气分子构成的.故填:氮气是由氮气分子构成的.
性质方面:氮气的沸点比氧气低.故填:氮气的沸点比氧气低.
变化方面:分离液态空气制氧气是物理变化.故填:分离液态空气制氧气是物理变化.
【点评】解答本题的关键是要掌握物质的组成、结构、性质、变化等方面的知识,只有这样才能对问题做出正确的判断.
22.如图是四种粒子的结构示意图:序号填空:
(1)电子层排布相同的是 BC ;
(2)属于同种元素的是 AB ;
(3)表示阳离子的是 C ;
(4)属于非金属元素原子的是 AD .
【考点】原子结构示意图与离子结构示意图.
【专题】化学用语和质量守恒定律.
【分析】(1)依据粒子结构示意图的信息分析解答;
(2)依据同种元素质子数相同分析解答即可;
(3)依据阳离子带正电荷,且质子数大于核外电子数分析解答;
(4)依据质子数判断元素种类以及类别;
【解答】解:(1)依据粒子结构示意图的信息分析可知:核外电子排布相同的是BC,都是10个电子;
(2)依据同种元素质子数相同可知:AB属于同种元素,其核内质子数都是8;
(3)依据阳离子带正电荷,且质子数大于核外电子数可知:C是钠离子属于阳离子,其它微粒均不是阳离子;
(4)依据质子数可判断元素种类:AB是氧元素,C是钠元素D是硫元素,所以属于非金属元素的是ABD,由于原子中质子数等于核外电子数,可知AD是非金属元素原子,B不是原子;
故答案为:(1)BC;(2)AB;(3)C;(4)AD;
【点评】本题难度不大,考查学生对粒子结构示意图及其意义的理解,了解粒子结构示意图的意义是正确解题的关键.
23.科学家发现,细胞膜中存在着某种只允许水分子出入的通道﹣﹣﹣﹣水通道.右图是2003年诺贝尔化学奖获得者彼得 阿格雷公布的世界上第一张水通道蛋白的示意图.
(1)如图水通道中的每个“”表示:① 水分子 ;
② 每个水分子由2个氢原子和1个氧原子构成 .
(2)根据示意图,由于水通道中间的正电荷对H+离子有 排斥 作用,所以,H+离子不能通过该水通道.
【考点】分子的定义与分子的特性.
【专题】微观粒子模拟图型;物质的微观构成与物质的宏观组成.
【分析】根据化学式的意义和构成氢离子的微观粒子及同种电荷互相排斥来解答.
【解答】解:(1)水通道的每个表示的微观意义为一个水分子和一个水分子由两个氢原子和一个氧原子构成;
(2)因为同种电荷互相排斥,H+离子带正电,所以水通道中间的正电荷对H+离子有排斥作用.
故答案为:(1)①水分子
②每个水分子由2个氢原子和1个氧原子构成
(2)排斥
【点评】会看懂图示,了解化学式的微观意义,知道是同种电荷相互排斥解此题的关键.
24.俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.表为元素周期表的部分示意图,表中数字为各元素原子的质子数,利用下表回答相关问题:
(1)用符号表示:带两个单位负电荷且质子数为8的离子 O2﹣ (写一种).AB2型化合物 MgCl2 、 CO2 (写两种).
(2)去年底重庆开县发生天然气“井喷”事件.喷出的气体中有一种有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸,请用符号和数字表示:3个A2B分子 3H2S .
(3)研究表中各元素原子的质子数,可发现元素从左向右的排列规律是 质子数依次增大 ,请预测质子数为20的元素在表中的位置 ② (填①、②、③).
(4)已知元素周期表中原子序数等于质子数.请从元素种类、质子数分析第二、第三周期的元素分布,有什么规律? 由左到右第二、三周期元素都是质子数依次递增;元素种类由金属元素到非金属元素到稀有气体元素过渡的相同的变化规律 .
【考点】元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
【专题】化学用语和质量守恒定律.
【分析】(1)根据质子数来确定元素,再利用“2﹣”标在元素符号的右上角来表示离子符号,利用AB2型化合物来分析A、B的化合价,确定元素的位置来分析解答;
(2)根据有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸可确定是氢硫酸,再利用元素符号及数字来表示3个分子;
(3)根据周期表判断原子的排列规律,然后利用原子序数及最外层电子数来预测元素在周期表中的位置,利用最外层电子数进一步判断离子的结构示意图;
(4)根据周期表判断元素的排列规律.
【解答】解:(1)因质子数为8单核原子为氧原子,则利用“2﹣”标在元素符号的右上角来表示氧离子符号,即带两个单位负电荷且质子数为8的离子为O2﹣,
由AB2型化合物,则A为+2价,B为﹣1价,则可以从周期表的第二列和倒数第二列来找合适的元素,如Mg与Cl可形成MgCl2,若A为+4价,B为﹣2价,则可以从周期表中的倒数第五列和倒数第三列来找合适的元素,如C与O可形成CO2,故答案为:O2﹣;MgCl2;CO2;
(2)由一种有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸,则该酸为氢硫酸,其化学式为H2S,化学式可表示1个分子,则在化学式的前面加数字“3”可表示3个分子,故答案为:3H2S;
(3)由周期表可知,在每一横行原子按照质子数由小到大的顺序来排列,即元素从左向右的排列规律是质子数依次增大,质子数为20的元素有4个电子层,最外层电子数为2,则在周期表中的第4个横行和第2个竖列的位置,即在②处,该原子变为离子时失去最外层2个电子而满足最外层8电子的稳定结构,即离子的结构中最外层电子数为8,则元素离子的结构示意图为甲图,故答案为:质子数依次增大,②;
(4)由左到右第二、三周期元素都是质子数依次递增;元素种类由金属元素到非金属元素到稀有气体元素过渡的相同的变化规律.
【点评】本题考查学生对元素周期表的认识和应用,将理论与元素、化合物知识结合在一起,难度较大,且考查的知识点较多,学生应熟悉原子的结构及常见物质的性质来解答.
五、实验与探究题
25.NaOH溶液可使无色酚酞变红.我们知道NaOH溶液中含有Na+离子、OH﹣离子、H2O分子,如要探究是哪种微粒使酚酞变红,请填写如表内容:
实验步骤
现象
分析推理过程
结论
(1)向盛有氯化钠溶液的试管中滴加几滴酚酞试液;(2)向盛有氢氧化钠溶液的试管中滴加几滴酚酞试液
(1)酚酞试液不变色;(2)酚酞试液变红色;
氯化钠溶液中含有钠离子、氯离子和水分子,由实验现象可知,钠离子和水分子不能使酚酞试液变色;氢氧化钠溶液中含有氢氧根离子,钠离子和水分子,由实验现象可知,氢氧根离子能使酚酞试液变色.
氢氧化钠溶液中能使酚酞试液变色的是氢氧根离子.
【考点】探究酸碱的主要性质;碱的化学性质.
【专题】科学探究.
【分析】氢氧化钠溶液中含有钠离子、氢氧根离子、水分子;氯化钠溶液中含有钠离子、氯离子、水分子;可以向氢氧化钠溶液和氯化钠溶液中分别滴加酚酞试液,如果氯化钠溶液能使酚酞试液变色,说明钠离子或水分子能使酚酞试液变色,如果氯化钠溶液不能使酚酞试液变色,说明钠离子或水分子不能使酚酞试液变色,则能使酚酞试液变色的离子是氢氧根离子.
【解答】解:因为氯化钠溶液中含有钠离子和水分子,如果氯化钠溶液能使酚酞试液变色,说明钠离子或水分子能使酚酞试液变色,如果氯化钠溶液不能使酚酞试液变色,说明钠离子或水分子不能使酚酞试液变色,则能使酚酞试液变色的离子是氢氧根离子.
实验步骤
实验现象
分析推理过程
结论
(1)向盛有氯化钠溶液的试管中滴加几滴酚酞试液;(2)向盛有氢氧化钠溶液的试管中滴加几滴酚酞试液;
(1)酚酞试液不变色;(2)酚酞试液变红色;
氯化钠溶液中含有钠离子、氯离子和水分子,由实验现象可知,钠离子和水分子不能使酚酞试液变色;氢氧化钠溶液中含有氢氧根离子,钠离子和水分子,由实验现象可知,氢氧根离子能使酚酞试液变色.
氢氧化钠溶液中能使酚酞试液变色的是氢氧根离子.
.
【点评】解答本题要掌握物质之间相互作用时的实验现象方面的知识,只有这样才能对相关方面的问题做出正确的判断.
六、计算题
26.自然界生命体的有机物组成除C、H、O外还有其他元素,如藻类物质(化学式可表示为C106H263O110N16P)的组成中就含有N和P.α﹣丙氨酸是组成人体蛋白质的氨基酸之一,其分子结构如图所示:
(1)写出α﹣丙氨酸的化学式.
(2)α﹣丙氨酸中氮元素的质量分数是多少?
【考点】元素的质量分数计算;化学式的书写及意义.
【专题】化学式的计算.
【分析】通过观察α﹣丙氨酸分子结构微观示意图可知:一个α﹣丙氨酸分子中各原子的个数,由此可以写出化学式,根据化学式就可以计算出α﹣丙氨酸中氮元素的质量分数.
【解答】解:(1)由微观示意图可知:每个α﹣丙氨酸分子有3个碳原子、7个氢原子、2个氧原子、1个氮原子构成,故α﹣丙氨酸的化学式:C3H7O2N
(2)α﹣丙氨酸中氮元素的质量分数为:×100%=15.73%.
故答为:(1)C3H7O2N,(2)α﹣丙氨酸中氮元素的质量分数是15.73%
【点评】本题主要考查学生认识物质微观粒子模型以及运用化学式和元素的质量分数公式进行计算的能力.
物质构成的奥秘》(1)
一、选择题(下列各题只有一个正确选项,每小题2分,共计20分)
1.小华用凉开水养鱼,不久鱼儿全死了.下列解释合理的是( )
A.凉开水中几乎不含氧元素
B.凉开水中几乎不含氧原子
C.凉开水中几乎不含水分子
D.凉开水中几乎不含氧气
2.下列符号只具有微观意义的是( )
A.H2
B.H2SO4
C.2H2O
D.C2H2
3.氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等领域.已知氮、硅的原子结构示意图依次为.请推测,氮化硅的化学式(分子式)为( )
A.Si3N4
B.Si4N3
C.Si3N7
D.Si7N3
4.下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )
A.它们结合其他原子的个数相同
B.它们的质子数不同
C.它们的最外层电子数相同
D.它们的核外电子数不同
5.我国在1993年成功制取了一种由相对原子质量为18、核电荷数为8的氧原子构成的双原子分子气体,下列说法正确的是( )
A.这种气体的相对分子质量是32
B.这种氧原子和氢原子构成的水分子,其相对分子质量为20
C.这种氧原子的核内质子数为10
D.这种氧原子的核外电子数为10
6.测得某溶液中仅含有Na+、Mg2+、SO42﹣、Cl﹣四种离子,其中离子个数比为Na+:Mg2+:Cl﹣=4:5:8,若设Na+为4n个,则SO42﹣的离子数为( )
A.2n
B.3n
C.6n
D.8n
7.如图,这四位同学描述的可能是下面的同一个化学符号( )
A.HClO
B.O3
C.NO2﹣
D.H2O
8.下列各组原子结构示意图中所表示的两种元素具有相似的化学性质的是( )
A.
B.
C.
D.
9.1880(质子数为8,相对原子质量为18)是一种与普通氧原子有相同的核内质子数的原子,它与普通氧原子的化学性质相同,在有机化学反应中被用作示踪原子.1880和普通氧原子属于( )
A.相同分子
B.相同原子
C.相同元素
D.相同单质
10.如图是表示物质分子的示意图,图中“●”和“○”分别表示两种含有不同质子数的原子,则图中表示单质的是( )
A.
B.
C.
D.
二、选择题(以下每小题可能有1~2个符合要求的答案.错选、多选不给分.有二个答案的,只选一个且正确,给2分.每题3分,共计15分)
11.科学家已研究出高能微粒N5+,则有关说法正确的是( )
A.N5+是由5个氮原子构成的单质
B.N5+中只有质子,没有中子和电子
C.每个N5+中含有35个质子和34个电子
D.N5+中含有35个质子和35个电子
12.十九世纪初,意大利科学家阿伏伽德罗在总结前人工作的基础上,提出了分子概念,认为:①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;④分子是保持物质化学性质的最小粒子;⑤分子的质量等于构成它的原子的质量之和;⑥分子在不停地运动.从你所学知识看,上述观点中存在明显不足的是( )
A.①③
B.①②⑤
C.④⑤⑥
D.③⑤
13.由碳、氧元素组成的气体中,碳与氧的质量比为3:5,则该气体可能是( )
A.由CO2
或CO单独组成的纯净物
B.由CO和CO2
共同组成的混合物
C.由CO和O2
共同组成的混合物
D.由O2和CO2
共同组成的混合物
14.核外电子数相同,核内质子数不同的两种粒子,它们可能是( )
A.一种元素的原子和另一种元素的离子
B.同种元素的原子和离子
C.两种不同元素的原子
D.两种不同元素的离子
15.由如图所示粒子结构示意图得出的结论中,错误的是( )
A.①、②分别与④、⑤反应均能形成与③电子层结构相同的粒子
B.上述粒子间能形成AB型、AB2型、A2B型化合物
C.上述粒子形成化合物前后,质子总数、电子总数均发生改变,而质量不变
D.上述粒子形成化合物前后,在化合物中均能显示可变化合价
三、简答题
16.古希腊著名学者亚里士多德曾提出过“四元素说”,认为火、空气、土、水是构成世界万物的基本元素,它们两两作用产生物质的基本性质﹣﹣热、冷、干、湿,如图所示.你认为“空气”和“水”是元素吗?为什么?
17.对“原子在化学反应中不可再分”这一句话,在学完了原子结构和核外电子排布知识后,你是怎样理解的?
四、填空题
18.用化学符号表示:3个氮原子______,+3价的铝元素______,n个水分子______,2个铁离子______,2个铵根离子______.
19.欢迎参加我们的化学俱乐部,请你写出符合与下列特征提示相关的物质名称
提示1
提示2
提示3
物质名称
物质1
液体
银白色
温度计
______
物质2
碳元素
很硬
昂贵
______
物质3
空气
植物根系
保护气
______
物质4
无色
光合作用
人工降雨
______
20.化学与我们的生活密切相关,日常生活中的化学知识有很多.想想看,你知道生活中常用的以下物质分别含有什么化学成分?
①“干冰”常用于人工降雨,干冰中的“冰”是指______;(填化学式)
②管道煤气中含有使人中毒的成分,该有毒气体是指______;(填化学式)
③碘酒是生活中常用的皮肤消毒剂,碘酒中的“酒”是指______;(填名称)
④天然气是常用的气体燃料,天然气中的“气”主要是指______;(填化学式)
21.图是从空气中分离氧气的示意图:请你写出从图中所获得的有关物质组成、结构、性质、变化等信息各一条:
组成:______
结构:______
性质:______
变化:______.
22.如图是四种粒子的结构示意图:序号填空:
(1)电子层排布相同的是______;
(2)属于同种元素的是______;
(3)表示阳离子的是______;
(4)属于非金属元素原子的是______.
23.科学家发现,细胞膜中存在着某种只允许水分子出入的通道﹣﹣﹣﹣水通道.右图是2003年诺贝尔化学奖获得者彼得 阿格雷公布的世界上第一张水通道蛋白的示意图.
(1)如图水通道中的每个“”表示:①______;
②______.
(2)根据示意图,由于水通道中间的正电荷对H+离子有______作用,所以,H+离子不能通过该水通道.
24.俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.表为元素周期表的部分示意图,表中数字为各元素原子的质子数,利用下表回答相关问题:
(1)用符号表示:带两个单位负电荷且质子数为8的离子______(写一种).AB2型化合物______、______(写两种).
(2)去年底重庆开县发生天然气“井喷”事件.喷出的气体中有一种有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸,请用符号和数字表示:3个A2B分子______.
(3)研究表中各元素原子的质子数,可发现元素从左向右的排列规律是______,请预测质子数为20的元素在表中的位置______(填①、②、③).
(4)已知元素周期表中原子序数等于质子数.请从元素种类、质子数分析第二、第三周期的元素分布,有什么规律?______.
五、实验与探究题
25.
NaOH溶液可使无色酚酞变红.我们知道NaOH溶液中含有Na+离子、OH﹣离子、H2O分子,如要探究是哪种微粒使酚酞变红,请填写如表内容:
实验步骤
现象
分析推理过程
结论
______
______
______
______
六、计算题
26.自然界生命体的有机物组成除C、H、O外还有其他元素,如藻类物质(化学式可表示为C106H263O110N16P)的组成中就含有N和P.α﹣丙氨酸是组成人体蛋白质的氨基酸之一,其分子结构如图所示:
(1)写出α﹣丙氨酸的化学式.
(2)α﹣丙氨酸中氮元素的质量分数是多少?
《第3单元
物质构成的奥秘》(1)
参考答案与试题解析
一、选择题(下列各题只有一个正确选项,每小题2分,共计20分)
1.小华用凉开水养鱼,不久鱼儿全死了.下列解释合理的是( )
A.凉开水中几乎不含氧元素
B.凉开水中几乎不含氧原子
C.凉开水中几乎不含水分子
D.凉开水中几乎不含氧气
【考点】氧气的物理性质;氧气的用途.
【分析】为什么凉开水不能养鱼,而一般的水则可以?通过比较凉开水与一般水的区别入手,从而认识到鱼儿是由于缺氧而死.
【解答】解:
A、说法错误,水是有氢氧两种元素组成的.
B、错误,水中含有许多水分子,每个水分子里都有氧原子.
C、凉开水也是水,也是由水分子构成的.
D、凉开水经过沸腾,水中不含有氧气,导致金鱼缺氧.
【点评】温度升高,气体在水中的溶解度下降,水中的氧气就逐渐减少.压强减小,气体在水中的溶解度也减少.
2.下列符号只具有微观意义的是( )
A.H2
B.H2SO4
C.2H2O
D.C2H2
【考点】化学符号及其周围数字的意义.
【分析】化学式具有两方面的意义,一方面表示宏观意义,而另一方面表示微观意义.而在化学式的前面加上相应的数字,它只表示微观意义.
【解答】解:化学式即表示宏观意义,也可表示微观意义.即可表示这种物质,也可表示这种物质的一个分子.所以ABD具有两方面的意义.而在化学式的前面加数字,如C只表示2个水分子.只表示微观意义.
故选C
【点评】初中所接触到的化学式、离子符号、元素符号等都具有两方面的意义,即可表宏观,又可表微观.而在这些符号的前面加相应的数字只表示微观.
3.氮化硅是一种新型陶瓷材料的主要成分,能承受高温,可用于制造业、航天业等领域.已知氮、硅的原子结构示意图依次为.请推测,氮化硅的化学式(分子式)为( )
A.Si3N4
B.Si4N3
C.Si3N7
D.Si7N3
【考点】有关化学式的计算和推断;核外电子在化学反应中的作用;化合价规律和原则.
【专题】结合课本知识的信息.
【分析】根据氮、硅的原子结构示意图,分析得出元素的化合价,然后利用化合价来书写化学式.
【解答】解:由氮原子的结构示意图,可以看出最外层电子数为5,容易得到3个电子,则N元素的化合价为﹣3价;由硅原子的结构示意图,可以看出最外层电子数为4,一般不容易失去也不容易得到电子,但可以与其它元素以共用电子对形成化合物,则元素的化合价为+4价,则,化合价不能约分可直接交叉,使化合物中正负化合价的代数和为0,得化学式为Si3N4,
故选A.
【点评】本题考查学生利用化合价来书写物质的化学式,学生应能根据原子结构得出元素在形成化合物时的化合价,然后可利用化合价和化合价的原则来书写化学式.
4.下列关于Fe、Fe2+、Fe3+的说法中,正确的是( )
A.它们结合其他原子的个数相同
B.它们的质子数不同
C.它们的最外层电子数相同
D.它们的核外电子数不同
【考点】原子和离子的相互转化.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据Fe、Fe2+、Fe3+三种粒子可以看出:它们都是铁元素形成的不同微粒,则它们的质子数相同,它们的电子数不同,化学性质不同.
【解答】解:A、因Fe、Fe2+、Fe3+三种粒子的核外电子数不同,最外层电子数也不同,所以化学性质不同,它们结合其他原子的个数不相同.故A说法不正确;
B、它们是同种元素形成的微粒,核电荷数相同,则质子数相同.故B说法不正确;
C、因金属原子失去电子变为金属阳离子,且Fe2+、Fe3+带电荷不同,则原子变为离子失去的电子数不同,则三种粒子的核外电子数不同,最外层电子数不同,故C说法不正确;
D、由以上分析可知,它们的核外电子数不同,故D说法正确.
故选D.
【点评】本题考查原子和离子的相互转化,学生应注意单原子形成的微粒中质子数与电子数的关系,抓住质子数是判断元素的关键.
5.我国在1993年成功制取了一种由相对原子质量为18、核电荷数为8的氧原子构成的双原子分子气体,下列说法正确的是( )
A.这种气体的相对分子质量是32
B.这种氧原子和氢原子构成的水分子,其相对分子质量为20
C.这种氧原子的核内质子数为10
D.这种氧原子的核外电子数为10
【考点】相对分子质量的概念及其计算;原子的有关数量计算.
【专题】化学式的计算.
【分析】根据相对分子质量为构成分子的各原子的相对原子质量之和,原子中:核电荷数=核内质子数=核外电子数,结合题意进行分析解答.
【解答】解:由题意,我国在1993年成功制取了一种由相对原子质量为18、核电荷数为8的氧原子构成的双原子分子气体.
A、这种气体的相对分子质量是18×2=36,故选项说法错误.
B、这种氧原子和氢原子构成的水分子,其相对分子质量为1×2+18=20,故选项说法正确.
C、原子中:核电荷数=核内质子数,这种氧原子的核电荷数为8,其核内质子数为8,故选项说法错误.
D、原子中:核电荷数=核内质子数=核外电子数,这种氧原子的核电荷数为8,其核外电子数为8,故选项说法错误.
故选B.
【点评】本题难度不大,解题的关键是掌握并灵活运用化学式的有关计算、原子中核电荷数=核内质子数=核外电子数.
6.测得某溶液中仅含有Na+、Mg2+、SO42﹣、Cl﹣四种离子,其中离子个数比为Na+:Mg2+:Cl﹣=4:5:8,若设Na+为4n个,则SO42﹣的离子数为( )
A.2n
B.3n
C.6n
D.8n
【考点】有关元素化合价的计算.
【专题】化学式的计算.
【分析】由溶液中离子个数比为Na+:Mg2+:Cl﹣=4:5:8,若Na+为4n个,则Mg2+与Cl﹣个数分别为5n与8n个;根据溶液中阴阳离子所带电荷总数相等,计算溶液中SO42﹣的离子数.
【解答】解:由于溶液中离子个数比为Na+:Mg2+:Cl﹣=4:5:8,若Na+为4n个,则Mg2+与Cl﹣个数分别为5n与8n个;
根据溶液中阴阳离子所带电荷总数相等,由溶液中SO42﹣的离子数==3n
故选B.
【点评】溶液中虽然含有带正电的阳离子和带负电的阴离子,但阴阳离子所带电荷总数相等、电性相反,因此整个溶液不现电性.
7.如图,这四位同学描述的可能是下面的同一个化学符号( )
A.HClO
B.O3
C.NO2﹣
D.H2O
【考点】化学符号及其周围数字的意义;化学式的书写及意义.
【专题】物质的微观构成与物质的宏观组成;化学用语和质量守恒定律.
【分析】化学式可以表示一种物质,该物质的元素组成,该物质的分子构成,该分子的原子构成.
【解答】解:A、HClO中含有氢、氯、氧三种元素,不符合第三位同学的描述,因此排除选项A.
B、O3中只含氧元素,不符合第三位同学的描述,因此排除选项B.
C、NO2﹣表示一种离子,不能表示物质,不符合第一位同学的描述,因此排除选项C.
D、只有H2O能表示水这种物质,能表示1个水分子,能表示水由氢、氧两种元素组成,还能表示1个水分子中含有1个氧原子和2个氢原子共3个原子.因此选项D正确.
故选D.
【点评】本题主要考查化学式的含义,解答时要注意理解宏观组成和微观构成的区别.
8.下列各组原子结构示意图中所表示的两种元素具有相似的化学性质的是( )
A.
B.
C.
D.
【考点】原子结构示意图与离子结构示意图;核外电子在化学反应中的作用.
【专题】微观粒子模拟图型.
【分析】元素的化学性质取决于该元素原子的最外层电子数,最外层电子数小于4,易失电子;最外层电子数大于4,易得电子;最外层电子数为8(He除外),性质稳定.
【解答】解:A、质子数为2的原子为He原子,质子数为18的原子为Ar原子,二者都是稀有气体元素,化学性质都表现为稳定;
B、质子数为9的原子最外层有7个电子,不稳定,易得1个电子而形成稳定结构;质子数为11的原子最外层有1个电子,不稳定,易失去最外层的1个电子而形成稳定结构;化学性质迥然不同;
C、虽然两种元素的原子的最外层电子数相同,但它们的化学性质却完全不同.质子数为2的He为稀有气体元素,化学性质稳定;而质子数为12的原子最外层电子数为2,不稳定,易失最外层的2个电子形成稳定结构;
D、质子数为10的原子,最外层电子达8电子稳定结构,性质稳定;质子数为8的原子最外层电子数为6,不稳定,易得2个电子形成稳定结构.两种元素化学性质无相似处.
故选:A.
【点评】最外层电子数为8称为稳定结构(He除外),具有这种结构的粒子化学性质稳定.
9.1880(质子数为8,相对原子质量为18)是一种与普通氧原子有相同的核内质子数的原子,它与普通氧原子的化学性质相同,在有机化学反应中被用作示踪原子.1880和普通氧原子属于( )
A.相同分子
B.相同原子
C.相同元素
D.相同单质
【考点】元素的概念.
【专题】压轴实验题;物质的微观构成与物质的宏观组成.
【分析】根据元素的含义可知质子数决定元素种类进行解答.
【解答】解:质子数决定元素种类,1880的质子数为8,普通氧原子的质子数也为8,所以为同种元素的不同原子.
故选:C.
【点评】同种元素的原子,其中子数可能不同,但不影响它的化学性质.
10.如图是表示物质分子的示意图,图中“●”和“○”分别表示两种含有不同质子数的原子,则图中表示单质的是( )
A.
B.
C.
D.
【考点】单质和化合物的判别.
【专题】物质的分类.
【分析】同种原子构成的分子为单质分子,不同种原子构成的分子为化合物分子;同种物质的分子构成纯净物,不同物质的分子构成的混合物,确定为纯净物后,再判断分子是否为同种原子构成,据此回答问题即可;
【解答】解:A、图中两个分子构成相同,为同种物质的分子,该图所表示物质为纯净物;并且该分子由两种不同的原子构成,为化合物的分子;
B、图中四个分子构成不同,为两种不同物质的分子,是两种不同物质的单质,该图所示物质为混合物;
C、图中两个分子构成相同,为同种物质的分子,且该分子由同种原子构成,所以该图示表示的是单质;
D、图所示物质为化合物;图中两个分子构成相同,为同种物质的分子,该图所表示物质为纯净物;并且该分子由两种不同和原子构成,为化合物的分子;图所示物质为化合物.
故选C.
【点评】分子同原子构成,构成相同的分子为同种物质的分子,同种物质的分子构成的物质为纯净物;不同种原子构成的分子为化合物分子,同种原子构成的分子为单质分子.
二、选择题(以下每小题可能有1~2个符合要求的答案.错选、多选不给分.有二个答案的,只选一个且正确,给2分.每题3分,共计15分)
11.科学家已研究出高能微粒N5+,则有关说法正确的是( )
A.N5+是由5个氮原子构成的单质
B.N5+中只有质子,没有中子和电子
C.每个N5+中含有35个质子和34个电子
D.N5+中含有35个质子和35个电子
【考点】原子的定义与构成;原子和离子的相互转化.
【专题】结合课本知识的信息;压轴实验题.
【分析】先从N5+的表示方法得到它是一个带有一个单位正电荷的离子,再根据氮原子核内有7个质子和离子带电的原理分析出N5+中的质子数和电子数,从而判断正确答案.
【解答】解:从N5+的表示方法可看出它是一个带有一个单位正电荷的离子,其中每个氮原子核内有7个质子,当原子的核内质子数和电子数相等时,原子不显电性,而N5+带有一个单位的正电荷,所以N5+中含有35个质子和34个电子.所以只有选项C正确.
故选:C.
【点评】主要考查了原子的构成和原子和离子之间的相互转化.离子是由于质子和电子的数目相等而不带电.
12.十九世纪初,意大利科学家阿伏伽德罗在总结前人工作的基础上,提出了分子概念,认为:①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;④分子是保持物质化学性质的最小粒子;⑤分子的质量等于构成它的原子的质量之和;⑥分子在不停地运动.从你所学知识看,上述观点中存在明显不足的是( )
A.①③
B.①②⑤
C.④⑤⑥
D.③⑤
【考点】分子、原子、离子、元素与物质之间的关系;分子和原子的区别和联系.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据所学的分子和原子的性质进行分析,分子是保持物质化学性质的微粒;原子是化学变化中最小的微粒;带电的原子或原子团称为离子.
【解答】解:构成物质的微粒有分子、原子和离子,故①不正确;分子是由原子构成的,故②正确;金属和稀有气体都是由原子直接构成的,故原子可以独立存在,故③不正确;分子是保持物质化学性质的最小粒子,故④正确;分子的质量等于构成它的原子的质量之和,故⑤正确;分子是不停的运动着的,故⑥正确;故存在明显不足的是①③.
故选A.
【点评】由分子构成的物质其化学性质由分子保持,由原子构成的物质其化学性质由原子保持.
13.由碳、氧元素组成的气体中,碳与氧的质量比为3:5,则该气体可能是( )
A.由CO2
或CO单独组成的纯净物
B.由CO和CO2
共同组成的混合物
C.由CO和O2
共同组成的混合物
D.由O2和CO2
共同组成的混合物
【考点】有关化学式的计算和推断;元素质量比的计算.
【专题】化学式的计算.
【分析】根据物质的化学式,可以计算组成元素的质量比,根据组成元素的质量比可以判断气体的组成情况.
【解答】解:二氧化碳、一氧化碳中碳元素和氧元素质量比分别是:12:32=3:8,12:16=3:4,
A、由CO2
或CO单独组成的纯净物中碳元素和氧元素质量比是3:8,或3:4,该选项不正确;
B、由CO和CO2
共同组成的混合物中碳与氧的质量比可能为3:5,该选项正确;
C、由CO和O2
共同组成的混合物中,由于一氧化碳中碳元素和氧元素质量比是3:4,因此碳与氧的质量比可能为3:5,该选项正确;
D、由O2和CO2
共同组成的混合物中,由于二氧化碳中碳元素和氧元素的质量比是3:8,因此混合物中碳元素和氧元素质量比小于3:8,该选项不正确.
故选:BC.
【点评】本题主要考查根据物质的化学式计算组成元素的元素质量比方面的问题,计算时要注意准确性.
14.核外电子数相同,核内质子数不同的两种粒子,它们可能是( )
A.一种元素的原子和另一种元素的离子
B.同种元素的原子和离子
C.两种不同元素的原子
D.两种不同元素的离子
【考点】原子和离子的相互转化;元素的概念.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据不同种元素最本质的区别是质子数不同,可推断:不同质子数,说明肯定不是同种元素的粒子;相同电子数即“核外电子数相同”,说明它们核外电子结构相同,而它们的质子数不同,说明肯定不是两种不同元素的原子的两种粒子;据此即可判定正确的选项.
【解答】解:A、一种元素的原子和另一种元素的离子,符合不同质子数、相同电子数的两种粒子,故A正确;
B、同一元素,质子数就一定相同,故B错误;
C、不同元素的原子,电子数肯定不同,故C错误;
D、不同元素的离子,如Na+
和
Mg2+,都是离子,而且质子数不同,而电子数相同,故D正确.
故选AD.
【点评】解答本题必须理解不同质子数、相同电子数的含义,才能正确解答.
15.由如图所示粒子结构示意图得出的结论中,错误的是( )
A.①、②分别与④、⑤反应均能形成与③电子层结构相同的粒子
B.上述粒子间能形成AB型、AB2型、A2B型化合物
C.上述粒子形成化合物前后,质子总数、电子总数均发生改变,而质量不变
D.上述粒子形成化合物前后,在化合物中均能显示可变化合价
【考点】原子结构示意图与离子结构示意图.
【专题】化学用语和质量守恒定律.
【分析】由粒子结构示意图可知:粒子①核内8个质子,最外层6个电子,易得2个电子;粒子②核内9个质子,最外层7个电子,易得1个电子;粒子③核内10个质子,核外电子结构为2、8结构;粒子④核内11个质子,最外层1个电子,易失去该层上的1个电子;粒子⑤核内12个质子,最外层2个电子,易失去该层上的2个电子;
根据五种粒子的结构示意图所反映的粒子构成,利用元素化学性质决定于最外层电子数等对选项中的结论进行评价.
【解答】解:A、由粒子①、②、④、⑤的最外层电子数可知,在反应中,粒子①易得2个电子、粒子②易得1个电子、粒子④易失去该层上的1个电子、粒子⑤易失去该层上的2个电子而形成与粒子③核外电子结构为2、8结构相同的粒子;故A正确;
B、根据在反应中,粒子①易得2个电子、粒子②易得1个电子、粒子④易失去该层上的1个电子、粒子⑤易失去该层上的2个电子,利用化合物中得失电子总数相等,粒子①与粒子⑤、粒子②与粒子④可形成AB型化合物;粒子⑤与粒子②可结合成AB2型化合物;粒子④与粒子①可结合成A2B型化合物;故B正确;
C、由于化学反应中原子的种类以及个数不会变化,只是发生了电子的转移,所以上述粒子形成化合物前后,质子总数、电子总数均不发生改变,故C不正确;
D、依据对①﹣⑤原子所表示的元素情况可知:在含有F、Na、Mg元素的化合物中一般存在固定化合价,Ne化学性质相对稳定一般很难形成化合物,而氧元素可能存在可变的化合价;故D不正确;
故选CD.
【点评】质子数等于核外电子数的粒子结构图为原子的结构示意图,在原子结构示意图中,最外层电子层数大于4,易得电子;最外层电子数小于4,易失去最外层上的电子.
三、简答题
16.古希腊著名学者亚里士多德曾提出过“四元素说”,认为火、空气、土、水是构成世界万物的基本元素,它们两两作用产生物质的基本性质﹣﹣热、冷、干、湿,如图所示.你认为“空气”和“水”是元素吗?为什么?
【考点】元素的概念.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称进行分析解答本题.
【解答】解:元素是具有相同核电荷数(即核内质子数)的一类原子的总称,而“空气”“水”分别是由不同种元素组成的物质.
故答案为:不是;元素是具有相同核电荷数同一类原子的总称,而“空气”、“水”是由不同种元素组成的物质.
【点评】本题考查学生根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称进行分析解题的能力
17.对“原子在化学反应中不可再分”这一句话,在学完了原子结构和核外电子排布知识后,你是怎样理解的?
【考点】原子的定义与构成.
【专题】物质的微观构成与物质的宏观组成.
【分析】根据已有的原子的构成的知识进行分析解答即可.
【解答】解:原子可以分为原子核和核外电子,原子在化学变化中原子核不发生改变,所以原子种类就不发生改变,而核外电子可以得失,故答案为:原子在化学变化中原子核不发生改变,所以原子种类就不发生改变,而核外电子可以得失.
【点评】本题考查的是原子结构的知识,完成此题,可以依据已有的知识进行.
四、填空题
18.用化学符号表示:3个氮原子 3N ,+3价的铝元素 ,n个水分子 nH2O ,2个铁离子 2Fe3+ ,2个铵根离子 2NH4+ .
【考点】化学符号及其周围数字的意义.
【专题】化学用语和质量守恒定律.
【分析】原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.
化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后.
分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字.
离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
【解答】解:由原子的表示方法:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,则3个氮原子可表示为:3N.
由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故+3价的铝元素可表示为:.
由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则n个水分子可表示为:nH2O.
由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.2个铁离子、2个铵根离子分别可表示为2Fe3+、2NH4+.
故答案为:3N;;nH2O;2Fe3+;2NH4+.
【点评】本题难度不大,掌握常见化学用语(原子符号、分子符号、化合价、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.
19.欢迎参加我们的化学俱乐部,请你写出符合与下列特征提示相关的物质名称
提示1
提示2
提示3
物质名称
物质1
液体
银白色
温度计
水银
物质2
碳元素
很硬
昂贵
金刚石
物质3
空气
植物根系
保护气
氮气
物质4
无色
光合作用
人工降雨
二氧化碳
【考点】金属的物理性质及用途;常见气体的用途;二氧化碳的用途;碳单质的物理性质及用途.
【专题】物质的性质与用途.
【分析】(1)根据水银的物理性质和用途进行分析判断;
(2)根据金刚石的物理性质和用途进行分析判断;
(3)根据氮气的物理性质和用途进行分析判断;
(4)根据二氧化碳性质和用途进行分析判断.
【解答】解:(1)温度计中填充的银白色的液体是水银,故填:水银;
(2)金刚石是由碳元素组成的,硬度最大的天然物质,由金刚石制成的钻石价格昂贵,故填:金刚石;
(3)氮气中空气的成份之一,化学性质稳定常作保护气,而且某些植物的根瘤菌可直接吸收氮气,故填:氮气;
(4)二氧化碳是无色无味的气体,是光合作用的原料之一,二氧化碳的固体干冰可进行人工降雨,故填:二氧化碳.
【点评】此题考查与日常生产、生活联系紧密的一些物质的性质和用途,化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一,注意用课本知识去解决并分析现实生活中的一些具体情况,加深对知识的理解.
20.化学与我们的生活密切相关,日常生活中的化学知识有很多.想想看,你知道生活中常用的以下物质分别含有什么化学成分?
①“干冰”常用于人工降雨,干冰中的“冰”是指 CO2 ;(填化学式)
②管道煤气中含有使人中毒的成分,该有毒气体是指 CO ;(填化学式)
③碘酒是生活中常用的皮肤消毒剂,碘酒中的“酒”是指 酒精 ;(填名称)
④天然气是常用的气体燃料,天然气中的“气”主要是指 CH4 ;(填化学式)
【考点】化学式的书写及意义;甲烷、乙醇等常见有机物的性质和用途.
【专题】物质的性质与用途;化学用语和质量守恒定律.
【分析】首先根据题意确定物质的化学名称,然后根据书写化学式的方法和步骤写出物质的化学式即可.
【解答】解:①“干冰”常用于人工降雨,干冰中的“冰”是指固态的二氧化碳,其化学式为:CO2.
②管道煤气中含有使人中毒的成分,该有毒气体是指一氧化碳,其化学式为:CO.
③碘酒是生活中常用的皮肤消毒剂,碘酒中的“酒”是指酒精.
④天然气是常用的气体燃料,天然气中的“气”主要是指甲烷,其化学式为:CH4.
故答案为:①CO2;
②CO;
③酒精;④CH4.
【点评】本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在.
21.图是从空气中分离氧气的示意图:请你写出从图中所获得的有关物质组成、结构、性质、变化等信息各一条:
组成: 空气是由氮气、氧气等组成的混合物
结构: 氮气是由氮气分子构成的
性质: 氮气的沸点比氧气低
变化: 分离液态空气制氧气是物理变化 .
【考点】微粒观点及模型图的应用;化学变化和物理变化的判别;化学性质与物理性质的差别及应用.
【专题】微观粒子模拟图型.
【分析】可以根据图中提供的信息和物质的组成、结构、性质、变化等方面进行分析、判断,从而得出正确的结论.
【解答】解:组成方面:空气是由氮气、氧气等组成的混合物.故填:空气是由氮气、氧气等组成的混合物.
结构方面:氮气是由氮气分子构成的.故填:氮气是由氮气分子构成的.
性质方面:氮气的沸点比氧气低.故填:氮气的沸点比氧气低.
变化方面:分离液态空气制氧气是物理变化.故填:分离液态空气制氧气是物理变化.
【点评】解答本题的关键是要掌握物质的组成、结构、性质、变化等方面的知识,只有这样才能对问题做出正确的判断.
22.如图是四种粒子的结构示意图:序号填空:
(1)电子层排布相同的是 BC ;
(2)属于同种元素的是 AB ;
(3)表示阳离子的是 C ;
(4)属于非金属元素原子的是 AD .
【考点】原子结构示意图与离子结构示意图.
【专题】化学用语和质量守恒定律.
【分析】(1)依据粒子结构示意图的信息分析解答;
(2)依据同种元素质子数相同分析解答即可;
(3)依据阳离子带正电荷,且质子数大于核外电子数分析解答;
(4)依据质子数判断元素种类以及类别;
【解答】解:(1)依据粒子结构示意图的信息分析可知:核外电子排布相同的是BC,都是10个电子;
(2)依据同种元素质子数相同可知:AB属于同种元素,其核内质子数都是8;
(3)依据阳离子带正电荷,且质子数大于核外电子数可知:C是钠离子属于阳离子,其它微粒均不是阳离子;
(4)依据质子数可判断元素种类:AB是氧元素,C是钠元素D是硫元素,所以属于非金属元素的是ABD,由于原子中质子数等于核外电子数,可知AD是非金属元素原子,B不是原子;
故答案为:(1)BC;(2)AB;(3)C;(4)AD;
【点评】本题难度不大,考查学生对粒子结构示意图及其意义的理解,了解粒子结构示意图的意义是正确解题的关键.
23.科学家发现,细胞膜中存在着某种只允许水分子出入的通道﹣﹣﹣﹣水通道.右图是2003年诺贝尔化学奖获得者彼得 阿格雷公布的世界上第一张水通道蛋白的示意图.
(1)如图水通道中的每个“”表示:① 水分子 ;
② 每个水分子由2个氢原子和1个氧原子构成 .
(2)根据示意图,由于水通道中间的正电荷对H+离子有 排斥 作用,所以,H+离子不能通过该水通道.
【考点】分子的定义与分子的特性.
【专题】微观粒子模拟图型;物质的微观构成与物质的宏观组成.
【分析】根据化学式的意义和构成氢离子的微观粒子及同种电荷互相排斥来解答.
【解答】解:(1)水通道的每个表示的微观意义为一个水分子和一个水分子由两个氢原子和一个氧原子构成;
(2)因为同种电荷互相排斥,H+离子带正电,所以水通道中间的正电荷对H+离子有排斥作用.
故答案为:(1)①水分子
②每个水分子由2个氢原子和1个氧原子构成
(2)排斥
【点评】会看懂图示,了解化学式的微观意义,知道是同种电荷相互排斥解此题的关键.
24.俄国化学家门捷列夫在总结前人经验的基础上,通过艰辛的努力,终于提出了现代元素周期表的雏形.表为元素周期表的部分示意图,表中数字为各元素原子的质子数,利用下表回答相关问题:
(1)用符号表示:带两个单位负电荷且质子数为8的离子 O2﹣ (写一种).AB2型化合物 MgCl2 、 CO2 (写两种).
(2)去年底重庆开县发生天然气“井喷”事件.喷出的气体中有一种有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸,请用符号和数字表示:3个A2B分子 3H2S .
(3)研究表中各元素原子的质子数,可发现元素从左向右的排列规律是 质子数依次增大 ,请预测质子数为20的元素在表中的位置 ② (填①、②、③).
(4)已知元素周期表中原子序数等于质子数.请从元素种类、质子数分析第二、第三周期的元素分布,有什么规律? 由左到右第二、三周期元素都是质子数依次递增;元素种类由金属元素到非金属元素到稀有气体元素过渡的相同的变化规律 .
【考点】元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
【专题】化学用语和质量守恒定律.
【分析】(1)根据质子数来确定元素,再利用“2﹣”标在元素符号的右上角来表示离子符号,利用AB2型化合物来分析A、B的化合价,确定元素的位置来分析解答;
(2)根据有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸可确定是氢硫酸,再利用元素符号及数字来表示3个分子;
(3)根据周期表判断原子的排列规律,然后利用原子序数及最外层电子数来预测元素在周期表中的位置,利用最外层电子数进一步判断离子的结构示意图;
(4)根据周期表判断元素的排列规律.
【解答】解:(1)因质子数为8单核原子为氧原子,则利用“2﹣”标在元素符号的右上角来表示氧离子符号,即带两个单位负电荷且质子数为8的离子为O2﹣,
由AB2型化合物,则A为+2价,B为﹣1价,则可以从周期表的第二列和倒数第二列来找合适的元素,如Mg与Cl可形成MgCl2,若A为+4价,B为﹣2价,则可以从周期表中的倒数第五列和倒数第三列来找合适的元素,如C与O可形成CO2,故答案为:O2﹣;MgCl2;CO2;
(2)由一种有毒的含有18个质子的A2B型气体,其水溶液是一种无氧酸,则该酸为氢硫酸,其化学式为H2S,化学式可表示1个分子,则在化学式的前面加数字“3”可表示3个分子,故答案为:3H2S;
(3)由周期表可知,在每一横行原子按照质子数由小到大的顺序来排列,即元素从左向右的排列规律是质子数依次增大,质子数为20的元素有4个电子层,最外层电子数为2,则在周期表中的第4个横行和第2个竖列的位置,即在②处,该原子变为离子时失去最外层2个电子而满足最外层8电子的稳定结构,即离子的结构中最外层电子数为8,则元素离子的结构示意图为甲图,故答案为:质子数依次增大,②;
(4)由左到右第二、三周期元素都是质子数依次递增;元素种类由金属元素到非金属元素到稀有气体元素过渡的相同的变化规律.
【点评】本题考查学生对元素周期表的认识和应用,将理论与元素、化合物知识结合在一起,难度较大,且考查的知识点较多,学生应熟悉原子的结构及常见物质的性质来解答.
五、实验与探究题
25.NaOH溶液可使无色酚酞变红.我们知道NaOH溶液中含有Na+离子、OH﹣离子、H2O分子,如要探究是哪种微粒使酚酞变红,请填写如表内容:
实验步骤
现象
分析推理过程
结论
(1)向盛有氯化钠溶液的试管中滴加几滴酚酞试液;(2)向盛有氢氧化钠溶液的试管中滴加几滴酚酞试液
(1)酚酞试液不变色;(2)酚酞试液变红色;
氯化钠溶液中含有钠离子、氯离子和水分子,由实验现象可知,钠离子和水分子不能使酚酞试液变色;氢氧化钠溶液中含有氢氧根离子,钠离子和水分子,由实验现象可知,氢氧根离子能使酚酞试液变色.
氢氧化钠溶液中能使酚酞试液变色的是氢氧根离子.
【考点】探究酸碱的主要性质;碱的化学性质.
【专题】科学探究.
【分析】氢氧化钠溶液中含有钠离子、氢氧根离子、水分子;氯化钠溶液中含有钠离子、氯离子、水分子;可以向氢氧化钠溶液和氯化钠溶液中分别滴加酚酞试液,如果氯化钠溶液能使酚酞试液变色,说明钠离子或水分子能使酚酞试液变色,如果氯化钠溶液不能使酚酞试液变色,说明钠离子或水分子不能使酚酞试液变色,则能使酚酞试液变色的离子是氢氧根离子.
【解答】解:因为氯化钠溶液中含有钠离子和水分子,如果氯化钠溶液能使酚酞试液变色,说明钠离子或水分子能使酚酞试液变色,如果氯化钠溶液不能使酚酞试液变色,说明钠离子或水分子不能使酚酞试液变色,则能使酚酞试液变色的离子是氢氧根离子.
实验步骤
实验现象
分析推理过程
结论
(1)向盛有氯化钠溶液的试管中滴加几滴酚酞试液;(2)向盛有氢氧化钠溶液的试管中滴加几滴酚酞试液;
(1)酚酞试液不变色;(2)酚酞试液变红色;
氯化钠溶液中含有钠离子、氯离子和水分子,由实验现象可知,钠离子和水分子不能使酚酞试液变色;氢氧化钠溶液中含有氢氧根离子,钠离子和水分子,由实验现象可知,氢氧根离子能使酚酞试液变色.
氢氧化钠溶液中能使酚酞试液变色的是氢氧根离子.
.
【点评】解答本题要掌握物质之间相互作用时的实验现象方面的知识,只有这样才能对相关方面的问题做出正确的判断.
六、计算题
26.自然界生命体的有机物组成除C、H、O外还有其他元素,如藻类物质(化学式可表示为C106H263O110N16P)的组成中就含有N和P.α﹣丙氨酸是组成人体蛋白质的氨基酸之一,其分子结构如图所示:
(1)写出α﹣丙氨酸的化学式.
(2)α﹣丙氨酸中氮元素的质量分数是多少?
【考点】元素的质量分数计算;化学式的书写及意义.
【专题】化学式的计算.
【分析】通过观察α﹣丙氨酸分子结构微观示意图可知:一个α﹣丙氨酸分子中各原子的个数,由此可以写出化学式,根据化学式就可以计算出α﹣丙氨酸中氮元素的质量分数.
【解答】解:(1)由微观示意图可知:每个α﹣丙氨酸分子有3个碳原子、7个氢原子、2个氧原子、1个氮原子构成,故α﹣丙氨酸的化学式:C3H7O2N
(2)α﹣丙氨酸中氮元素的质量分数为:×100%=15.73%.
故答为:(1)C3H7O2N,(2)α﹣丙氨酸中氮元素的质量分数是15.73%
【点评】本题主要考查学生认识物质微观粒子模型以及运用化学式和元素的质量分数公式进行计算的能力.
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
