新疆奎屯市第一高级中学人教版高一化学必修二课件:第二章化学反应与能量 (共21张PPT)
文档属性
| 名称 | 新疆奎屯市第一高级中学人教版高一化学必修二课件:第二章化学反应与能量 (共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-02 12:59:51 | ||
图片预览





文档简介
课件21张PPT。
第二章 化学能与热能1、了解化学反应的实质
2、学会分析物质自身能量与吸热放热的关系
3、能够掌握吸热反应与放热反应的判断方法
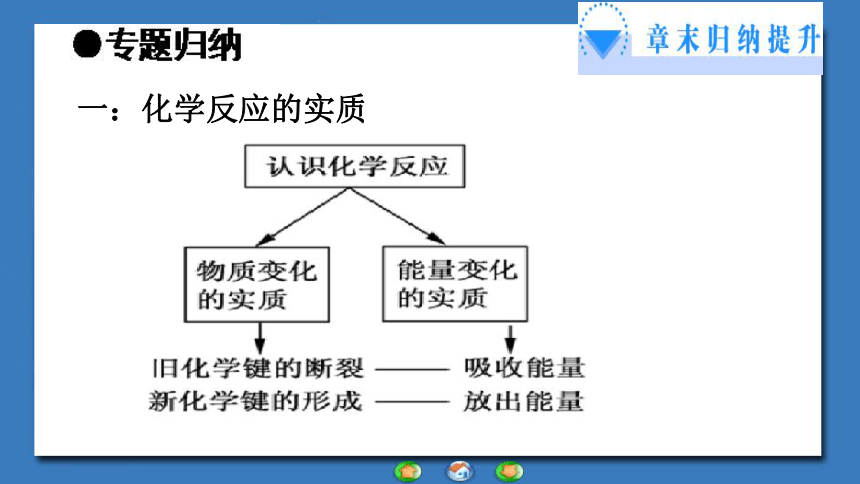
学习目标一:化学反应的实质放热(1)化学键的 和 是化学反应中能量变化的主要原因。(3)化学反应的实质用化学键理论可表述为旧化学键的 和新化学键的 。【归纳小结】断裂形成断裂形成(2)断键吸热成键放热二:物质自身能量与吸热放热的关系①反应物总能量>生成物总能量 反应放出能量
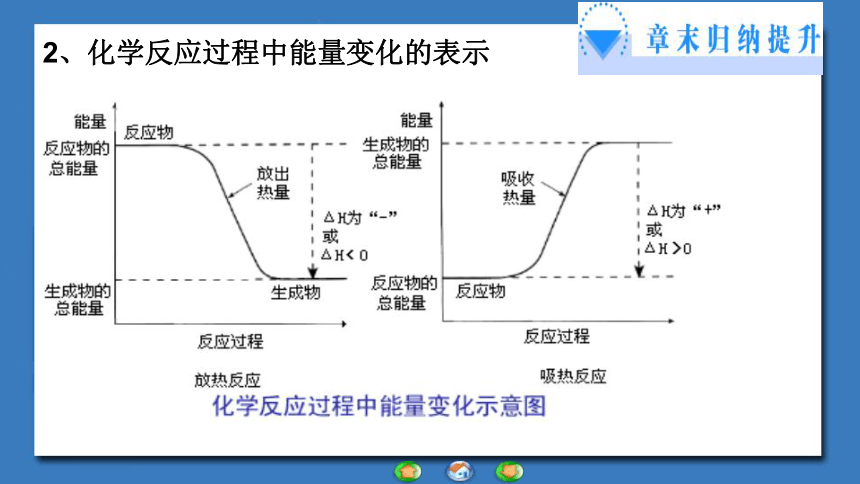
②反应物总能量<生成物总能量 反应吸收能量2、化学反应过程中能量变化的表示
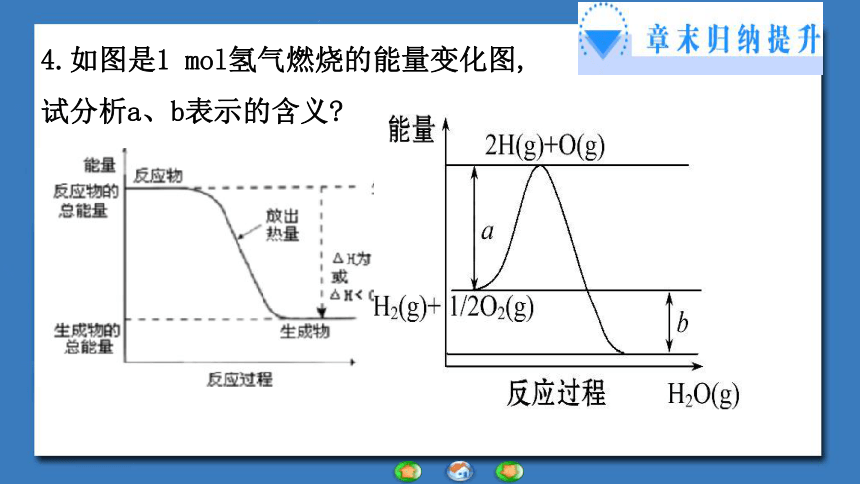
4.如图是1 mol氢气燃烧的能量变化图,试分析a、b表示的含义?【归纳小结】一个化学反应是放热反应还是吸热反应
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小,即取决于反应物的总能量与生成物的总能量的相对大小,与反应条件无关。
A. Q1>Q2 B. Q1=Q2
C. Q1 A.实验室制H2的反应 B.硫的燃烧
C.水的分解反应 D.石灰石分解的反应
E.碳与水蒸气的反应 F.碳与二氧化碳的反应
G.盐酸与氢氧化钠的反应 课堂小练 ABG CDEF(2).下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.放热反应一定不需要加热
C.有的吸热反应在不加热的情况下也能发生
D.任何放热反应在常温条件下一定能发生反应C3常见的放热反应(5)物质的缓慢氧化。(4)大多数化合反应,如2H2+O2 ====2H2O;
(3)酸碱中和反应,如HCl+NaOH====NaCl+H2O;(2)活泼金属与酸或水的反应,如Zn+H2SO4====ZnSO4+H2↑;(1)一切燃烧反应,如CH4+2O2 ==== CO2+2H2O;
4.常见的吸热反应:
(1)铵态氮肥和碱的反应
(晶体Ba(OH)2?8H2O+NH4Cl的反应)
(2)大多数的分解反应(特别持续加热的)
(3)以H2、CO、C为还原剂的氧化还原反应
(除了它们参与的烧反应)三:吸热反应与放热反应的判断(1)根据反应物和生成物的总能量的相对大小判断——决定因素。
若反应物的总能量大于生成物的总能量,属于放热反应,否则是吸热反应。吸热反应放热反应的判断AC例2、已知金刚石在一定条件下转化为石墨是放热的。据此,以下判断或说法不正确的是( )
A、石墨不如金刚石稳定
B、金刚石不如石墨稳定
C、金刚石和石墨互为同素异形体
D、这个反应属于化学变化 (3)根据反应物和生成物的相对稳定性判断。
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应。A请认真观察下图,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应。
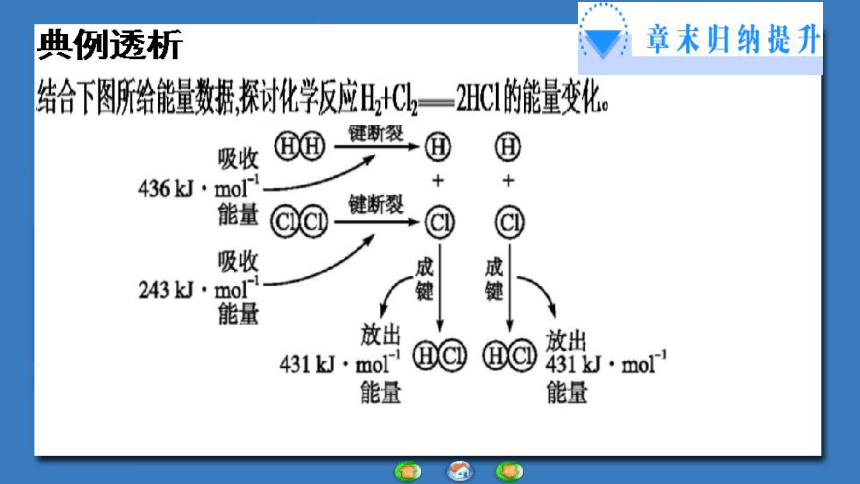
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)_____kJ的热量。
(3)下列反应中,属于放热反应的是______,属于吸热反应的是______。
①物质燃烧 ② 铁粉与稀盐酸反应 ③酸碱中和反应
④二氧化碳通过炽热的碳 ⑤Ba(OH)2·8H2O与NH4Cl反应 知识点再现放热放出11①②③④⑤1.化学键的破坏和化学键的形成与吸热放热的关系
2.物质自身能量与吸热放热的关系
3.吸热反应放热反应的判断方法的总结
课堂小结
第二章 化学能与热能1、了解化学反应的实质
2、学会分析物质自身能量与吸热放热的关系
3、能够掌握吸热反应与放热反应的判断方法
学习目标一:化学反应的实质放热(1)化学键的 和 是化学反应中能量变化的主要原因。(3)化学反应的实质用化学键理论可表述为旧化学键的 和新化学键的 。【归纳小结】断裂形成断裂形成(2)断键吸热成键放热二:物质自身能量与吸热放热的关系①反应物总能量>生成物总能量 反应放出能量
②反应物总能量<生成物总能量 反应吸收能量2、化学反应过程中能量变化的表示
4.如图是1 mol氢气燃烧的能量变化图,试分析a、b表示的含义?【归纳小结】一个化学反应是放热反应还是吸热反应
取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小,即取决于反应物的总能量与生成物的总能量的相对大小,与反应条件无关。
A. Q1>Q2 B. Q1=Q2
C. Q1
C.水的分解反应 D.石灰石分解的反应
E.碳与水蒸气的反应 F.碳与二氧化碳的反应
G.盐酸与氢氧化钠的反应 课堂小练 ABG CDEF(2).下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.放热反应一定不需要加热
C.有的吸热反应在不加热的情况下也能发生
D.任何放热反应在常温条件下一定能发生反应C3常见的放热反应(5)物质的缓慢氧化。(4)大多数化合反应,如2H2+O2 ====2H2O;
(3)酸碱中和反应,如HCl+NaOH====NaCl+H2O;(2)活泼金属与酸或水的反应,如Zn+H2SO4====ZnSO4+H2↑;(1)一切燃烧反应,如CH4+2O2 ==== CO2+2H2O;
4.常见的吸热反应:
(1)铵态氮肥和碱的反应
(晶体Ba(OH)2?8H2O+NH4Cl的反应)
(2)大多数的分解反应(特别持续加热的)
(3)以H2、CO、C为还原剂的氧化还原反应
(除了它们参与的烧反应)三:吸热反应与放热反应的判断(1)根据反应物和生成物的总能量的相对大小判断——决定因素。
若反应物的总能量大于生成物的总能量,属于放热反应,否则是吸热反应。吸热反应放热反应的判断AC例2、已知金刚石在一定条件下转化为石墨是放热的。据此,以下判断或说法不正确的是( )
A、石墨不如金刚石稳定
B、金刚石不如石墨稳定
C、金刚石和石墨互为同素异形体
D、这个反应属于化学变化 (3)根据反应物和生成物的相对稳定性判断。
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应。A请认真观察下图,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)_____kJ的热量。
(3)下列反应中,属于放热反应的是______,属于吸热反应的是______。
①物质燃烧 ② 铁粉与稀盐酸反应 ③酸碱中和反应
④二氧化碳通过炽热的碳 ⑤Ba(OH)2·8H2O与NH4Cl反应 知识点再现放热放出11①②③④⑤1.化学键的破坏和化学键的形成与吸热放热的关系
2.物质自身能量与吸热放热的关系
3.吸热反应放热反应的判断方法的总结
课堂小结
