2016年9月海口市琼山中学高三复习知识回顾必修一复习《物质的分类》教学设计
文档属性
| 名称 | 2016年9月海口市琼山中学高三复习知识回顾必修一复习《物质的分类》教学设计 | 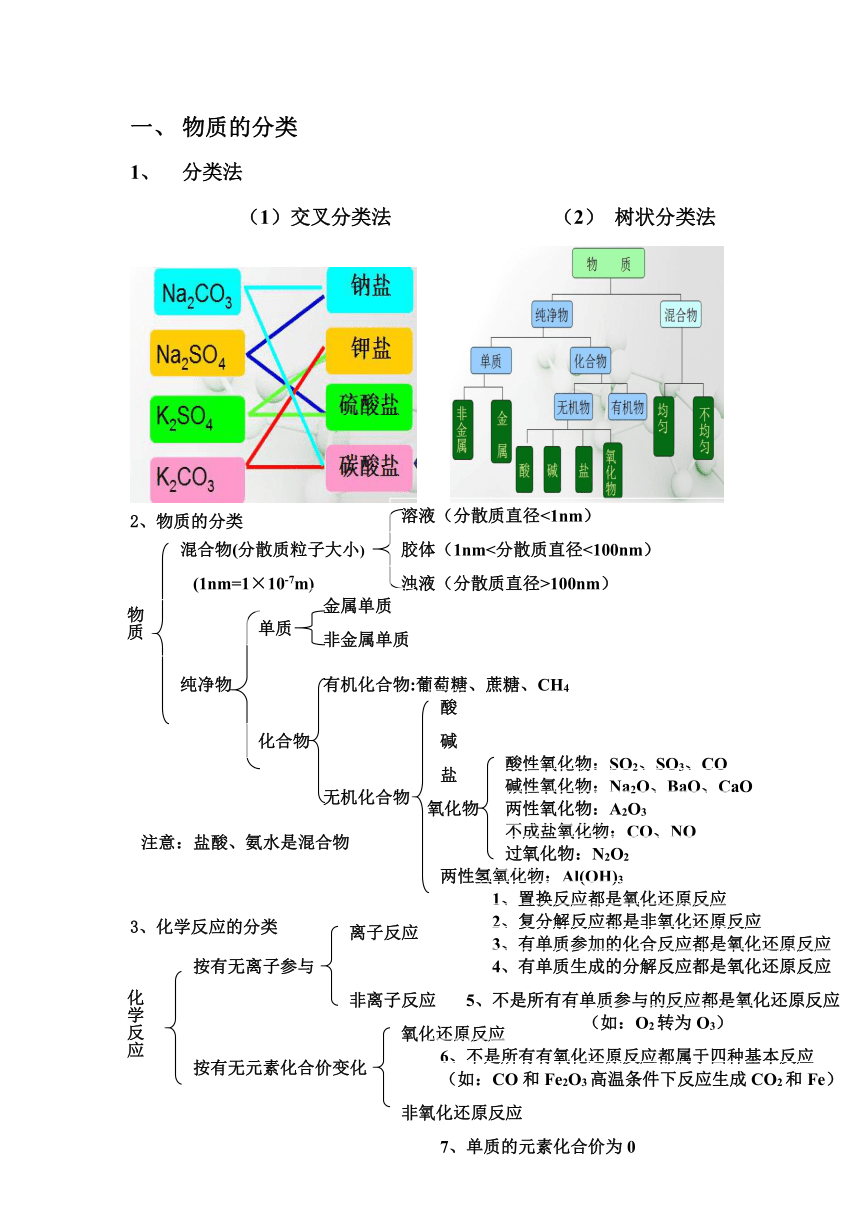 | |
| 格式 | zip | ||
| 文件大小 | 110.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-03 14:48:38 | ||
图片预览



文档简介
物质的分类
分类法
(1)交叉分类法
(2)
树状分类法
2、物质的分类
3、化学反应的分类
4、溶液、胶体、浊液的本质特征(区分标准)(1nm=1×10-9m)
①
溶液(本质特征):分散质粒子直径(大小)<1nm的分散系,直径<1×10-9m
②
胶体(本质特征):
1nm<分散质粒子直径(大小)<100nm的分散系,
1×10-9m<直径<1×10-7m
③
浊液(本质特征):分散质粒子直径(大小)>100nm的分散系,
直径>1×10-7m
5、溶液、胶体、浊液的一些性质
①
如何区分胶体和溶液:丁达尔效应(用激光笔或手电筒照射液体,形成光亮通路的是胶体;没有光亮通路的是溶液)
②
丁达尔效应是由于胶体粒子对光线的散射形成的,不是胶体粒子本身发光
③
分离溶液、胶体和浊液
过滤(浊液留在滤纸上,溶液和胶体通过滤纸)
渗析法(分离溶液和胶体,胶体留在半透膜内,溶液可通过半透膜)
注意:可用渗析法提纯胶体
④
溶液稳定、胶体具有介稳性(胶体稳定性介于溶液和浊液之间)、浊液性质不稳定
⑤
胶体介稳性的原因:
胶体粒子吸附相同电性离子,同性相斥。(主要原因)
布朗运动(微粒作永不停歇、无规则的运动)(次要原因)
⑥
胶体聚沉方法:I.加入电解质溶液;II.加入带相反电荷胶体粒子;
加热胶体
⑦
制备Fe(OH)3胶体方法:往煮沸的蒸馏水中逐滴加入FeCl3饱和溶液,知道溶液变为红褐色则停止加热。
化学方程式:FeCl3
+
3H2O
=====
Fe(OH)3(胶体)
+
3HCl
离子方程式:Fe3++
3H2O
=====
Fe(OH)3(胶体)
+
3H+
离子反应
电解质和非电解质
电解质:在水溶液或熔融状态下能导电的化合物;酸、碱、盐、金属氧化物和H2O。
非电解质:在水溶液和熔融状态下均能导电的化合物;大多数有机物、非金属氧化物和NH3。
注意:AgCl、BaSO4和CaCO3等虽为难溶物,但都是盐,所以都是电解质。
导电物质:①
有导电的微粒(电子或离子);②
能自由移动。
导电物质:①单质(自由移动电子):金属单质、非金属单质石墨
导电物质:②混合物(自由移动离子):酸溶液、碱溶液和可溶性盐溶液
注意:①纯净的酸、碱、盐、金属氧化物都不导电
②单质、混合物既不是电解质,又不是非电解质。
③是电解质,但熔融状态下不导电的是酸(如HCl、H2SO4、HNO3)
电离
电解质在水溶液或熔融状态下电离出自由移动离子的过程。
H2SO4=2H++SO42-
Ba(OH)2=Ba2++2OH-
FeSO4=Fe2++SO42-
NaHCO3=Na++HCO3-
NaHSO4=Na++H++SO42-
FeCl3=Fe3++3Cl-
熔融状态下:FeCl3===Fe3++3Cl-
离子反应
发生依据
①复分解型离子反应:I.气体;II.沉淀;III.H2O。
②有离子参加的氧化还原反应:2Fe3++Fe=Fe2+;2Fe3++Cu=2Fe2++Cu2+
;2Fe2++Cl2=2Fe3++2Cl-
离子方程式书写:①写(化学方程式:反应条件、气体符号、沉淀符号)
②拆(易溶且易电离)③删(等号两边相同的离子)④查(元素/电荷守恒)
可拆成离子的物质:①三大强酸:HCl、H2SO4、HNO3
②四大强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2
③可溶性盐:钠盐、钾盐、铵盐、硝酸盐及其他可溶性盐
根据溶解性口诀得知其它可溶性盐:
钾鈉铵硝酸盐全溶
氯化物不溶氯化银
碳酸磷酸亚硫酸
可溶只有钾钠铵
硫酸盐不溶钡钙银
溶碱钡加钾钠铵
(3)
常见有色离子:
Cu2+
:蓝色;Fe2+
:浅绿色;Fe3+
:黄色;MnO4-
:紫红色。
(4)
离子共存:离子间不发生反应(没有沉淀、气体或H2O生成)
氧化还原反应
判断依据:反应过程中有元素化合价变化(升降)的是氧化还原反应,实质是有电子转移(得失或偏移)。
氧化剂、还原剂、氧化产物和还原产物的判断:
升、失、氧、还:化合价升高,失去电子,被氧化(发生氧化反应)的是还原剂
降、得、还、氧:化合价降低,得到电子,被还原(发生还原反应)的是氧化剂
还原剂
+
氧化剂
=
氧化产物
+
还原产物
双线桥法和单线桥法(看课本和笔记)
双线桥法:
4Na
+
O2
=
2Na2O
单线桥法:
4Na
+
O2
=
2Na2O
配平:①标价态;②粗略配平变价元素原子个数;③列变化(双线桥/列化合价变化);④定总数(通过最小公倍数法确定得失电子总数,从而配好氧化剂、还原剂、氧化产物和还原产物的化学计量数);⑤平计量(先配金属元素,再配非金属元素,接着配H,最后配氧)。
注意:失去电子总数=得到电子总数=电子转移数目
涉及化学反应的计算:①化学反应中各物质的物质的量(n)之比等于化学计量数之比(包括电子);
②
N=n·NA
;m
=
n·M;V
=
n·Vm;n
=
C·V
钠及其化合物
地壳中含量最高的四种元素依次是:O、Si、Al和Fe。
金属钠(Na):银白色金属,密度小(比水小),熔点低,易被空气中氧气氧化(Na2O),保存在煤油或石蜡油中。
钠(Na)与O2反应(反应条件不同,产物也不同,跟氧气的量无关):
①
4Na
+
O2
=
2Na2O
(常温下反应,Na2O是白色固体)
氧化剂:O2;还原剂:Na;氧化产物:Na2O;还原产物:Na2O。转移了4个电子(电子的化学计量数是4)
②
2Na
+
O2
===
Na2O2
(加热条件下反应,Na2O2是淡黄色固体)
氧化剂:O2;还原剂:Na;氧化产物:Na2O2;还原产物:Na2O2。转移了2个电子(电子的化学计量数是2)。O22-是过氧根离子,氧元素是-1价。
钠(Na)与H2O反应(现象:①
“浮”:钠浮在水面上;鈉的密度比水小。②“熔”:钠熔化成小球;钠与水反应放热且钠的熔点低。③“游”:钠在水面上四处游动;反应有气体生成。④“响”:反应中有“嘶嘶”的响声;反应剧烈。⑤“红”:加入酚酞,溶液变红;反应有碱生成。)
2Na
+
2H2O
=
2NaOH
+
H2↑
氧化剂:H2O;还原剂:Na;氧化产物:NaOH;还原产物:H2。转移了2个电子(电子的化学计量数是2)。
5、Na与CuSO4溶液反应
总反应:2Na
+
CuSO4
+
2H2O
=
Cu(OH)2↓
+
H2↑
+
Na2SO4
第一步反应(与H2O反应):2Na
+
2H2O
=
2NaOH
+
H2↑
第二步反应(生成的NaOH与CuSO4反应):2NaOH
+
CuSO4
=
Cu(OH)2↓
+
Na2SO4
过氧化钠(Na2O2)的重要性质
金属钠加热条件下反应生成过氧化钠(淡黄色固体)
淡黄色固体有:过氧化钠(Na2O2)、硫磺(S)、溴化银(AgBr)
带磁性的黑色晶体:Fe3O4
阳离子数(Na+):阴离子数(O22-)=
2:1。
O22-:过氧根离子
过氧化钠(Na2O2)与水反应:
现象:I.
试管发烫;过氧化钠与水反应放热。II.带火星小木条复燃:反应有氧气生成。III.加入酚酞溶液变红;反应有碱生成。IV.溶液褪色;过氧化钠(Na2O2)有漂白性。
②
2Na2O2
+
2H2O
=
4NaOH
+
O2↑
氧化剂:Na2O2;还原剂:Na2O2;氧化产物:O2;还原产物:NaOH。转移2个电子(电子化学计量数是2)。H2O化合价没变化,不是氧化剂也不是还原剂。
③
2Na2O2
+
2CO2
=
2Na2CO3
+
O2
该反应是Na2O2用作呼吸面具的反应
氧化剂:Na2O2;还原剂:Na2O2;氧化产物:O2;还原产物:Na2CO3。转移2个电子(电子化学计量数是2)。CO2化合价没变化,不是氧化剂也不是还原剂。
④
2Na2O2
+
4HCl
=
4NaCl
+
2H2O
+
O2↑
氧化剂:Na2O2;还原剂:Na2O2;氧化产物:O2;还原产物:H2O。转移2个电子(电子化学计量数是2)。HCl化合价没变化,不是氧化剂也不是还原剂。
注意:过氧化钠(Na2O2)是过氧化物(有O22-),但不是碱性氧化物。
⑤
单线桥表示电子转移:2Na2O2
+
4HCl
=
4NaCl
+
2H2O
+
O2↑
⑥
Na2O2可作为呼吸面具(潜艇、太空)、漂白剂、供氧剂和氧化剂。
⑦
注意1:如果将含水蒸气(H2O)和二氧化碳(CO2)的混合气体通入装有Na2O2的装置中,Na2O2先跟CO2反应,待CO2反应完后如果Na2O2还有剩余,Na2O2再与水蒸气(H2O)反应。
注意2:将Na2O2放入紫色石蕊溶液中,溶液先变蓝(Na2O2与H2O反应生成碱),然后溶液褪色(Na2O2具有漂白性)
碳酸钠(Na2CO3)与碳酸氢钠(NaHCO3)的比较
“钠三角”
Na2O2
溶液(分散质直径<1nm)
胶体(1nm<分散质直径<100nm)
混合物(分散质粒子大小)
(1nm=1×10-7m)
浊液(分散质直径>100nm)
金属单质
两性氢氧化物:Al(OH)3
过氧化物:N2O2
不成盐氧化物:CO、NO
两性氧化物:A2O3
碱性氧化物:Na2O、BaO、CaO
酸性氧化物:SO2、SO3、CO
氧化物
盐
碱
酸
有机化合物:葡萄糖、蔗糖、CH4
非金属单质
单质
纯净物
物质
化合物
无机化合物
注意:盐酸、氨水是混合物
1、置换反应都是氧化还原反应
2、复分解反应都是非氧化还原反应
3、有单质参加的化合反应都是氧化还原反应
离子反应
4、有单质生成的分解反应都是氧化还原反应
按有无离子参与
5、不是所有有单质参与的反应都是氧化还原反应
非离子反应
化学反应
(如:O2转为O3)
氧化还原反应
6、不是所有有氧化还原反应都属于四种基本反应
(如:CO和Fe2O3高温条件下反应生成CO2和Fe)
按有无元素化合价变化
7、单质的元素化合价为0
非氧化还原反应
△
△
熔融
化合价升高,失去电子,被氧化(氧化反应)
化合价降低,得到电子,被还原(还原反应)
失4×e-
得2×2e-
4e-
失4×e-
得2×2e-
失2×e-
△
得2×e-
失2×e-
得2×e-
得2×e-
失2×e-
得2×e-
失2×e-
得2×e-
失2×e-
2e-
Na2CO3
NaHCO3
小苏打
纯碱、苏打
俗名
白色晶体
白色粉末
颜色状态
Na2CO3
>
NaHCO3
溶解性
均为碱性
水溶液
Na2CO3溶液碱性大于NaHCO3溶液,加入酚酞溶液后,Na2CO3溶液颜色更深
酸碱性
△
2NaHCO3
===
Na2CO3
+
H2O
+
CO2↑
稳定,受热不分解
热稳定性
方法3:将Na2CO3固体和NaHCO3固体分别溶解在装有水的两试管中,然后分别加入稀盐酸,很快就有气泡冒出的是NaHCO3溶液,一段时间后才出现气泡的是Na2CO3溶液。
方法2:将Na2CO3固体和NaHCO3固体分别溶解在装有水的两试管中,然后分别加入BaCl2溶液(或CaCl2溶液),有白色沉淀生成的是Na2CO3溶液,没有明显现象的是NaHCO3溶液。
方法1:加热固体,能产生使澄清石灰水变浑浊的是NaHCO3固体,不能使澄清石灰水变浑浊的是Na2CO3固体。
和NaHCO3
鉴别Na2CO3
不反应
Na2CO3
+
CO2
+
H2O
=
2NaHCO3
与CO2
不反应
Na2CO3
+
BaCl2
=
BaCO3↓
+
2NaCl
BaCl2溶液
NaHCO3
+
NaOH
=
Na2CO3
+
H2O
不反应
与NaOH溶液
②
①
③
Na2CO3
NaOH
④
②
2Na2O2
+
2CO2
=
2Na2CO3
+
O2↑
①
2Na2O2
+
2H2O
=
4NaOH
+
O2↑
④
Na2CO3
+
Ca(OH)2
=
CaCO3↓
+
2NaOH
③
Na2CO3
+
CO2
+
H2O
=
2NaHCO3
分类法
(1)交叉分类法
(2)
树状分类法
2、物质的分类
3、化学反应的分类
4、溶液、胶体、浊液的本质特征(区分标准)(1nm=1×10-9m)
①
溶液(本质特征):分散质粒子直径(大小)<1nm的分散系,直径<1×10-9m
②
胶体(本质特征):
1nm<分散质粒子直径(大小)<100nm的分散系,
1×10-9m<直径<1×10-7m
③
浊液(本质特征):分散质粒子直径(大小)>100nm的分散系,
直径>1×10-7m
5、溶液、胶体、浊液的一些性质
①
如何区分胶体和溶液:丁达尔效应(用激光笔或手电筒照射液体,形成光亮通路的是胶体;没有光亮通路的是溶液)
②
丁达尔效应是由于胶体粒子对光线的散射形成的,不是胶体粒子本身发光
③
分离溶液、胶体和浊液
过滤(浊液留在滤纸上,溶液和胶体通过滤纸)
渗析法(分离溶液和胶体,胶体留在半透膜内,溶液可通过半透膜)
注意:可用渗析法提纯胶体
④
溶液稳定、胶体具有介稳性(胶体稳定性介于溶液和浊液之间)、浊液性质不稳定
⑤
胶体介稳性的原因:
胶体粒子吸附相同电性离子,同性相斥。(主要原因)
布朗运动(微粒作永不停歇、无规则的运动)(次要原因)
⑥
胶体聚沉方法:I.加入电解质溶液;II.加入带相反电荷胶体粒子;
加热胶体
⑦
制备Fe(OH)3胶体方法:往煮沸的蒸馏水中逐滴加入FeCl3饱和溶液,知道溶液变为红褐色则停止加热。
化学方程式:FeCl3
+
3H2O
=====
Fe(OH)3(胶体)
+
3HCl
离子方程式:Fe3++
3H2O
=====
Fe(OH)3(胶体)
+
3H+
离子反应
电解质和非电解质
电解质:在水溶液或熔融状态下能导电的化合物;酸、碱、盐、金属氧化物和H2O。
非电解质:在水溶液和熔融状态下均能导电的化合物;大多数有机物、非金属氧化物和NH3。
注意:AgCl、BaSO4和CaCO3等虽为难溶物,但都是盐,所以都是电解质。
导电物质:①
有导电的微粒(电子或离子);②
能自由移动。
导电物质:①单质(自由移动电子):金属单质、非金属单质石墨
导电物质:②混合物(自由移动离子):酸溶液、碱溶液和可溶性盐溶液
注意:①纯净的酸、碱、盐、金属氧化物都不导电
②单质、混合物既不是电解质,又不是非电解质。
③是电解质,但熔融状态下不导电的是酸(如HCl、H2SO4、HNO3)
电离
电解质在水溶液或熔融状态下电离出自由移动离子的过程。
H2SO4=2H++SO42-
Ba(OH)2=Ba2++2OH-
FeSO4=Fe2++SO42-
NaHCO3=Na++HCO3-
NaHSO4=Na++H++SO42-
FeCl3=Fe3++3Cl-
熔融状态下:FeCl3===Fe3++3Cl-
离子反应
发生依据
①复分解型离子反应:I.气体;II.沉淀;III.H2O。
②有离子参加的氧化还原反应:2Fe3++Fe=Fe2+;2Fe3++Cu=2Fe2++Cu2+
;2Fe2++Cl2=2Fe3++2Cl-
离子方程式书写:①写(化学方程式:反应条件、气体符号、沉淀符号)
②拆(易溶且易电离)③删(等号两边相同的离子)④查(元素/电荷守恒)
可拆成离子的物质:①三大强酸:HCl、H2SO4、HNO3
②四大强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2
③可溶性盐:钠盐、钾盐、铵盐、硝酸盐及其他可溶性盐
根据溶解性口诀得知其它可溶性盐:
钾鈉铵硝酸盐全溶
氯化物不溶氯化银
碳酸磷酸亚硫酸
可溶只有钾钠铵
硫酸盐不溶钡钙银
溶碱钡加钾钠铵
(3)
常见有色离子:
Cu2+
:蓝色;Fe2+
:浅绿色;Fe3+
:黄色;MnO4-
:紫红色。
(4)
离子共存:离子间不发生反应(没有沉淀、气体或H2O生成)
氧化还原反应
判断依据:反应过程中有元素化合价变化(升降)的是氧化还原反应,实质是有电子转移(得失或偏移)。
氧化剂、还原剂、氧化产物和还原产物的判断:
升、失、氧、还:化合价升高,失去电子,被氧化(发生氧化反应)的是还原剂
降、得、还、氧:化合价降低,得到电子,被还原(发生还原反应)的是氧化剂
还原剂
+
氧化剂
=
氧化产物
+
还原产物
双线桥法和单线桥法(看课本和笔记)
双线桥法:
4Na
+
O2
=
2Na2O
单线桥法:
4Na
+
O2
=
2Na2O
配平:①标价态;②粗略配平变价元素原子个数;③列变化(双线桥/列化合价变化);④定总数(通过最小公倍数法确定得失电子总数,从而配好氧化剂、还原剂、氧化产物和还原产物的化学计量数);⑤平计量(先配金属元素,再配非金属元素,接着配H,最后配氧)。
注意:失去电子总数=得到电子总数=电子转移数目
涉及化学反应的计算:①化学反应中各物质的物质的量(n)之比等于化学计量数之比(包括电子);
②
N=n·NA
;m
=
n·M;V
=
n·Vm;n
=
C·V
钠及其化合物
地壳中含量最高的四种元素依次是:O、Si、Al和Fe。
金属钠(Na):银白色金属,密度小(比水小),熔点低,易被空气中氧气氧化(Na2O),保存在煤油或石蜡油中。
钠(Na)与O2反应(反应条件不同,产物也不同,跟氧气的量无关):
①
4Na
+
O2
=
2Na2O
(常温下反应,Na2O是白色固体)
氧化剂:O2;还原剂:Na;氧化产物:Na2O;还原产物:Na2O。转移了4个电子(电子的化学计量数是4)
②
2Na
+
O2
===
Na2O2
(加热条件下反应,Na2O2是淡黄色固体)
氧化剂:O2;还原剂:Na;氧化产物:Na2O2;还原产物:Na2O2。转移了2个电子(电子的化学计量数是2)。O22-是过氧根离子,氧元素是-1价。
钠(Na)与H2O反应(现象:①
“浮”:钠浮在水面上;鈉的密度比水小。②“熔”:钠熔化成小球;钠与水反应放热且钠的熔点低。③“游”:钠在水面上四处游动;反应有气体生成。④“响”:反应中有“嘶嘶”的响声;反应剧烈。⑤“红”:加入酚酞,溶液变红;反应有碱生成。)
2Na
+
2H2O
=
2NaOH
+
H2↑
氧化剂:H2O;还原剂:Na;氧化产物:NaOH;还原产物:H2。转移了2个电子(电子的化学计量数是2)。
5、Na与CuSO4溶液反应
总反应:2Na
+
CuSO4
+
2H2O
=
Cu(OH)2↓
+
H2↑
+
Na2SO4
第一步反应(与H2O反应):2Na
+
2H2O
=
2NaOH
+
H2↑
第二步反应(生成的NaOH与CuSO4反应):2NaOH
+
CuSO4
=
Cu(OH)2↓
+
Na2SO4
过氧化钠(Na2O2)的重要性质
金属钠加热条件下反应生成过氧化钠(淡黄色固体)
淡黄色固体有:过氧化钠(Na2O2)、硫磺(S)、溴化银(AgBr)
带磁性的黑色晶体:Fe3O4
阳离子数(Na+):阴离子数(O22-)=
2:1。
O22-:过氧根离子
过氧化钠(Na2O2)与水反应:
现象:I.
试管发烫;过氧化钠与水反应放热。II.带火星小木条复燃:反应有氧气生成。III.加入酚酞溶液变红;反应有碱生成。IV.溶液褪色;过氧化钠(Na2O2)有漂白性。
②
2Na2O2
+
2H2O
=
4NaOH
+
O2↑
氧化剂:Na2O2;还原剂:Na2O2;氧化产物:O2;还原产物:NaOH。转移2个电子(电子化学计量数是2)。H2O化合价没变化,不是氧化剂也不是还原剂。
③
2Na2O2
+
2CO2
=
2Na2CO3
+
O2
该反应是Na2O2用作呼吸面具的反应
氧化剂:Na2O2;还原剂:Na2O2;氧化产物:O2;还原产物:Na2CO3。转移2个电子(电子化学计量数是2)。CO2化合价没变化,不是氧化剂也不是还原剂。
④
2Na2O2
+
4HCl
=
4NaCl
+
2H2O
+
O2↑
氧化剂:Na2O2;还原剂:Na2O2;氧化产物:O2;还原产物:H2O。转移2个电子(电子化学计量数是2)。HCl化合价没变化,不是氧化剂也不是还原剂。
注意:过氧化钠(Na2O2)是过氧化物(有O22-),但不是碱性氧化物。
⑤
单线桥表示电子转移:2Na2O2
+
4HCl
=
4NaCl
+
2H2O
+
O2↑
⑥
Na2O2可作为呼吸面具(潜艇、太空)、漂白剂、供氧剂和氧化剂。
⑦
注意1:如果将含水蒸气(H2O)和二氧化碳(CO2)的混合气体通入装有Na2O2的装置中,Na2O2先跟CO2反应,待CO2反应完后如果Na2O2还有剩余,Na2O2再与水蒸气(H2O)反应。
注意2:将Na2O2放入紫色石蕊溶液中,溶液先变蓝(Na2O2与H2O反应生成碱),然后溶液褪色(Na2O2具有漂白性)
碳酸钠(Na2CO3)与碳酸氢钠(NaHCO3)的比较
“钠三角”
Na2O2
溶液(分散质直径<1nm)
胶体(1nm<分散质直径<100nm)
混合物(分散质粒子大小)
(1nm=1×10-7m)
浊液(分散质直径>100nm)
金属单质
两性氢氧化物:Al(OH)3
过氧化物:N2O2
不成盐氧化物:CO、NO
两性氧化物:A2O3
碱性氧化物:Na2O、BaO、CaO
酸性氧化物:SO2、SO3、CO
氧化物
盐
碱
酸
有机化合物:葡萄糖、蔗糖、CH4
非金属单质
单质
纯净物
物质
化合物
无机化合物
注意:盐酸、氨水是混合物
1、置换反应都是氧化还原反应
2、复分解反应都是非氧化还原反应
3、有单质参加的化合反应都是氧化还原反应
离子反应
4、有单质生成的分解反应都是氧化还原反应
按有无离子参与
5、不是所有有单质参与的反应都是氧化还原反应
非离子反应
化学反应
(如:O2转为O3)
氧化还原反应
6、不是所有有氧化还原反应都属于四种基本反应
(如:CO和Fe2O3高温条件下反应生成CO2和Fe)
按有无元素化合价变化
7、单质的元素化合价为0
非氧化还原反应
△
△
熔融
化合价升高,失去电子,被氧化(氧化反应)
化合价降低,得到电子,被还原(还原反应)
失4×e-
得2×2e-
4e-
失4×e-
得2×2e-
失2×e-
△
得2×e-
失2×e-
得2×e-
得2×e-
失2×e-
得2×e-
失2×e-
得2×e-
失2×e-
2e-
Na2CO3
NaHCO3
小苏打
纯碱、苏打
俗名
白色晶体
白色粉末
颜色状态
Na2CO3
>
NaHCO3
溶解性
均为碱性
水溶液
Na2CO3溶液碱性大于NaHCO3溶液,加入酚酞溶液后,Na2CO3溶液颜色更深
酸碱性
△
2NaHCO3
===
Na2CO3
+
H2O
+
CO2↑
稳定,受热不分解
热稳定性
方法3:将Na2CO3固体和NaHCO3固体分别溶解在装有水的两试管中,然后分别加入稀盐酸,很快就有气泡冒出的是NaHCO3溶液,一段时间后才出现气泡的是Na2CO3溶液。
方法2:将Na2CO3固体和NaHCO3固体分别溶解在装有水的两试管中,然后分别加入BaCl2溶液(或CaCl2溶液),有白色沉淀生成的是Na2CO3溶液,没有明显现象的是NaHCO3溶液。
方法1:加热固体,能产生使澄清石灰水变浑浊的是NaHCO3固体,不能使澄清石灰水变浑浊的是Na2CO3固体。
和NaHCO3
鉴别Na2CO3
不反应
Na2CO3
+
CO2
+
H2O
=
2NaHCO3
与CO2
不反应
Na2CO3
+
BaCl2
=
BaCO3↓
+
2NaCl
BaCl2溶液
NaHCO3
+
NaOH
=
Na2CO3
+
H2O
不反应
与NaOH溶液
②
①
③
Na2CO3
NaOH
④
②
2Na2O2
+
2CO2
=
2Na2CO3
+
O2↑
①
2Na2O2
+
2H2O
=
4NaOH
+
O2↑
④
Na2CO3
+
Ca(OH)2
=
CaCO3↓
+
2NaOH
③
Na2CO3
+
CO2
+
H2O
=
2NaHCO3
同课章节目录
