【沪教版】化学九年级上册课件 5.1 金属的性质和利用 (共26张PPT)
文档属性
| 名称 | 【沪教版】化学九年级上册课件 5.1 金属的性质和利用 (共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-05 15:19:31 | ||
图片预览






文档简介
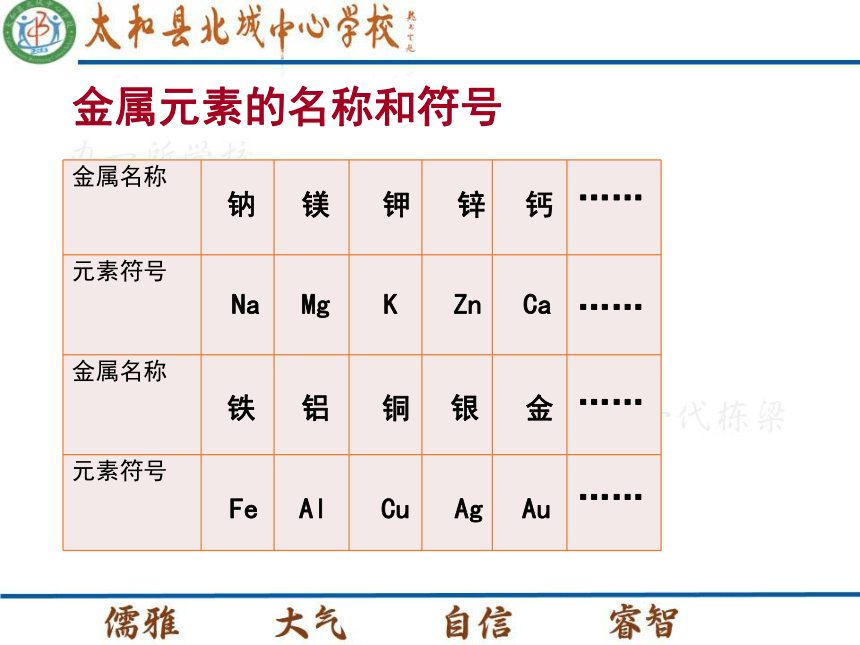
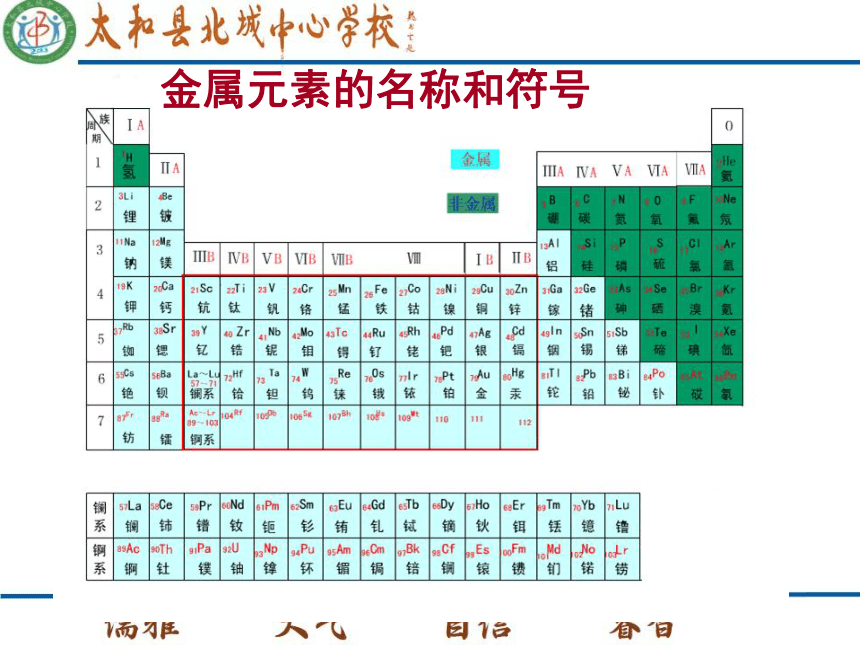
课件26张PPT。第五章 金属的冶炼与利用5.1 金属的性质和利用钠镁钾锌钙NaMgKZnCa铁铝铜银金FeAlCuAgAu……………………金属元素的名称和符号金属元素的名称和符号金属的物理性质常温下金属都是固体(汞除外),
有金属光泽,铜是紫红色,铁、铝等大多数是银白色,
大多数金属都导电导热,
有延展性,
密度较大,
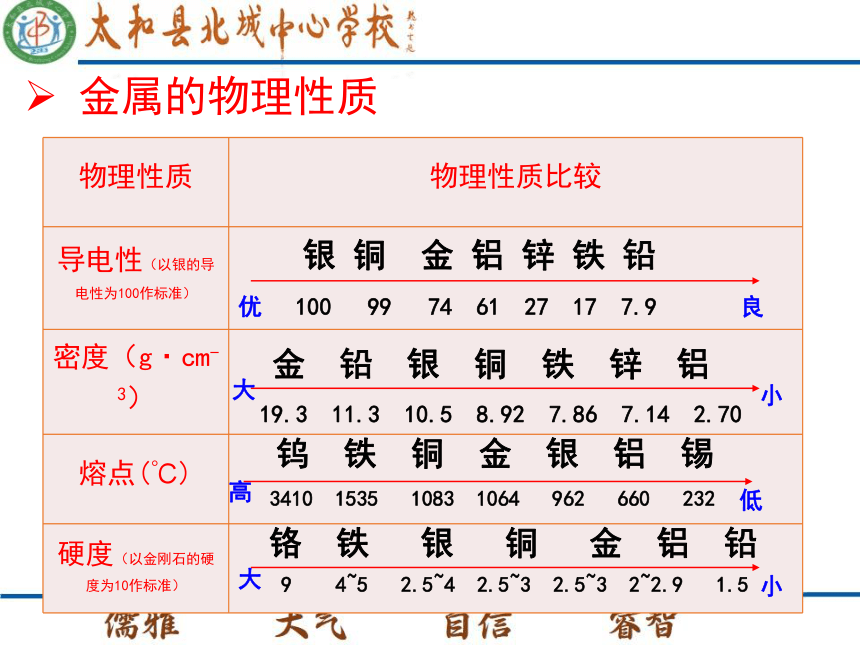
熔点较高。金属的性质金属光泽有些金属粉末细小到一定程度时,吸收可见光后辐射不出去,所以金属粉末一般呈暗灰色或黑色。金属的物理性质金属的性质优良金 铅 银 铜 铁 锌 铝 19.3 11.3 10.5 8.92 7.86 7.14 2.70 大小钨 铁 铜 金 银 铝 锡 3410 1535 1083 1064 962 660 232 高低铬 铁 银 铜 金 铝 铅9 4~5 2.5~4 2.5~3 2.5~3 2~2.9 1.5 大小银 铜 金 铝 锌 铁 铅100 99 74 61 27 17 7.9金属的物理性质金属的性质金属的应用大多数的金属有延性(抽丝,最细的白金丝直径不超过1/5000mm)及展性(压薄片,最薄的金箔只有1/10000mm厚),其中金(Au)的延展性最好;也有少数金属的延展性很差,如锰(Mn)、锌(Zn)等;金属可以被扎制成各种不同的形状,金属金打成金箔贴在器物上“神六”面罩上镀有一层金箔铜丝和铝箔金属的应用延展性漂亮的金银首饰 具有颜色、有金属光泽铁栏杆、锄头、机械零件 硬度大 钢丝、钢板、金属 铁锅、铝锅、电烙铁 导热性好 延展性好电线、电缆 导电性好 金属的性质金属的应用哪些金属可用来打造首饰?为什么?
金、铂可用来打造首饰,原因是它们具有永恒而美丽的光泽
哪些金属可用来制造电线,为什么?
铜可以用来制造电线是因为它易导电
哪些金属可用来制造炊具,为什么?
铁可以用来制造炊具是因为它传热快
哪些金属可拉成细丝或压成薄片,为什么?
金、银、铜、铝可拉成细丝或压成薄片,这是由于它们有延展性,容易加工讨论为什么菜刀、镰刀、锤子等用铁制而不用铅制?
铅的硬度小,而铁的硬度大.
银的导电性比铜好,为什么电线一般用铜制而不用银制?
银的价格比铜高许多
讨论为什么灯泡里的灯丝用钨制而不用锡制?如果用锡制的话,可能会出现什么情况?
钨的熔点高,锡的熔点低,锡丝易烧断.
为什么有的铁制品如水龙头等要镀铬?如果镀金怎么样?
铬硬度大, 耐磨、美观,又防锈,如果镀金则会增加成本且不耐用,日久,金脱落则铁又会生锈而缩短水龙头的使用寿命讨论剧烈燃烧,火星四射,放热,生成黑色固体表面变暗,失去金属光泽表面由红色变成黑色剧烈燃烧,发出耀眼的白光,放热,生成白色固体3Fe+2O2 == Fe3O42Mg+O2==2MgO4Al+3O2==2Al2O3Fe、Mg 、 Al、Cu能与氧气反应点燃点燃金属的性质常见金属的化学性质实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。镁、铝在常温下就能与氧气反应。
铁、铜在常温下不能与氧气反应,但在高温时能与氧气反应。
金即使在高温时不能与氧气反应。
活动性:镁、铝 > 铁、铜 > 金铝是银白色的金属,具有金属光泽,而生活中的铝制品却往往是暗淡无色,知道为什么吗?原因:常温下,铝就能和氧气发生反应,在其表面生成一层 的氧化铝保护膜(Al2O3)。4Al + 3O2 = 2Al2O3致密讨论金属与(稀)酸溶液反应剧烈反应,金属逐渐减少,产生大量气泡剧烈反应,金属逐渐减少,产生大量气泡剧烈较反应,金属逐渐减少,产生大量气泡反应缓慢,金属逐渐
减少,有气泡产生,
溶液由无色变为浅绿色不反应Mg + H2 SO4 == MgSO4 + H2 ↑Mg + 2HCl == MgCl2 + H2↑Zn + H2 SO4 == Zn SO4 + H2 ↑Zn + 2HCl == ZnCl2 + H2 ↑Fe + H2 SO4 == FeSO4 + H2 ↑Fe + 2HCl == FeCl2 + H2 ↑2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑2Al + 6HCl = 2AlCl3 +3H2↑很快很快较快较慢不反应常见金属的化学性质铁和稀盐酸镁和稀盐酸锌和稀盐酸铜和稀盐酸盐酸镁、锌、铁、铜的金属活动性由强到弱金属与金属化合物溶液的反应铁片表面覆盖一层红色物质,溶液由蓝色逐渐变为浅绿色特点: 由一种单质跟一种化合物作用生成另一种单质和另一种化合物的反应叫置换反应。下列反应都是置换反应吗?
3CO + Fe2O3 ==== 2Fe + 3CO2高温点燃比较:
化合反应:A+B+…→C
分解反应:A→B+C+…Cl2 + 2KI ==== I2 + 2KClCH4 + 2O2 ==== CO2 + 2H2O置换反应(1)药品:锌和稀硫酸(或稀盐酸) 氢气的实验室制法 Zn+H2SO4=ZnSO4+H2↑为何不用镁或铁等来和酸反应制取氢气?(2)原理: Zn+2HCl=ZnCl2+H2↑思考: ——镁和酸反应速度太快,而铁的反应速度又太慢,不便于操作。(4)收集: ①排水法固液不加热型(3)装置: ②向下排空气法 (5)步骤
①按照要求连 接装置。
②检查 气密性。
③装 药品:先装固体,后装液体。
④开始反应,并收集一小试管氢气,进行验 纯(任何
可燃性气体,在做性质实验之前务必进行验纯)。
⑤用排水法或向下排空气法收 集气体,盖上玻璃片倒
放在实验桌上。 实验装置图定义:就是在金属中加热熔合某些金属或非金属形成的具有金属特征的物质。合金性能:
具有许多良好的物理、化学或机械性能。合金的硬度一般比各成分金属大
多数合金的熔点低于组成它的成分金属
调整合金的配方和改变合金的形成条件,可以制成性能不同的各种合金铁的合金----生铁和钢的比较合金合金与组成它们的纯金属的性质比较合金与纯金属相比,性能上发生了改变,说明物质的组成的改变会使其性能发生改变,合金的用途比纯金属的用途广得多。一些常见合金的特性和用途
有金属光泽,铜是紫红色,铁、铝等大多数是银白色,
大多数金属都导电导热,
有延展性,
密度较大,
熔点较高。金属的性质金属光泽有些金属粉末细小到一定程度时,吸收可见光后辐射不出去,所以金属粉末一般呈暗灰色或黑色。金属的物理性质金属的性质优良金 铅 银 铜 铁 锌 铝 19.3 11.3 10.5 8.92 7.86 7.14 2.70 大小钨 铁 铜 金 银 铝 锡 3410 1535 1083 1064 962 660 232 高低铬 铁 银 铜 金 铝 铅9 4~5 2.5~4 2.5~3 2.5~3 2~2.9 1.5 大小银 铜 金 铝 锌 铁 铅100 99 74 61 27 17 7.9金属的物理性质金属的性质金属的应用大多数的金属有延性(抽丝,最细的白金丝直径不超过1/5000mm)及展性(压薄片,最薄的金箔只有1/10000mm厚),其中金(Au)的延展性最好;也有少数金属的延展性很差,如锰(Mn)、锌(Zn)等;金属可以被扎制成各种不同的形状,金属金打成金箔贴在器物上“神六”面罩上镀有一层金箔铜丝和铝箔金属的应用延展性漂亮的金银首饰 具有颜色、有金属光泽铁栏杆、锄头、机械零件 硬度大 钢丝、钢板、金属 铁锅、铝锅、电烙铁 导热性好 延展性好电线、电缆 导电性好 金属的性质金属的应用哪些金属可用来打造首饰?为什么?
金、铂可用来打造首饰,原因是它们具有永恒而美丽的光泽
哪些金属可用来制造电线,为什么?
铜可以用来制造电线是因为它易导电
哪些金属可用来制造炊具,为什么?
铁可以用来制造炊具是因为它传热快
哪些金属可拉成细丝或压成薄片,为什么?
金、银、铜、铝可拉成细丝或压成薄片,这是由于它们有延展性,容易加工讨论为什么菜刀、镰刀、锤子等用铁制而不用铅制?
铅的硬度小,而铁的硬度大.
银的导电性比铜好,为什么电线一般用铜制而不用银制?
银的价格比铜高许多
讨论为什么灯泡里的灯丝用钨制而不用锡制?如果用锡制的话,可能会出现什么情况?
钨的熔点高,锡的熔点低,锡丝易烧断.
为什么有的铁制品如水龙头等要镀铬?如果镀金怎么样?
铬硬度大, 耐磨、美观,又防锈,如果镀金则会增加成本且不耐用,日久,金脱落则铁又会生锈而缩短水龙头的使用寿命讨论剧烈燃烧,火星四射,放热,生成黑色固体表面变暗,失去金属光泽表面由红色变成黑色剧烈燃烧,发出耀眼的白光,放热,生成白色固体3Fe+2O2 == Fe3O42Mg+O2==2MgO4Al+3O2==2Al2O3Fe、Mg 、 Al、Cu能与氧气反应点燃点燃金属的性质常见金属的化学性质实验表明:大多数金属都能与氧气反应,但反应的难易和剧烈程度不同。镁、铝在常温下就能与氧气反应。
铁、铜在常温下不能与氧气反应,但在高温时能与氧气反应。
金即使在高温时不能与氧气反应。
活动性:镁、铝 > 铁、铜 > 金铝是银白色的金属,具有金属光泽,而生活中的铝制品却往往是暗淡无色,知道为什么吗?原因:常温下,铝就能和氧气发生反应,在其表面生成一层 的氧化铝保护膜(Al2O3)。4Al + 3O2 = 2Al2O3致密讨论金属与(稀)酸溶液反应剧烈反应,金属逐渐减少,产生大量气泡剧烈反应,金属逐渐减少,产生大量气泡剧烈较反应,金属逐渐减少,产生大量气泡反应缓慢,金属逐渐
减少,有气泡产生,
溶液由无色变为浅绿色不反应Mg + H2 SO4 == MgSO4 + H2 ↑Mg + 2HCl == MgCl2 + H2↑Zn + H2 SO4 == Zn SO4 + H2 ↑Zn + 2HCl == ZnCl2 + H2 ↑Fe + H2 SO4 == FeSO4 + H2 ↑Fe + 2HCl == FeCl2 + H2 ↑2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑2Al + 6HCl = 2AlCl3 +3H2↑很快很快较快较慢不反应常见金属的化学性质铁和稀盐酸镁和稀盐酸锌和稀盐酸铜和稀盐酸盐酸镁、锌、铁、铜的金属活动性由强到弱金属与金属化合物溶液的反应铁片表面覆盖一层红色物质,溶液由蓝色逐渐变为浅绿色特点: 由一种单质跟一种化合物作用生成另一种单质和另一种化合物的反应叫置换反应。下列反应都是置换反应吗?
3CO + Fe2O3 ==== 2Fe + 3CO2高温点燃比较:
化合反应:A+B+…→C
分解反应:A→B+C+…Cl2 + 2KI ==== I2 + 2KClCH4 + 2O2 ==== CO2 + 2H2O置换反应(1)药品:锌和稀硫酸(或稀盐酸) 氢气的实验室制法 Zn+H2SO4=ZnSO4+H2↑为何不用镁或铁等来和酸反应制取氢气?(2)原理: Zn+2HCl=ZnCl2+H2↑思考: ——镁和酸反应速度太快,而铁的反应速度又太慢,不便于操作。(4)收集: ①排水法固液不加热型(3)装置: ②向下排空气法 (5)步骤
①按照要求连 接装置。
②检查 气密性。
③装 药品:先装固体,后装液体。
④开始反应,并收集一小试管氢气,进行验 纯(任何
可燃性气体,在做性质实验之前务必进行验纯)。
⑤用排水法或向下排空气法收 集气体,盖上玻璃片倒
放在实验桌上。 实验装置图定义:就是在金属中加热熔合某些金属或非金属形成的具有金属特征的物质。合金性能:
具有许多良好的物理、化学或机械性能。合金的硬度一般比各成分金属大
多数合金的熔点低于组成它的成分金属
调整合金的配方和改变合金的形成条件,可以制成性能不同的各种合金铁的合金----生铁和钢的比较合金合金与组成它们的纯金属的性质比较合金与纯金属相比,性能上发生了改变,说明物质的组成的改变会使其性能发生改变,合金的用途比纯金属的用途广得多。一些常见合金的特性和用途
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
