人教版高中选修4化学第一章 化学反应与能量第一节 化学反应与能量的变化 (26张ppt) (共26张PPT)
文档属性
| 名称 | 人教版高中选修4化学第一章 化学反应与能量第一节 化学反应与能量的变化 (26张ppt) (共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 883.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-06 09:08:07 | ||
图片预览







文档简介
课件26张PPT。第一章 化学反应与能量第一节 化学反应与能量的变化 从物质的角度:有新物质生成从微粒的角度:原子重新组合的过程从化学键的角度:旧键的断裂和新键的形成从能量的角度:释放或贮存能量的过程化学反应的本质一、焓变 反应热1、反应热 恒(等)压过程:反应前后压强不变,体积改变
敞口、针筒、活塞在化学反应过程中放出或吸收的热量恒(等)容过程:反应前后体积不变,压强改变
密闭容器、体积不变容器2、焓变 焓:热力学状态函数。 焓变:在一定条件下(恒压)的反应热
生成物与反应物的焓值差①焓变符号:△H②焓变单位:kJ/mol ③测量条件:恒压下,一般为敞口容器中④“+”:吸热,环境对体系做功自身能量增加
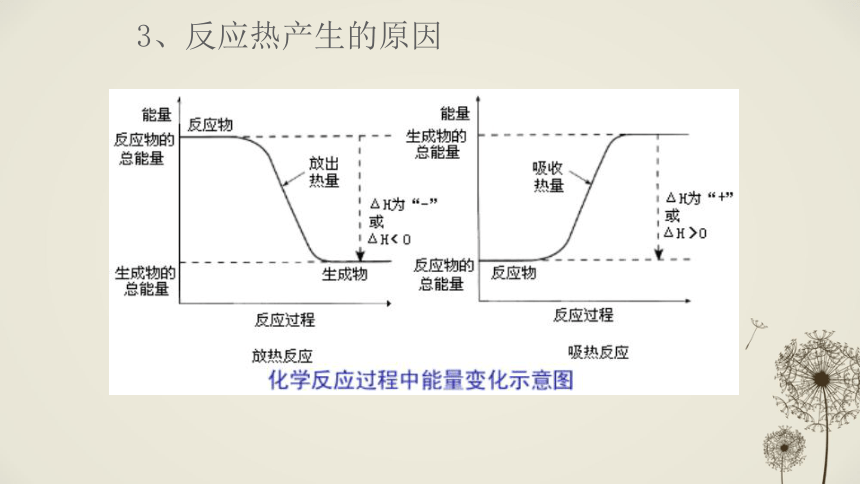
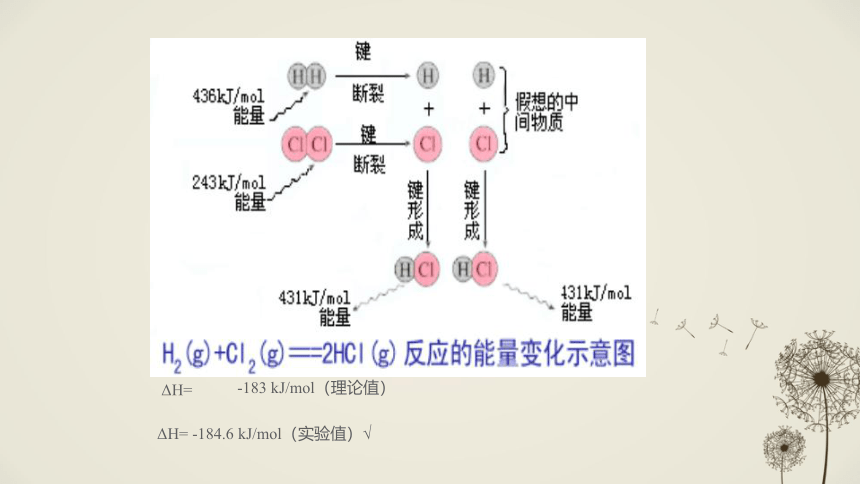
“-”:放热,体系对环境做功自身能量减少3、反应热产生的原因 ①从物质所具有的能量角度 反应物的总能量>生成物的总能量生成物的总能量>反应物的总能量△H>0△H<0放热反应:吸热反应:-183 kJ/mol(理论值)ΔH= -184.6 kJ/mol(实验值)√ΔH=化学键断裂——吸热
化学键形成——放热②从化学键的角度 4、常见吸热反应与放热反应 ①放热反应 放出热量的化学反应。△H 为“-”或△H <0常见放热反应:中和反应
燃烧反应
活泼金属与酸反应
大多数化合反应②吸热反应 吸收热量的化学反应。△H 为“+”或△H >0常见的吸热反应:
大多数分解反应
某些金属氧化物的还原反应
C+CO2 C+H2O
Ba(OH)2·8H2O+NH4Cl 已知拆开1mol H2中的化学键要吸收436 kJ的能量,拆开1mol O2中的化学键要吸收496 kJ的能量,形成水分子中的1mol H—O键要放出463 kJ的能量,试说明 2H2+ O2 = 2H2O中的能量变化。练习△H=-484kJ/mol1、1molC与1molH2O(g)反应生成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。2、拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。 +131.5-92KJ/mol-30.7KJ/mol练 习二、热化学方程式表示参加反应物质的量和反应热的关系的化学方程式。热化学方程式书写要点①需注明反应的温度和压强如在25℃、101KPa下进行的反应,可不注明温度和压强②应注明反应物和生成物的状态气体用g;液体用l;固体用s;溶液用aq2H2(g)+O2(g)=2H2O(g) △H1=-Q1kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-Q2kJ/mol
④化学计量数表示物质的量,而不是分子个数。化学计量数可以是整数,可以是分数。⑤化学计量数与△H成正比,当化学计量数不同时,其△H不同H2(g)+1/2O2(g)=H2O(l),△H=-285.8kJ/mol③右端标注热量数值和符号,
△H:吸热用“+”,放热用:“-”。2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ/mol1、已知在25℃,101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,表示上述反应的热化学方程式正确的是
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g)
ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-5518 kJ·mol-1
C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=+5518 kJ·mol-1
D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-48.40 kJ·mol-1
B2、1克甲烷在空气中燃烧,恢复常温下测得放出热量55.625KJ,试写出热化学方式。CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=- 890 kJ/mol3、常温下14克CO在足量氧气中充分燃烧,
放出141.3KJ热量,写出该热化学方程式。CO(g) + 1/2O2(g)=CO2(g) △H=- 282.6 kJ/mol2H2(g)+O2(g)=2H2O(l),△H1=-Q1kJ/mol
H2(g)+1/2O2(g)=H2O(l),△H2=-Q2kJ/mol4、比较Q1和Q2的大小、 △H1和△H2的大小Q1﹥Q2△H1 <△H2注意:热量比较比数值, △H比较带符号 练:⑴比较Q1<Q2的大小、△H1 >△H2的大小S(g)+O2(g)==SO2(g) △H1=- Q1 kJ/mol
S(s)+O2(g)==SO2(g) △H2=- Q2 kJ/molQ1>Q2△H1 <△H2注意:对于可逆反应,
①当反应逆向进行时,其反应热与正反应的数值相等,符号相反。②其反应热是指反应物完全转变成生成物放出或吸收的热量。6、已知:C(s)+O2(g)==CO2(g) △H=-393.5 kJ/mol
要获得1000kg热量,需燃烧多少克碳?30.5g备用:
已知:S(s)+O2(g)=SO2(g) △H=- 290.6 kJ/mol
求1.6g硫燃烧成为SO2气体,放出多少热量?14.53kJ三、中和反应反应热的测定1、中和热酸与碱反应生成1mol H2O时释放的热量称中和热。数值:稀溶液中,强酸和强碱中和时
△H= -57.3kJ/mol2、中和反应反应热的测定 ①原理:Q=mc△t②仪器及药品③实验步骤b、用一个量筒量取50mL 0.5mol/L盐酸, 倒入 小烧杯中,并用温度计测量盐酸的温度,记录。 把温度计上的酸用水冲洗干净。c、用另一个量筒量取50mL 0.55mol/L氢氧化钠,并用温度计测量氢氧化钠的温度,记录。 d、把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒在外面),盖好盖板。用环形玻璃搅拌棒轻轻搅动溶液,并准确量取混合溶液的最高温度,记为终止温度,记录。e、重复实验步骤2—4三次如何提高中和热测定的准确度呢?增强保温、隔热措施,减少实验过程中热量的损失。
不断搅动,使热量分散均匀
使用稀酸溶液和稀碱溶液,减少溶解热的干扰
使用强酸和强碱溶液,减少电离热效应的干扰
敞口、针筒、活塞在化学反应过程中放出或吸收的热量恒(等)容过程:反应前后体积不变,压强改变
密闭容器、体积不变容器2、焓变 焓:热力学状态函数。 焓变:在一定条件下(恒压)的反应热
生成物与反应物的焓值差①焓变符号:△H②焓变单位:kJ/mol ③测量条件:恒压下,一般为敞口容器中④“+”:吸热,环境对体系做功自身能量增加
“-”:放热,体系对环境做功自身能量减少3、反应热产生的原因 ①从物质所具有的能量角度 反应物的总能量>生成物的总能量生成物的总能量>反应物的总能量△H>0△H<0放热反应:吸热反应:-183 kJ/mol(理论值)ΔH= -184.6 kJ/mol(实验值)√ΔH=化学键断裂——吸热
化学键形成——放热②从化学键的角度 4、常见吸热反应与放热反应 ①放热反应 放出热量的化学反应。△H 为“-”或△H <0常见放热反应:中和反应
燃烧反应
活泼金属与酸反应
大多数化合反应②吸热反应 吸收热量的化学反应。△H 为“+”或△H >0常见的吸热反应:
大多数分解反应
某些金属氧化物的还原反应
C+CO2 C+H2O
Ba(OH)2·8H2O+NH4Cl 已知拆开1mol H2中的化学键要吸收436 kJ的能量,拆开1mol O2中的化学键要吸收496 kJ的能量,形成水分子中的1mol H—O键要放出463 kJ的能量,试说明 2H2+ O2 = 2H2O中的能量变化。练习△H=-484kJ/mol1、1molC与1molH2O(g)反应生成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。2、拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。 +131.5-92KJ/mol-30.7KJ/mol练 习二、热化学方程式表示参加反应物质的量和反应热的关系的化学方程式。热化学方程式书写要点①需注明反应的温度和压强如在25℃、101KPa下进行的反应,可不注明温度和压强②应注明反应物和生成物的状态气体用g;液体用l;固体用s;溶液用aq2H2(g)+O2(g)=2H2O(g) △H1=-Q1kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-Q2kJ/mol
④化学计量数表示物质的量,而不是分子个数。化学计量数可以是整数,可以是分数。⑤化学计量数与△H成正比,当化学计量数不同时,其△H不同H2(g)+1/2O2(g)=H2O(l),△H=-285.8kJ/mol③右端标注热量数值和符号,
△H:吸热用“+”,放热用:“-”。2H2(g)+O2(g)=2H2O(l),△H=-571.6kJ/mol1、已知在25℃,101kpa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,表示上述反应的热化学方程式正确的是
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g)
ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-5518 kJ·mol-1
C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=+5518 kJ·mol-1
D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1)
ΔH=-48.40 kJ·mol-1
B2、1克甲烷在空气中燃烧,恢复常温下测得放出热量55.625KJ,试写出热化学方式。CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=- 890 kJ/mol3、常温下14克CO在足量氧气中充分燃烧,
放出141.3KJ热量,写出该热化学方程式。CO(g) + 1/2O2(g)=CO2(g) △H=- 282.6 kJ/mol2H2(g)+O2(g)=2H2O(l),△H1=-Q1kJ/mol
H2(g)+1/2O2(g)=H2O(l),△H2=-Q2kJ/mol4、比较Q1和Q2的大小、 △H1和△H2的大小Q1﹥Q2△H1 <△H2注意:热量比较比数值, △H比较带符号 练:⑴比较Q1<Q2的大小、△H1 >△H2的大小S(g)+O2(g)==SO2(g) △H1=- Q1 kJ/mol
S(s)+O2(g)==SO2(g) △H2=- Q2 kJ/molQ1>Q2△H1 <△H2注意:对于可逆反应,
①当反应逆向进行时,其反应热与正反应的数值相等,符号相反。②其反应热是指反应物完全转变成生成物放出或吸收的热量。6、已知:C(s)+O2(g)==CO2(g) △H=-393.5 kJ/mol
要获得1000kg热量,需燃烧多少克碳?30.5g备用:
已知:S(s)+O2(g)=SO2(g) △H=- 290.6 kJ/mol
求1.6g硫燃烧成为SO2气体,放出多少热量?14.53kJ三、中和反应反应热的测定1、中和热酸与碱反应生成1mol H2O时释放的热量称中和热。数值:稀溶液中,强酸和强碱中和时
△H= -57.3kJ/mol2、中和反应反应热的测定 ①原理:Q=mc△t②仪器及药品③实验步骤b、用一个量筒量取50mL 0.5mol/L盐酸, 倒入 小烧杯中,并用温度计测量盐酸的温度,记录。 把温度计上的酸用水冲洗干净。c、用另一个量筒量取50mL 0.55mol/L氢氧化钠,并用温度计测量氢氧化钠的温度,记录。 d、把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒在外面),盖好盖板。用环形玻璃搅拌棒轻轻搅动溶液,并准确量取混合溶液的最高温度,记为终止温度,记录。e、重复实验步骤2—4三次如何提高中和热测定的准确度呢?增强保温、隔热措施,减少实验过程中热量的损失。
不断搅动,使热量分散均匀
使用稀酸溶液和稀碱溶液,减少溶解热的干扰
使用强酸和强碱溶液,减少电离热效应的干扰
