【鲁教版】化学九年级上6.3 大自然中的二氧化碳:(28张PPT)
文档属性
| 名称 | 【鲁教版】化学九年级上6.3 大自然中的二氧化碳:(28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 500.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-08 22:47:29 | ||
图片预览






文档简介
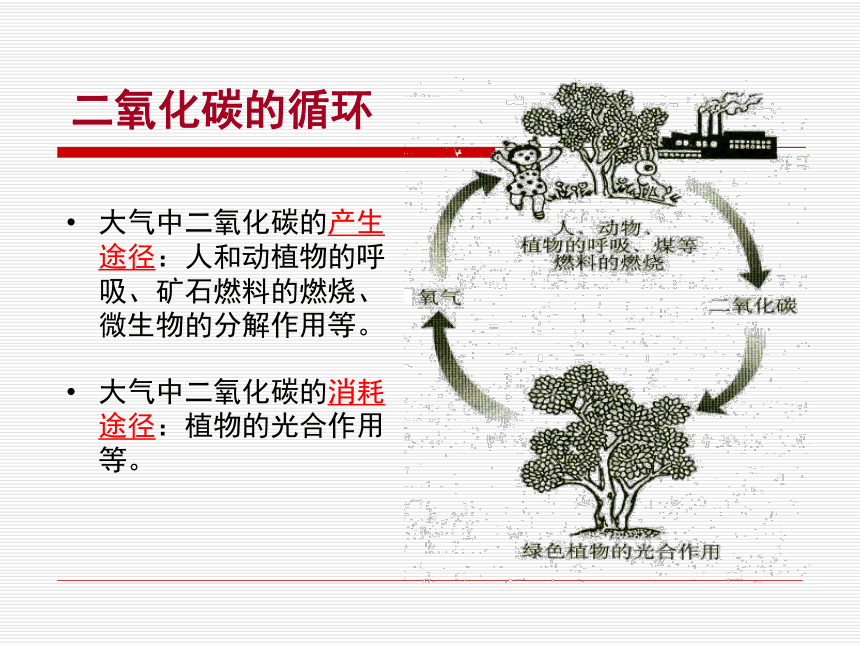
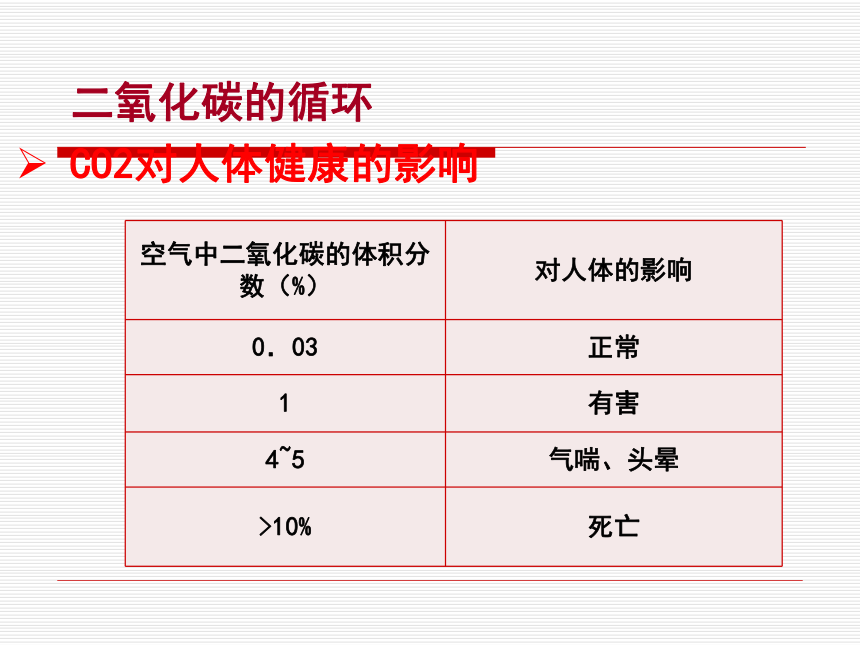
课件28张PPT。第六章 燃烧与燃料6.3 大自然中的二氧化碳二氧化碳的循环大气中二氧化碳的产生途径:人和动植物的呼吸、矿石燃料的燃烧、微生物的分解作用等。大气中二氧化碳的消耗途径:植物的光合作用等。CO2对人体健康的影响 二氧化碳的循环温室效应当大气中的二氧化碳或某些其他气体的含量升高时,会增强大气对太阳光中红外线辐射的吸收,阻止地球表面的热量向外散发,使地球的平均气温上升,这就是所谓的“温室效应”。煤、石油、天然气消耗量急剧增加,向空气中排放大量的二氧化碳,森林遭到破坏,使二氧化碳的吸收量减少,从而造成空气中的二氧化碳含量不断上升。两极冰川融化,海平面上升淹没部分沿海城市;
土地沙漠化,农业减产。减少煤、石油、天然气等化石原料的燃烧;
开发新能源,利用太阳能、风能、地热能等;
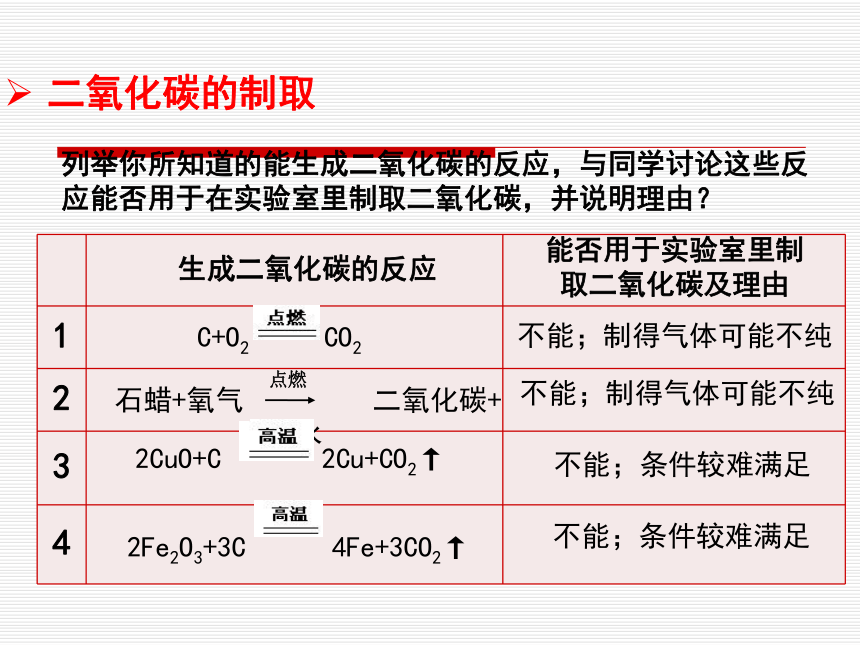
大力植树造林,严禁乱砍滥伐森林。二氧化碳的循环CO2的物理性质二氧化碳的性质及制取CO2的化学性质一般情况下, 二氧化碳不能燃烧,也不支持燃烧。二氧化碳不能供给呼吸。二氧化碳能使澄清的石灰水变浑浊。二氧化碳能和水反应生成碳酸。CO2 + H2O = H2CO3CO2 + Ca(OH)2 = CaCO3 ↓+ H2O二氧化碳的性质及制取?CO2的用途:灭火工业原料人工降雨气体肥料二氧化碳的性质和制取不能燃烧,也不支持燃烧且密度比空气大用CO2、H2O、Nacl制作纯碱干冰升华吸热能够参与光合作用二氧化碳的制取石蜡+氧气 二氧化碳+水不能;制得气体可能不纯不能;制得气体可能不纯不能;条件较难满足不能;条件较难满足生成二氧化碳的反应能否用于实验室里制取二氧化碳及理由点燃列举你所知道的能生成二氧化碳的反应,与同学讨论这些反应能否用于在实验室里制取二氧化碳,并说明理由?实验室制二氧化碳的理想原料可供选择的原料有:
石灰石(主要成分CaCO3)
碳酸钠粉末(Na2CO3)
稀盐酸(有效成分HCl)
稀硫酸(有效成分H2SO4) 注意事项:
(1)注意仪器的使用和药品的取用
(2)重点比较反应速率的快慢二氧化碳的制取选用的药品有大量气泡产生,反应剧烈 有大量气泡产生,反应剧烈 反应速率太快,不易收集 反应速率太快,不易收集 产生气泡速率比较适中 适合实验室制取二氧化碳气体有气泡产生,会减慢,停止 反应速率慢,不易收集 二氧化碳的制取 ① ② ③ ④ 注意:①将半药匙碳酸钠、两至三粒石灰石分别放入四支试管中;③观察的重点是比较四个反应中的稀盐酸或稀硫酸;②向四支试管中分别倒入1/5试管气泡产生的快慢。反应原理的选择二氧化碳的制取实验室制取二氧化碳的反应原理●药 品●化学方程式CaCO3+2HCl=CaCl2+H2CO3H2CO3=H2O+CO2↑H2CO3石灰石(大理石)稀盐酸主要成分主要成分CaCO3HClCaCO3+2HCl = CaCl2+H2O+CO2↑↑二氧化碳的制取稀硫酸与大理石(或石灰石)反应现象分析刚开始有大量气泡产生,一时间后,气泡逐渐
减少 ,反应逐渐停止。虽然该反应能生成二氧化碳:
CaCO3+H2SO4==CaSO4+H2O+CO2
但生成的CaSO4微溶于水,覆盖在大理石表面,
形成一层薄膜,使大理石与酸不能接触,反应难
以进行。结论实验室制取二氧化碳能不能用稀硫酸代替稀盐酸
二氧化碳的制取稀盐酸与碳酸钠粉未反应现象分析结论反应非常剧烈,短时间产生大量气泡碳酸钠粉未的表面积很大,与盐酸接触面积大,
反应速度很快,不易控制实验室不能用碳酸钠粉未或大理石粉未等粉未状
物质制取二氧化碳该反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2二氧化碳的制取实验室制取二氧化碳能不能用浓盐酸代替稀盐酸?不能。因为浓盐酸有强烈的挥发性,会挥发出氯化氢气体,使制得的二氧化碳不纯。二氧化碳的制取●确定二氧化碳气体发生装置应考虑的因素?反应物的状态反应发生条件固体—液体不需要加热●确定二氧化碳气体收集装置应考虑的因素?二氧化碳的密度二氧化碳的溶解性二氧化碳能否与水反应密度比空气大能溶于水能与水反应二氧化碳的制取实验室制取二氧化碳的几种简易装置:二氧化碳的制取注意事项:
长颈漏斗必须液封
导管应在橡皮塞下少许
导管应接近集气瓶底部防止气体从长颈漏斗口逸出便于排出气体能充分排走集气瓶中的空气?目的:二氧化碳的制取实验室制取二氧化碳的装置长颈漏斗伸入液面以下导气管不能伸入液面以下二氧化碳的制取装置气密性的检查方法:1、关闭止水夹;2、从长颈漏斗向锥形瓶中加水,至水面没过长颈漏斗下端;3、一段时间后若长颈漏斗中液面不再下降,说明装置气密性良好。二氧化碳的制取操作步骤连接仪器
①检查气密性
②加大理石
③加稀盐酸
④收集气体
⑤二氧化碳的制取关于收集较纯的二氧化碳的处理 二氧化碳的制取检验方法验满方法澄清石灰水
变浑浊火焰熄灭CO2的验证方法和验满方法氧气、二氧化碳实验室制法的比较
制O2
制
CO2发生装置收集装置反应物状态反应条件固+液不需加热固加热固+液不需加热CaCO3+2HCl==
CaCl2+H2O+CO2↑气体密度气体溶解性比空气略大微溶于水比空气大能溶于水且能与水反应向上排空气法不适宜用排水法装置图实验室制取气体的装置由哪几部分组成?两部分装置:
一、发生装置
二、收集装置实验室制取气体的一般思路和实验装置发生装置的确定需考虑的因素:
1、反应物的状态(如液态、固态)
2、反应条件(如加热,不加热)反应物是固体且需加热反应物有两种(固体+液体)且不需加热实验室制取气体的一般思路和实验装置收集气体一般有两种:
排空气法(1)向上排空气法(2)向下排空气法
排水法确定收集装置时主要应以两个物理性质方面去考虑(1)气体的密度与空气密度比较
(2)气体在水中的溶解性 空气的平均相对分子质量为29.如果某气体的相对分子质量大于29,则这种气体的密度比空气的密度大;如果小于29,则这种气体的密度比空气的密度小.实验室制取气体的一般思路和实验装置实验室制取气体的装置气体发生装置气体收集装置反应物的状态固体和固体反应固体和液体反应液体和液体反应反应条件(是否需要加热、加催化剂等)。。。排空气法密度比空气的大——向上排空气法密度比空气的小——向下排空气法排水法(不易溶于水、不与水发生反应)实验室制取气体的一般思路和实验装置
土地沙漠化,农业减产。减少煤、石油、天然气等化石原料的燃烧;
开发新能源,利用太阳能、风能、地热能等;
大力植树造林,严禁乱砍滥伐森林。二氧化碳的循环CO2的物理性质二氧化碳的性质及制取CO2的化学性质一般情况下, 二氧化碳不能燃烧,也不支持燃烧。二氧化碳不能供给呼吸。二氧化碳能使澄清的石灰水变浑浊。二氧化碳能和水反应生成碳酸。CO2 + H2O = H2CO3CO2 + Ca(OH)2 = CaCO3 ↓+ H2O二氧化碳的性质及制取?CO2的用途:灭火工业原料人工降雨气体肥料二氧化碳的性质和制取不能燃烧,也不支持燃烧且密度比空气大用CO2、H2O、Nacl制作纯碱干冰升华吸热能够参与光合作用二氧化碳的制取石蜡+氧气 二氧化碳+水不能;制得气体可能不纯不能;制得气体可能不纯不能;条件较难满足不能;条件较难满足生成二氧化碳的反应能否用于实验室里制取二氧化碳及理由点燃列举你所知道的能生成二氧化碳的反应,与同学讨论这些反应能否用于在实验室里制取二氧化碳,并说明理由?实验室制二氧化碳的理想原料可供选择的原料有:
石灰石(主要成分CaCO3)
碳酸钠粉末(Na2CO3)
稀盐酸(有效成分HCl)
稀硫酸(有效成分H2SO4) 注意事项:
(1)注意仪器的使用和药品的取用
(2)重点比较反应速率的快慢二氧化碳的制取选用的药品有大量气泡产生,反应剧烈 有大量气泡产生,反应剧烈 反应速率太快,不易收集 反应速率太快,不易收集 产生气泡速率比较适中 适合实验室制取二氧化碳气体有气泡产生,会减慢,停止 反应速率慢,不易收集 二氧化碳的制取 ① ② ③ ④ 注意:①将半药匙碳酸钠、两至三粒石灰石分别放入四支试管中;③观察的重点是比较四个反应中的稀盐酸或稀硫酸;②向四支试管中分别倒入1/5试管气泡产生的快慢。反应原理的选择二氧化碳的制取实验室制取二氧化碳的反应原理●药 品●化学方程式CaCO3+2HCl=CaCl2+H2CO3H2CO3=H2O+CO2↑H2CO3石灰石(大理石)稀盐酸主要成分主要成分CaCO3HClCaCO3+2HCl = CaCl2+H2O+CO2↑↑二氧化碳的制取稀硫酸与大理石(或石灰石)反应现象分析刚开始有大量气泡产生,一时间后,气泡逐渐
减少 ,反应逐渐停止。虽然该反应能生成二氧化碳:
CaCO3+H2SO4==CaSO4+H2O+CO2
但生成的CaSO4微溶于水,覆盖在大理石表面,
形成一层薄膜,使大理石与酸不能接触,反应难
以进行。结论实验室制取二氧化碳能不能用稀硫酸代替稀盐酸
二氧化碳的制取稀盐酸与碳酸钠粉未反应现象分析结论反应非常剧烈,短时间产生大量气泡碳酸钠粉未的表面积很大,与盐酸接触面积大,
反应速度很快,不易控制实验室不能用碳酸钠粉未或大理石粉未等粉未状
物质制取二氧化碳该反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2二氧化碳的制取实验室制取二氧化碳能不能用浓盐酸代替稀盐酸?不能。因为浓盐酸有强烈的挥发性,会挥发出氯化氢气体,使制得的二氧化碳不纯。二氧化碳的制取●确定二氧化碳气体发生装置应考虑的因素?反应物的状态反应发生条件固体—液体不需要加热●确定二氧化碳气体收集装置应考虑的因素?二氧化碳的密度二氧化碳的溶解性二氧化碳能否与水反应密度比空气大能溶于水能与水反应二氧化碳的制取实验室制取二氧化碳的几种简易装置:二氧化碳的制取注意事项:
长颈漏斗必须液封
导管应在橡皮塞下少许
导管应接近集气瓶底部防止气体从长颈漏斗口逸出便于排出气体能充分排走集气瓶中的空气?目的:二氧化碳的制取实验室制取二氧化碳的装置长颈漏斗伸入液面以下导气管不能伸入液面以下二氧化碳的制取装置气密性的检查方法:1、关闭止水夹;2、从长颈漏斗向锥形瓶中加水,至水面没过长颈漏斗下端;3、一段时间后若长颈漏斗中液面不再下降,说明装置气密性良好。二氧化碳的制取操作步骤连接仪器
①检查气密性
②加大理石
③加稀盐酸
④收集气体
⑤二氧化碳的制取关于收集较纯的二氧化碳的处理 二氧化碳的制取检验方法验满方法澄清石灰水
变浑浊火焰熄灭CO2的验证方法和验满方法氧气、二氧化碳实验室制法的比较
制O2
制
CO2发生装置收集装置反应物状态反应条件固+液不需加热固加热固+液不需加热CaCO3+2HCl==
CaCl2+H2O+CO2↑气体密度气体溶解性比空气略大微溶于水比空气大能溶于水且能与水反应向上排空气法不适宜用排水法装置图实验室制取气体的装置由哪几部分组成?两部分装置:
一、发生装置
二、收集装置实验室制取气体的一般思路和实验装置发生装置的确定需考虑的因素:
1、反应物的状态(如液态、固态)
2、反应条件(如加热,不加热)反应物是固体且需加热反应物有两种(固体+液体)且不需加热实验室制取气体的一般思路和实验装置收集气体一般有两种:
排空气法(1)向上排空气法(2)向下排空气法
排水法确定收集装置时主要应以两个物理性质方面去考虑(1)气体的密度与空气密度比较
(2)气体在水中的溶解性 空气的平均相对分子质量为29.如果某气体的相对分子质量大于29,则这种气体的密度比空气的密度大;如果小于29,则这种气体的密度比空气的密度小.实验室制取气体的一般思路和实验装置实验室制取气体的装置气体发生装置气体收集装置反应物的状态固体和固体反应固体和液体反应液体和液体反应反应条件(是否需要加热、加催化剂等)。。。排空气法密度比空气的大——向上排空气法密度比空气的小——向下排空气法排水法(不易溶于水、不与水发生反应)实验室制取气体的一般思路和实验装置
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
