【科粤版】化学九年级上课件2.2 构成物质的微粒(Ⅰ)—分子 2.3构成物质的微粒—原子和离子(Ⅱ)
文档属性
| 名称 | 【科粤版】化学九年级上课件2.2 构成物质的微粒(Ⅰ)—分子 2.3构成物质的微粒—原子和离子(Ⅱ) |  | |
| 格式 | zip | ||
| 文件大小 | 746.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-09 16:12:38 | ||
图片预览









文档简介
课件32张PPT。2.2 构成物质的微粒(Ⅰ)—分子
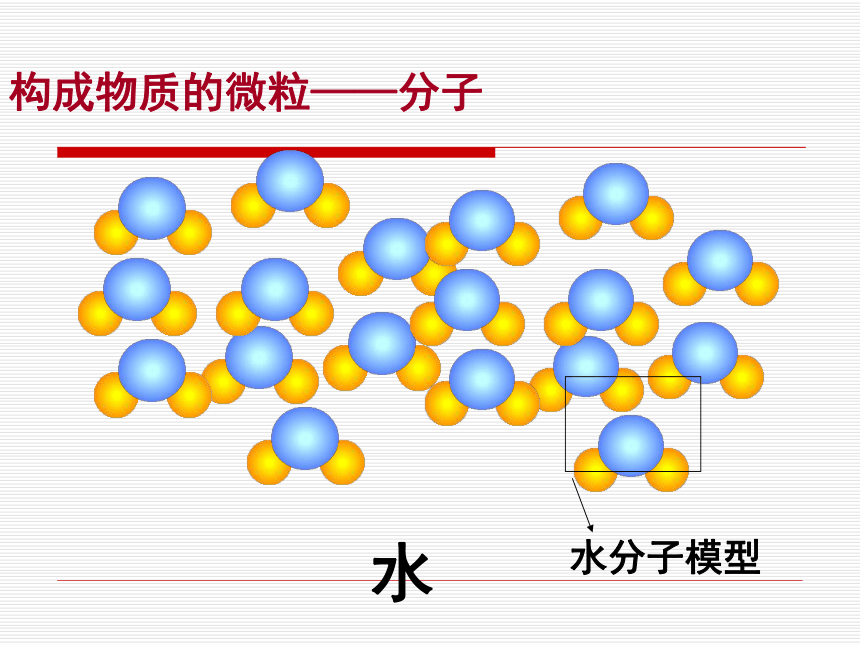
2.3构成物质的微粒(Ⅱ)——原子和离子第二章 空气、物质的构成 如果我们把看的见的水想象成是由很多很多小到肉眼看不见的微粒聚集而成的,当水受热时,就会分散开来成为一个一个的微粒,我们称这种微粒为水分子,分子很小,是肉眼看不见的,所以我们就看不见了。当遇冷的时候,一个一个水分子又聚集在一起,聚集的多了我们又看到了液体状态的水。构成物质的微粒——分子分子的定义:
由分子构成的物质,分子是保持物质化学性质的最小粒子。注意:1、是对于由分子构成的物质来说的。 2、分子只能保持物质的化学性质,不能保持
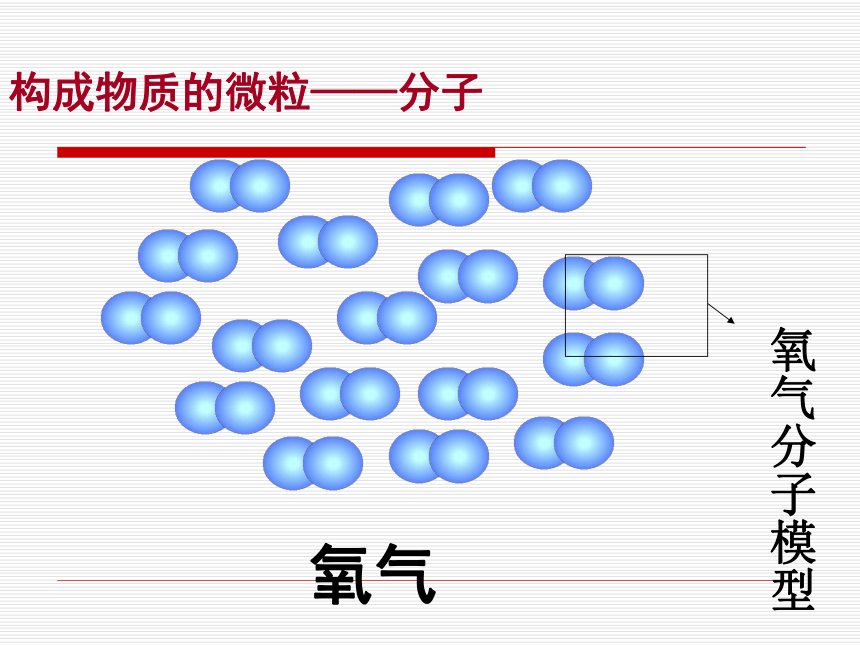
物质的物理性质。构成物质的微粒——分子水构成物质的微粒——分子氧气构成物质的微粒——分子用扫描隧道显微镜放大几百万倍获得的苯分子的图像分子的性质分子的质量和体积都很小构成物质的微粒——分子一滴水中有1.67×1021个水分子,即:1670000000000000000000个一个水分子的质量是3×10-26千克,即0.00000000000000000000000003kg如果10亿人都来数一滴水中的水分子,每人每分钟数100个,24小时不停的数,需要数多少年?三万多年分子的性质分子的质量和体积都很小构成物质的微粒——分子这个实验说明了分子具有什么性质?分子的性质分子间有间隙构成物质的微粒——分子固体液体气体气体分子
间的间隔>液体分子
间的间隔固体分子
间的间隔>分子的性质分子间有间隙构成物质的微粒——分子品红分子在冷水和热水中的运动情况分子的性质分子总是在不断运动着构成物质的微粒——分子分子
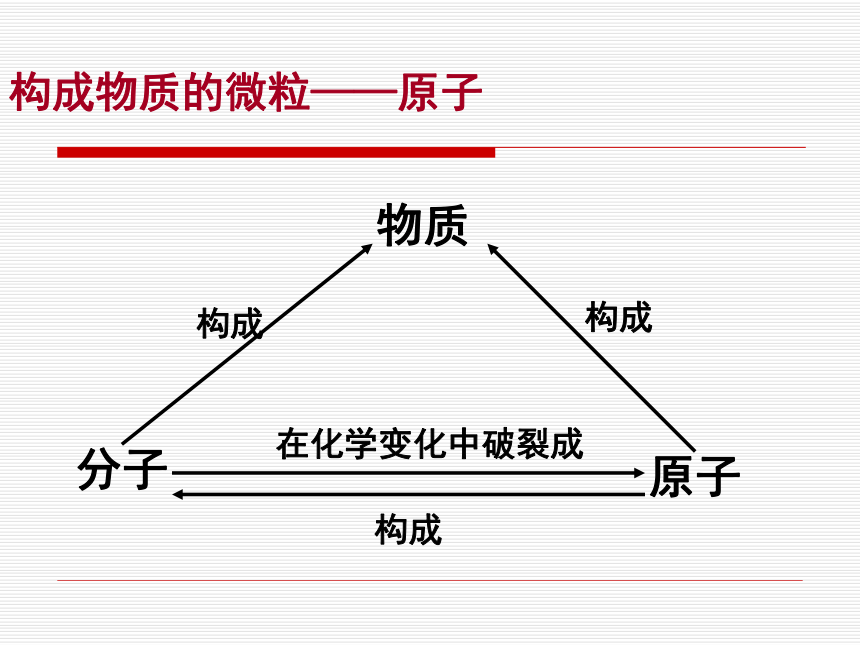
原子
构成在化学变化中破裂成物质
构成构成构成物质的微粒——原子原子的概念原子是化学变化中的最小粒子
注意:化学反应前后原子的种类和 数目不变
构成物质的微粒——原子原子与分子的关系构成物质的微粒——原子原子的构成构成物质的微粒——原子质子、中子、电子的电性和电量
1个电子带一个单位负电荷中子不带电1个质子带一个单位正电荷构成物质的微粒——原子原子电性 原子是否显电性?
核内电子数=核电荷数=核外质子数不显电性构成物质的微粒——原子构成原子的粒子及其性质构成物质的微粒——原子质子带正电,中子不带电,电子带负电。
质子和中子的质量很小,但比电子大很多。
中子不带电,所以原子核的电性由质子决定,因此原子核带正电,数目跟质子相等。总结:构成物质的微粒——原子不同种类的原子,质子数、电子数不同质子数=核外电子数=核电荷数=原子序数不是所有原子都有中子原子的结构几种常见原子的构成注意:原子核外电子排布规律
没有固定的轨道,但有经常出现区域;
核外电子是分层排布的;1 2 3 4 5 6 7;
离核越近能量越低;
最外层电子最多不超过8个电子(只有1层的不超过2个电子)。构成物质的微粒——原子原子结构示意图+826原子核电子层核内质子数电子层上的电子个数构成物质的微粒——原子稀有气体元素的原子结构HeNe特点:
最外层电子数8个(氦2个)达到稳定状态构成物质的微粒——原子金属元素的原子结构LiBeMgAl特点:
最外层电子数一般少于4个,在化学变化中容易失去电子。构成物质的微粒——原子非金属元素的原子结构HBFCNO特点:
最外层电子数一般大于等于4个,在化学变化中容易得到电子。构成物质的微粒——原子元素的化学性质与原子最外层电子数的关系构成物质的微粒——原子注意:元素的化学性质决定于其原子的最外层电子数。
元素的种类决定于其原子的核电荷数(或质子数)。
原子的质量(或相对原子质量)决定于原子核(或质子数和中子数)。构成物质的微粒——原子
质量数 ——
核电荷数 ——
(核内质子数)
——元素符号例如:表示原子组成的一种方法构成物质的微粒——原子离子的概念
带电荷的原子或原子团。
离子的分类:
阳离子:带正电荷 如
阴离子:带负电荷 如构成物质的微粒——离子离子的形成构成物质的微粒——离子阳离子:质子数 〉核外电子数
阴离子:质子数〈 核外电子数
质量数:
原子核中质子数和中子数之和叫质量数。
质量数(A)= 质子数(Z)+ 中子数(N)
离子质子数与核外电子数之间的关系构成物质的微粒——离子质量数(A)=质子数(Z)+中子数(N)
原子 ::核电荷数=质子数=核外电子数
阳离子 :核电荷数=质子数>核外电子数
核外电子数=a-m
阴离子 :核电荷数=质子数<核外电子数,
核外电子数=b+n
总结原子种类不同,质子数也不同。
核电荷数=质子数=核外电子数。
原子是由质子、中子、电子三中粒子构成,但不是所有的原子核内都有中子。
氢原子中没有中子。
在原子中质子数等于电子数,但质子数不一定等于中子数。
原子很小,但有一定质量,原子的质量主要集中在原子核上。
总结
2.3构成物质的微粒(Ⅱ)——原子和离子第二章 空气、物质的构成 如果我们把看的见的水想象成是由很多很多小到肉眼看不见的微粒聚集而成的,当水受热时,就会分散开来成为一个一个的微粒,我们称这种微粒为水分子,分子很小,是肉眼看不见的,所以我们就看不见了。当遇冷的时候,一个一个水分子又聚集在一起,聚集的多了我们又看到了液体状态的水。构成物质的微粒——分子分子的定义:
由分子构成的物质,分子是保持物质化学性质的最小粒子。注意:1、是对于由分子构成的物质来说的。 2、分子只能保持物质的化学性质,不能保持
物质的物理性质。构成物质的微粒——分子水构成物质的微粒——分子氧气构成物质的微粒——分子用扫描隧道显微镜放大几百万倍获得的苯分子的图像分子的性质分子的质量和体积都很小构成物质的微粒——分子一滴水中有1.67×1021个水分子,即:1670000000000000000000个一个水分子的质量是3×10-26千克,即0.00000000000000000000000003kg如果10亿人都来数一滴水中的水分子,每人每分钟数100个,24小时不停的数,需要数多少年?三万多年分子的性质分子的质量和体积都很小构成物质的微粒——分子这个实验说明了分子具有什么性质?分子的性质分子间有间隙构成物质的微粒——分子固体液体气体气体分子
间的间隔>液体分子
间的间隔固体分子
间的间隔>分子的性质分子间有间隙构成物质的微粒——分子品红分子在冷水和热水中的运动情况分子的性质分子总是在不断运动着构成物质的微粒——分子分子
原子
构成在化学变化中破裂成物质
构成构成构成物质的微粒——原子原子的概念原子是化学变化中的最小粒子
注意:化学反应前后原子的种类和 数目不变
构成物质的微粒——原子原子与分子的关系构成物质的微粒——原子原子的构成构成物质的微粒——原子质子、中子、电子的电性和电量
1个电子带一个单位负电荷中子不带电1个质子带一个单位正电荷构成物质的微粒——原子原子电性 原子是否显电性?
核内电子数=核电荷数=核外质子数不显电性构成物质的微粒——原子构成原子的粒子及其性质构成物质的微粒——原子质子带正电,中子不带电,电子带负电。
质子和中子的质量很小,但比电子大很多。
中子不带电,所以原子核的电性由质子决定,因此原子核带正电,数目跟质子相等。总结:构成物质的微粒——原子不同种类的原子,质子数、电子数不同质子数=核外电子数=核电荷数=原子序数不是所有原子都有中子原子的结构几种常见原子的构成注意:原子核外电子排布规律
没有固定的轨道,但有经常出现区域;
核外电子是分层排布的;1 2 3 4 5 6 7;
离核越近能量越低;
最外层电子最多不超过8个电子(只有1层的不超过2个电子)。构成物质的微粒——原子原子结构示意图+826原子核电子层核内质子数电子层上的电子个数构成物质的微粒——原子稀有气体元素的原子结构HeNe特点:
最外层电子数8个(氦2个)达到稳定状态构成物质的微粒——原子金属元素的原子结构LiBeMgAl特点:
最外层电子数一般少于4个,在化学变化中容易失去电子。构成物质的微粒——原子非金属元素的原子结构HBFCNO特点:
最外层电子数一般大于等于4个,在化学变化中容易得到电子。构成物质的微粒——原子元素的化学性质与原子最外层电子数的关系构成物质的微粒——原子注意:元素的化学性质决定于其原子的最外层电子数。
元素的种类决定于其原子的核电荷数(或质子数)。
原子的质量(或相对原子质量)决定于原子核(或质子数和中子数)。构成物质的微粒——原子
质量数 ——
核电荷数 ——
(核内质子数)
——元素符号例如:表示原子组成的一种方法构成物质的微粒——原子离子的概念
带电荷的原子或原子团。
离子的分类:
阳离子:带正电荷 如
阴离子:带负电荷 如构成物质的微粒——离子离子的形成构成物质的微粒——离子阳离子:质子数 〉核外电子数
阴离子:质子数〈 核外电子数
质量数:
原子核中质子数和中子数之和叫质量数。
质量数(A)= 质子数(Z)+ 中子数(N)
离子质子数与核外电子数之间的关系构成物质的微粒——离子质量数(A)=质子数(Z)+中子数(N)
原子 ::核电荷数=质子数=核外电子数
阳离子 :核电荷数=质子数>核外电子数
核外电子数=a-m
阴离子 :核电荷数=质子数<核外电子数,
核外电子数=b+n
总结原子种类不同,质子数也不同。
核电荷数=质子数=核外电子数。
原子是由质子、中子、电子三中粒子构成,但不是所有的原子核内都有中子。
氢原子中没有中子。
在原子中质子数等于电子数,但质子数不一定等于中子数。
原子很小,但有一定质量,原子的质量主要集中在原子核上。
总结
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
