【科粤版】化学九年级上课件3.2 制取氧气(24张PPT)
文档属性
| 名称 | 【科粤版】化学九年级上课件3.2 制取氧气(24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 834.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-09 00:00:00 | ||
图片预览








文档简介
课件24张PPT。第三章 维持生命之气—氧气3.2 制取氧气氯酸钾KClO3氯化钾 + 氧气KCl O2 (1)(2)高锰酸钾锰酸钾+二氧化锰+氧气KMnO4过氧化氢水 + 氧气H2O2 H2O O2(3)K2MnO4 MnO2 O2
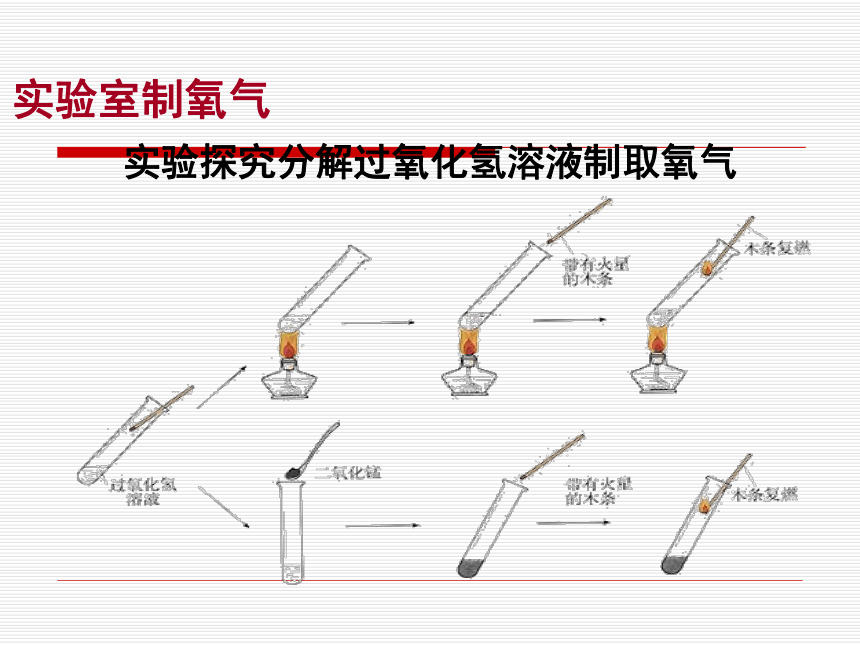
实验室制氧气实验室制取氧气有哪些反应实验探究分解过氧化氢溶液制取氧气探究问题:
不加热双氧水时,带火星的木条是否复燃
加热双氧水时,带火星的木条是否复燃
不加热,但在双氧水中加入二氧化锰时,是否复燃实验室制氧气实验探究分解过氧化氢溶液制取氧气实验室制氧气分解过氧化氢制取氧气装 置 图实验室制氧气固液常温型发生装置发生装置选择的依据:
反应物状态:
反应条件:固态和液态
不需加热分解过氧化氢制取氧气实验室制氧气收集装置选择的依据:不易溶于水且不与水反应的气体密度比空气大的气体且不与空气中气体反应密度比空气小的气体且不与空气中气体反应√√排水集气法向上排空气法向下排空气法要考虑气体的
溶解性
是否与水反应;
气体密度
与空气成分是否反应(制得的氧气较纯)(制得的氧气干燥)分解过氧化氢制取氧气收集装置实验室制氧气加热高锰酸钾或氯酸钾制取氧气装 置 图实验室制氧气发生装置选择的依据:固固加热型反应物为固态
反应条件需加热加热高锰酸钾制取氧气发生装置实验室制氧气检查装置的气密性:将带有导管的单孔胶塞塞紧试管,先将导管另一端放入水中,然后用手紧握试管,若导管口有气泡冒出,松开手后水倒流,导管内上升一段水柱,则说明装置的气密性好操作注意事项(加热前准备事项)加热高锰酸钾制取氧气实验操作实验室制氧气加热高锰酸钾制取氧气操作注意事项(加热前准备事项)实验室制氧气收(气泡连续均匀冒出时开始收集)点(酒精灯加热药品,利用外焰加热)加热高锰酸钾制取氧气操作注意事项(加热前准备事项)实验室制氧气移(导管移出水槽)熄(熄灭酒精灯)防止水槽里的水倒流到试管底部,导致试管炸裂。加热高锰酸钾制取氧气操作注意事项(加热前准备事项)实验室制氧气查(装置气密性)
装(装药品,塞紧单孔塞)
定(固定试管,先下后上、先左后右)
点(酒精灯加热药品)
收(气泡连续均匀冒出时开始收集)
移(导管出水槽)
熄(灭酒精灯)加热高锰酸钾制取氧气实验室制取氧气的步骤实验室制氧气装置图过氧化氢溶液和二氧化锰KMnO4氯酸钾和二氧化锰KClO3MnO2实验室制氧气发生装置固固加热型(1)氯酸钾和二氧化锰
(2)高锰酸钾反应物为固态,反应条件需加热固液常温型(3)过氧化氢溶液和二氧化锰反应物为固态和液态,
反应条件不需加热实验室制氧气不易溶于水且不与水反应的气体密度比空气大的气体且不与空气中气体反应密度比空气小的气体且不与空气中气体反应排水集气法向上排空气法向下排空气法要考虑气体的溶解性及是否与水反应;
气体密度及与空气成分是否反应收集装置实验室制氧气过氧化氢水 + 氧气H2O2 H2O + O2催化剂和催化作用在化学反应中能改变其他物质的化学反应的速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫催化剂(又叫触媒)。(1)改变的只是化学反应速率,效果可加快或减慢。(2)本身的化学性质在反应前后保持不变,但物理性质有可能改变。(3)催化剂要针对某个具体反应而言。如不能单独说二氧化锰是催化剂;二氧化锰在氯酸钾分解实验中是催化剂,但不是所有化学反应的催化剂。注意:催化剂和催化作用由一种物质生成两种或两种以上其它物质的反应,叫做分解反应。它是化学反应的基本类型。氯酸钾 氯酸钾+氧气高锰酸钾 锰酸钾+二氧化锰+氧气特点: 表示:一变多分解反应分解反应概念 由一种反应物生成两种或两种以上其他物质的反应,叫做分解反应化合反应 由两种或两种以上物质生成另一种物质的反应,叫做化合反应特点 “一变多”的化学反应 X→ A + B + … “多变一”的化学反应C+ D + … → Y联系两者都是化学反应的基本类型之一分解反应与化合反应的区别和联系工业制氧气分离液态空气的方法(物理变化)
原理:在低温条件下加压,使空气转变为液态空气,然后蒸发。由于液态氮的沸点比液态氧的沸点低,因此氮气首先从液态空气中蒸发出来,剩下的主要就是液态氧。
降温 蒸发
方法:纯净的空气 液态空气
加压 -196℃
氮气
升温至-183℃
液态氧 氧气工业制氧气分离液态空气的方法工业制氧气膜分离技术法原理:利用膜分离技术分离空气中的氧气。 方法:
在一定的压力下,让空气通过具有富集功能的薄膜,反复进行多级分离,便可得到含氧气90%以上的富氧空气。
实验室制氧气实验室制取氧气有哪些反应实验探究分解过氧化氢溶液制取氧气探究问题:
不加热双氧水时,带火星的木条是否复燃
加热双氧水时,带火星的木条是否复燃
不加热,但在双氧水中加入二氧化锰时,是否复燃实验室制氧气实验探究分解过氧化氢溶液制取氧气实验室制氧气分解过氧化氢制取氧气装 置 图实验室制氧气固液常温型发生装置发生装置选择的依据:
反应物状态:
反应条件:固态和液态
不需加热分解过氧化氢制取氧气实验室制氧气收集装置选择的依据:不易溶于水且不与水反应的气体密度比空气大的气体且不与空气中气体反应密度比空气小的气体且不与空气中气体反应√√排水集气法向上排空气法向下排空气法要考虑气体的
溶解性
是否与水反应;
气体密度
与空气成分是否反应(制得的氧气较纯)(制得的氧气干燥)分解过氧化氢制取氧气收集装置实验室制氧气加热高锰酸钾或氯酸钾制取氧气装 置 图实验室制氧气发生装置选择的依据:固固加热型反应物为固态
反应条件需加热加热高锰酸钾制取氧气发生装置实验室制氧气检查装置的气密性:将带有导管的单孔胶塞塞紧试管,先将导管另一端放入水中,然后用手紧握试管,若导管口有气泡冒出,松开手后水倒流,导管内上升一段水柱,则说明装置的气密性好操作注意事项(加热前准备事项)加热高锰酸钾制取氧气实验操作实验室制氧气加热高锰酸钾制取氧气操作注意事项(加热前准备事项)实验室制氧气收(气泡连续均匀冒出时开始收集)点(酒精灯加热药品,利用外焰加热)加热高锰酸钾制取氧气操作注意事项(加热前准备事项)实验室制氧气移(导管移出水槽)熄(熄灭酒精灯)防止水槽里的水倒流到试管底部,导致试管炸裂。加热高锰酸钾制取氧气操作注意事项(加热前准备事项)实验室制氧气查(装置气密性)
装(装药品,塞紧单孔塞)
定(固定试管,先下后上、先左后右)
点(酒精灯加热药品)
收(气泡连续均匀冒出时开始收集)
移(导管出水槽)
熄(灭酒精灯)加热高锰酸钾制取氧气实验室制取氧气的步骤实验室制氧气装置图过氧化氢溶液和二氧化锰KMnO4氯酸钾和二氧化锰KClO3MnO2实验室制氧气发生装置固固加热型(1)氯酸钾和二氧化锰
(2)高锰酸钾反应物为固态,反应条件需加热固液常温型(3)过氧化氢溶液和二氧化锰反应物为固态和液态,
反应条件不需加热实验室制氧气不易溶于水且不与水反应的气体密度比空气大的气体且不与空气中气体反应密度比空气小的气体且不与空气中气体反应排水集气法向上排空气法向下排空气法要考虑气体的溶解性及是否与水反应;
气体密度及与空气成分是否反应收集装置实验室制氧气过氧化氢水 + 氧气H2O2 H2O + O2催化剂和催化作用在化学反应中能改变其他物质的化学反应的速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫催化剂(又叫触媒)。(1)改变的只是化学反应速率,效果可加快或减慢。(2)本身的化学性质在反应前后保持不变,但物理性质有可能改变。(3)催化剂要针对某个具体反应而言。如不能单独说二氧化锰是催化剂;二氧化锰在氯酸钾分解实验中是催化剂,但不是所有化学反应的催化剂。注意:催化剂和催化作用由一种物质生成两种或两种以上其它物质的反应,叫做分解反应。它是化学反应的基本类型。氯酸钾 氯酸钾+氧气高锰酸钾 锰酸钾+二氧化锰+氧气特点: 表示:一变多分解反应分解反应概念 由一种反应物生成两种或两种以上其他物质的反应,叫做分解反应化合反应 由两种或两种以上物质生成另一种物质的反应,叫做化合反应特点 “一变多”的化学反应 X→ A + B + … “多变一”的化学反应C+ D + … → Y联系两者都是化学反应的基本类型之一分解反应与化合反应的区别和联系工业制氧气分离液态空气的方法(物理变化)
原理:在低温条件下加压,使空气转变为液态空气,然后蒸发。由于液态氮的沸点比液态氧的沸点低,因此氮气首先从液态空气中蒸发出来,剩下的主要就是液态氧。
降温 蒸发
方法:纯净的空气 液态空气
加压 -196℃
氮气
升温至-183℃
液态氧 氧气工业制氧气分离液态空气的方法工业制氧气膜分离技术法原理:利用膜分离技术分离空气中的氧气。 方法:
在一定的压力下,让空气通过具有富集功能的薄膜,反复进行多级分离,便可得到含氧气90%以上的富氧空气。
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
