京改版化学九年级上册3.3原子核外电子的排布 离子课件 (共24张PPT)
文档属性
| 名称 | 京改版化学九年级上册3.3原子核外电子的排布 离子课件 (共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 595.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-10 21:59:55 | ||
图片预览



文档简介
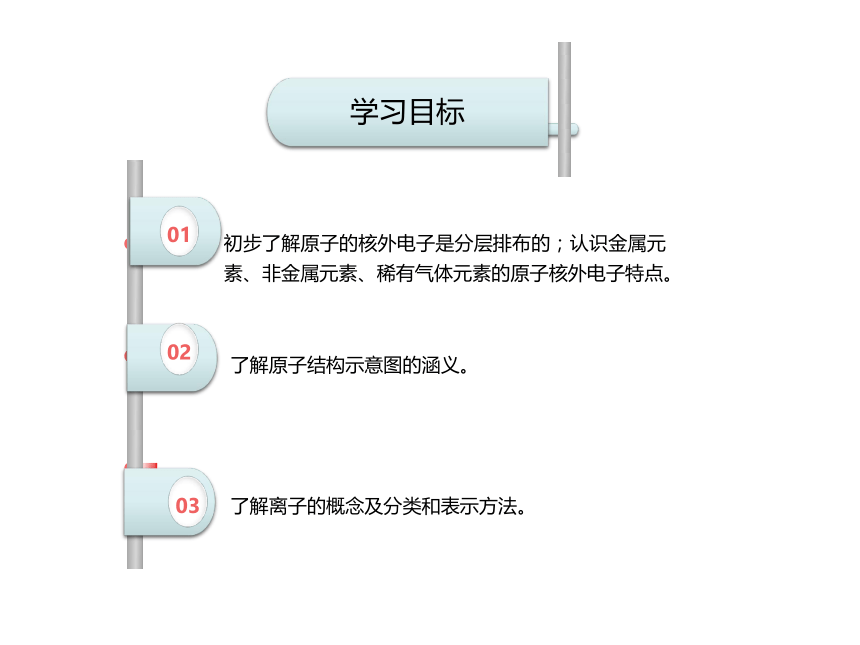
课件24张PPT。3.2 原子核外电子的排布 离子九年级上册 我是一个小小的电子,我在原子里围绕着正中心的原子核不停地高速运动。虽然空间很大,但我和我的同伴总想挣脱原子核的吸引。可是原子核这个小老头很有能耐,虽然只占原子的一丁点空间,里面却由质子和中子构成。中子不带电,质子带正电,正好把我身上的负电深深地吸引… 哎!大家猜一猜,我和我的同伴在原子里是怎样运动的呢? 电子的自白情境导入010203初步了解原子的核外电子是分层排布的;认识金属元素、非金属元素、稀有气体元素的原子核外电子特点。 了解原子结构示意图的涵义。 了解离子的概念及分类和表示方法。学习目标 1. 原子结构图:①圆圈内的数字:表示原子的 ; ②+:表示原子核的 ;③弧线:表示 ;
④弧线上的数字:表示该 。
2. 金属元素的原子最外层电子数一般______个,这些原子在化学反应中较易____电子,通常达到____个电子的稳定结构。
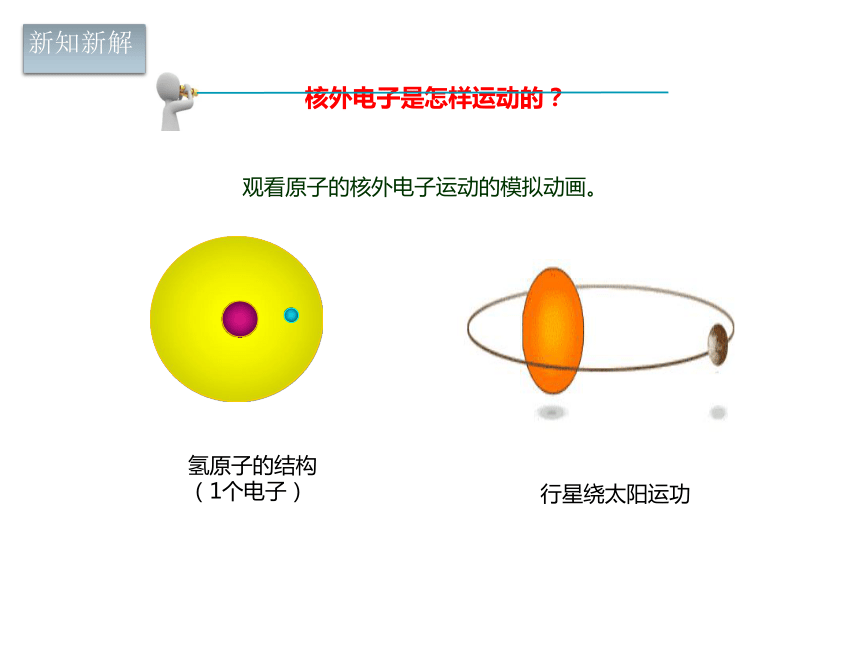
3. 非金属元素的的原子最外层电子数一般_____或 ,这些原子在化学反应中较易_____电子,通常达到____个电子的稳定结构预习检测核外电子是怎样运动的? 观看原子的核外电子运动的模拟动画。氢原子的结构
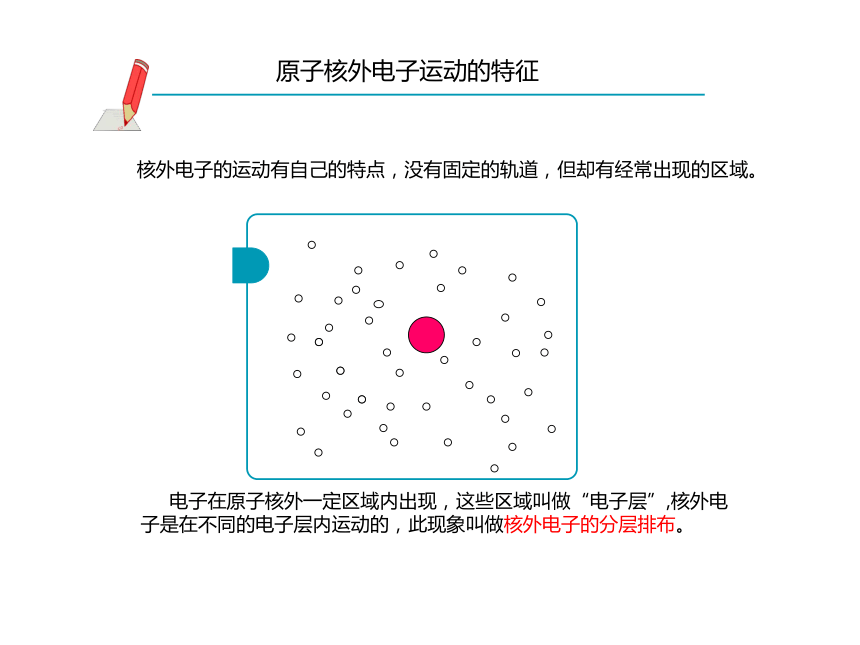
(1个电子)行星绕太阳运功新知新解核外电子的运动有自己的特点,没有固定的轨道,但却有经常出现的区域。
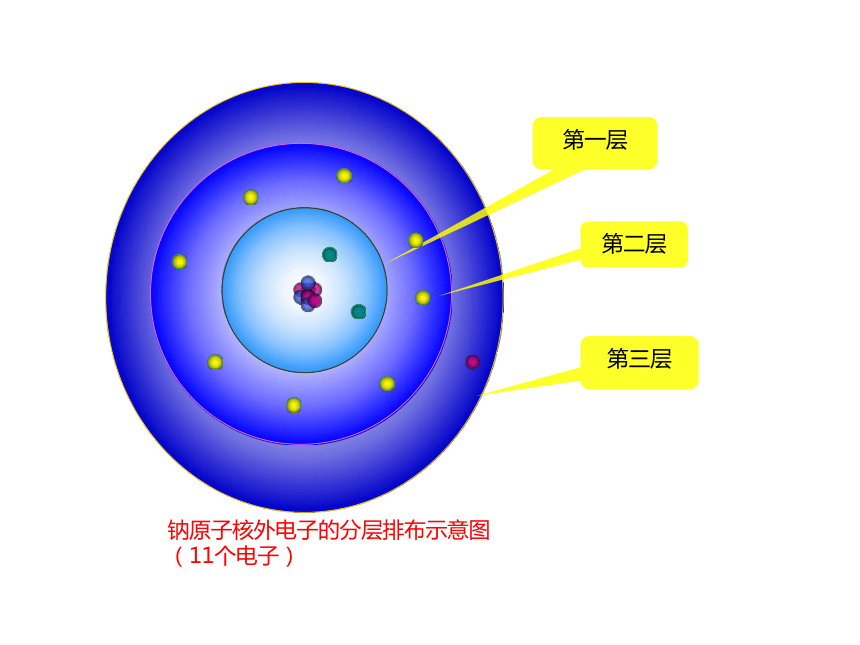
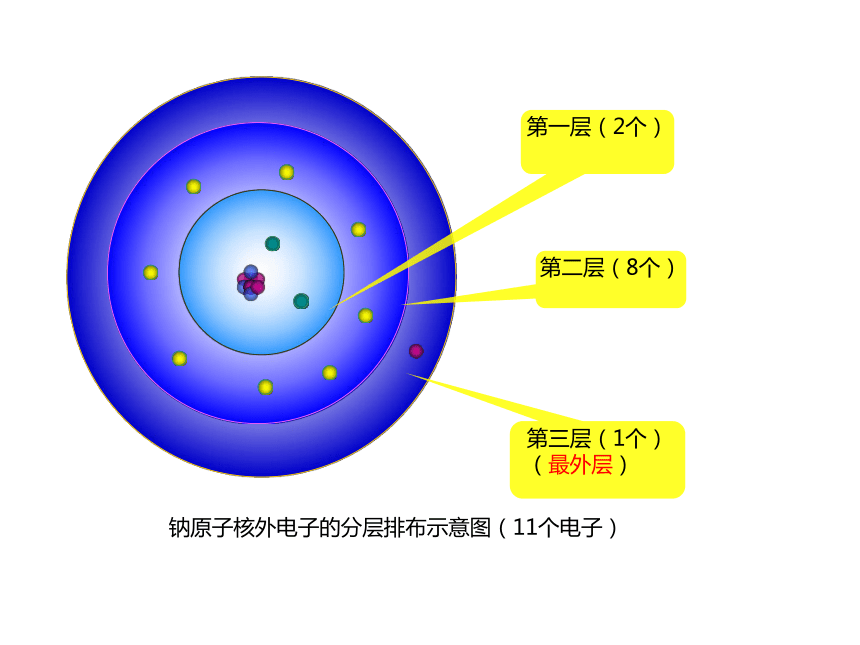
原子核外电子运动的特征 电子在原子核外一定区域内出现,这些区域叫做“电子层”,核外电子是在不同的电子层内运动的,此现象叫做核外电子的分层排布。第一层第二层第三层钠原子核外电子的分层排布示意图
(11个电子)第一层(2个)第二层(8个)第三层(1个)
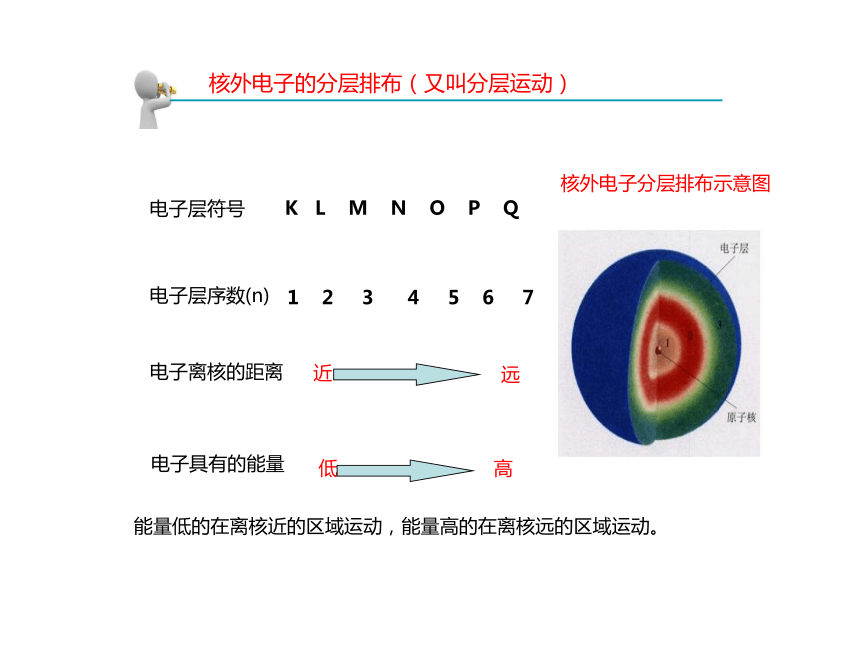
(最外层)钠原子核外电子的分层排布示意图(11个电子)电子层符号K L M N O P Q电子层序数(n)1 2 3 4 5 6 7电子离核的距离电子具有的能量核外电子的分层排布(又叫分层运动)能量低的在离核近的区域运动,能量高的在离核远的区域运动。核外电子分层排布示意图+11电子层原子核质子数各电子层上的电子数质子数带正电最外层电子数 2 8 1原子结构示意图为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种图形。上面的元素的原子结构示意图核外电子排列有什么规律?观察1-18号元素原子结构示意图1、核外电子是分层排布的;2、第一层最多排2个,第二层最多排8个,最外层
不超过8个电子(只有1层的不超过2个电子)。
3、排布时,先排满能量低也就是离核近的电子层,然后再依次往外排在离核较远的电子层。【思考】分析下列原子核外电子排布有什么特点?金属元素的原子最外层电子数一般少于4个非金属元素的原子最外层电子数一般等于或多于4个稀有气体元素的原子最外层电子数一般等于8个金属元素:最外层电子数<4个,易失去电子;
非金属元素:最外层电子数≥4个,易得到电子;
稀有气体:最外层电子数=8个(He为2个),稳定结构。
元素的性质与原子核外最外层电子数的关系【结论】元素的性质,特别是化学性质与原子最外层电子有密切关系。结构性质决定钠在氯气中燃烧 钠原子最外层有1个电子、氯原子最外层有7个电子,最外层都没有达到相对稳定结构,它们发生化学反应时,怎样才能达到相对稳定结构?钠原子氯原子钠+氯气 氯化钠加热 离子的形成NaNa+失去e-ClCl-得到e-钠与氯气反应生成氯化钠的形成过程Na+Cl-e-NaNa+ 失去
1个电子Mg 失去
2个电子Mg2+金属原子 阳离子失去电子钠原子钠离子镁原子镁离子ClS 得到
1个电子Cl - 得到
2个电子S2-氯原子氯离子硫原子硫离子非金属原子 阴离子得到电子例如阳离子:带正电荷的原子或原子团。
阴离子:带负电荷的原子或原子团。
先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面2Mg2+离子定义带电荷的原子或原子团叫做离子。分类写法离子符号意义表示每个镁离子带2个单位的正电荷表示2个镁离子1.某粒子的结构示意图如图所示,则m= , n= ,
x= 。该粒子是 (填粒子的化学符号)2.某粒子的结构示意图如图所示,若该粒子带2个单位负电荷,它的化学符号是 ;若该粒子带2个单位正电荷,它的化学符号是 ;若该粒子不显电性,它的化学符号是 。1628SO2-Mg2+Ne典例探究随堂练习C1.与元素化学性质关系最密切的是原子的 ( )
A.相对原子质量 B.质子数 C.最外层电子数 D.中子数
2.某原子的第一电子层有2个电子,第二电子层有6个电子,它属于( )
A.非金属元素 B.金属元素 C.稀有气体元素 D.无法判断
3.金属元素的原子在化学反应中 ( )
A.易得电子 B.易失电子 C.易导电 D.不易得失电子
AB课堂小结123
④弧线上的数字:表示该 。
2. 金属元素的原子最外层电子数一般______个,这些原子在化学反应中较易____电子,通常达到____个电子的稳定结构。
3. 非金属元素的的原子最外层电子数一般_____或 ,这些原子在化学反应中较易_____电子,通常达到____个电子的稳定结构预习检测核外电子是怎样运动的? 观看原子的核外电子运动的模拟动画。氢原子的结构
(1个电子)行星绕太阳运功新知新解核外电子的运动有自己的特点,没有固定的轨道,但却有经常出现的区域。
原子核外电子运动的特征 电子在原子核外一定区域内出现,这些区域叫做“电子层”,核外电子是在不同的电子层内运动的,此现象叫做核外电子的分层排布。第一层第二层第三层钠原子核外电子的分层排布示意图
(11个电子)第一层(2个)第二层(8个)第三层(1个)
(最外层)钠原子核外电子的分层排布示意图(11个电子)电子层符号K L M N O P Q电子层序数(n)1 2 3 4 5 6 7电子离核的距离电子具有的能量核外电子的分层排布(又叫分层运动)能量低的在离核近的区域运动,能量高的在离核远的区域运动。核外电子分层排布示意图+11电子层原子核质子数各电子层上的电子数质子数带正电最外层电子数 2 8 1原子结构示意图为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种图形。上面的元素的原子结构示意图核外电子排列有什么规律?观察1-18号元素原子结构示意图1、核外电子是分层排布的;2、第一层最多排2个,第二层最多排8个,最外层
不超过8个电子(只有1层的不超过2个电子)。
3、排布时,先排满能量低也就是离核近的电子层,然后再依次往外排在离核较远的电子层。【思考】分析下列原子核外电子排布有什么特点?金属元素的原子最外层电子数一般少于4个非金属元素的原子最外层电子数一般等于或多于4个稀有气体元素的原子最外层电子数一般等于8个金属元素:最外层电子数<4个,易失去电子;
非金属元素:最外层电子数≥4个,易得到电子;
稀有气体:最外层电子数=8个(He为2个),稳定结构。
元素的性质与原子核外最外层电子数的关系【结论】元素的性质,特别是化学性质与原子最外层电子有密切关系。结构性质决定钠在氯气中燃烧 钠原子最外层有1个电子、氯原子最外层有7个电子,最外层都没有达到相对稳定结构,它们发生化学反应时,怎样才能达到相对稳定结构?钠原子氯原子钠+氯气 氯化钠加热 离子的形成NaNa+失去e-ClCl-得到e-钠与氯气反应生成氯化钠的形成过程Na+Cl-e-NaNa+ 失去
1个电子Mg 失去
2个电子Mg2+金属原子 阳离子失去电子钠原子钠离子镁原子镁离子ClS 得到
1个电子Cl - 得到
2个电子S2-氯原子氯离子硫原子硫离子非金属原子 阴离子得到电子例如阳离子:带正电荷的原子或原子团。
阴离子:带负电荷的原子或原子团。
先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面2Mg2+离子定义带电荷的原子或原子团叫做离子。分类写法离子符号意义表示每个镁离子带2个单位的正电荷表示2个镁离子1.某粒子的结构示意图如图所示,则m= , n= ,
x= 。该粒子是 (填粒子的化学符号)2.某粒子的结构示意图如图所示,若该粒子带2个单位负电荷,它的化学符号是 ;若该粒子带2个单位正电荷,它的化学符号是 ;若该粒子不显电性,它的化学符号是 。1628SO2-Mg2+Ne典例探究随堂练习C1.与元素化学性质关系最密切的是原子的 ( )
A.相对原子质量 B.质子数 C.最外层电子数 D.中子数
2.某原子的第一电子层有2个电子,第二电子层有6个电子,它属于( )
A.非金属元素 B.金属元素 C.稀有气体元素 D.无法判断
3.金属元素的原子在化学反应中 ( )
A.易得电子 B.易失电子 C.易导电 D.不易得失电子
AB课堂小结123
同课章节目录
