人教版高一化学必修一教学课件《2.2 离子反应--离子方程式的书写》 (共22张PPT)
文档属性
| 名称 | 人教版高一化学必修一教学课件《2.2 离子反应--离子方程式的书写》 (共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 53.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-10 22:22:08 | ||
图片预览








文档简介
课件22张PPT。第二节 离子反应重点离子方程式的书写化学反应的分类方法一、根据反应物和生成物的类别以及反应前后物质种类的多少二、根据反应中是否有电子的转移三、根据反应中是否有离子参加置换反应、分解反应、化合反应、复分解反应氧化还原反应、非氧化还原反应离子反应、分子间的反应一、电解质和非电解质电解质:在水溶液或熔融状态下能导电的化合物非电解质:在水溶液和熔融状态下都不能导电的化合物2、电解质溶液导电的原因及导电能力——存在自由移动的阴阳离子单位体积内离子数目的多少及所带电荷的高低1、电解质和非电解质铜、汞、干冰、氯化钠晶体、蔗糖是电解质吗?注意:(1)电解质和非电解质的研究范畴:
(2)酸、碱、盐、部分金属氧化物是_电解质___,非金属氧化
物,大部分有机物为_非电解质___。
(3) 将SO3溶于水所形成的溶液能导电,SO3是否为电解质? 电解质和非电解质电解质:凡是在水溶液中或熔融状态下,能导电的化合物。非电解质:凡是在水溶液中和熔融状态下,都不能导电的化合物。凡是在水溶液中或熔融状态下,本身能电离出离子而导电的化合物。凡是在水溶液中和熔融状态下,本身不能电离出离子而导电的化合物。一定要搞清本质!电解质和非电解质讨论一:判断一个物质是否是电解质的依据是什么?问题与讨论讨论二:判断SO2、Cl2、NH3、盐酸是否是电解质?讨论三:电解质在水溶液中和熔融状态下都能导电?讨论四:化合物不是电解质就是非电解质?讨论五:氧化钠溶于水能导电,所以它是电解质。讨论六:固体氯化钠不导电,所以它不是电解质?溶液的导电性溶液导电示意图:定向运动自由移动的离子电解质溶液一定要搞清本质!电离外电场导电问题与讨论溶液的导电性讨论一:不同的电解质溶液导电能力为什么不同?讨论二:离子数目越多导电能力越强?讨论三:非电解质溶液不能导电?讨论四:水溶液能导电一定是把电解质加到水里了?讨论五:导电能力强的溶液里离子数目一定比导电能力
弱的溶液里离子数目多?讨论六:同条件下的电解质溶液导电能力不同,说明什
么问题?如盐酸和醋酸。判断正误:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质
5、BaSO4难溶于水,所以BaSO4是非电解质
6、电解质都能够导电,能导电的物质都是电解质
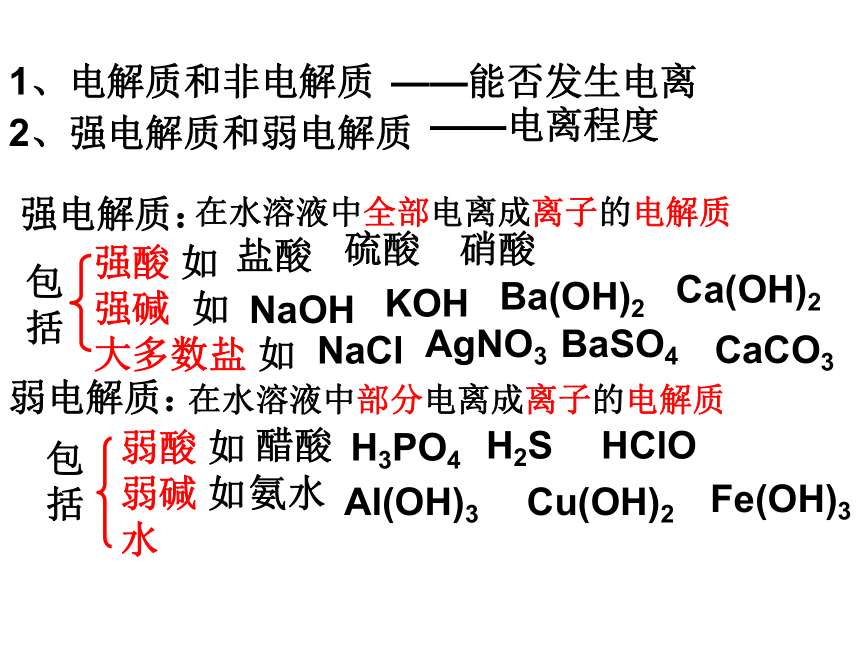
7、非电解质都不能导电,不能导电的物质不一定是非电解质。√XXXXXX2、强电解质和弱电解质强电解质:在水溶液中全部电离成离子的电解质弱电解质:在水溶液中部分电离成离子的电解质包括强酸 如
强碱 如
大多数盐 如 包括弱酸 如
弱碱 如
水盐酸硫酸硝酸NaOHKOHBa(OH)2NaClAgNO3BaSO4醋酸H3PO4H2SHClO氨水Al(OH)3Cu(OH)2Ca(OH)2CaCO3Fe(OH)31、电解质和非电解质——能否发生电离——电离程度强电解质和弱电解质强电解质:能全部电离成离子的电解质。强酸、强碱、大部分盐。弱电解质:能部分电离成离子的电解质。弱酸、弱碱、水。本质区别:是否能完全电离。存在电离平衡。注意区别!强电解质和弱电解质问题与讨论讨论一:强电解质溶液的导电能力一定强?讨论二:难溶物一定是弱电解质?讨论三:强电解质溶液的导电能力一定强于弱电解质?讨论四:同浓度的强电解质溶液的导电能力一定强于弱
电解质溶液的导电能力?讨论五:弱电解质一定不完全电离?练习:
1、下列各项中的物质能导电且属于强电解质的是( )
A、固态氯化镁(MgCl2)
B、液态氯化镁(MgCl2)
C、氨水 D、液态H3PO4
2、NaHSO4溶于水的电离方程式_________,
NaHSO4受热熔化的电离方程式_______。
二、电解质的电离
1、电离条件
(1)离子化合物型电解质电离的条件
① 溶于水(注意:难溶于水的、跟水反应的)
② 受热熔化(注意:受热反应的)
(2)共价化合物型电解质电离的条件
在水作用下
2、电离方程式
完全电离
部分电离
3、电离方程式的书写(1)强电解质——完全电离,用“=”(2)弱电解质——部分电离,用“ ”练习:下列物质中是电解质的写出电离方程式:
H2SO3、HClO、 Cl2、 CH3COOH、 Ba(OH)2、 Cu(OH)2 、 NH3、 NH3·H2O、 KCl、CaCO3、Na2SO4、CO2、
H2O 、KMnO4、H2SO4 、AgNO3、
NaHSO4、NaHCO3、 写出下列物质的电离方程式:
① H2SO4 、② HClO、③Ba(OH)2
④ Cu(OH)2 ⑤ NH3·H2O、 ⑥ KMnO4 、
⑦CaCO3⑧ NaHSO4⑨ NaHCO3 ⑩H2O ① H2SO4 2H++SO42-② HClO H++ClO-③ Ba(OH)2 Ba2++2OH-④ Cu(OH)2 Cu2++2OH-⑤ NH3·H2O NH4++OH-⑥KMnO4 K++MnO4-⑦CaCO3 Ca2++CO32-⑧NaHSO4 Na++H++SO42-⑨ NaHCO3 Na++HCO3-⑩H2O H++OH-我是弱电解质我是强电解质,我更亮!硫酸与氢氧化钡溶液混合改用醋酸与氨水混合做上述实验呢??二、离子反应1、概念:2、判断依据:3、发生的条件:电解质在溶液中进行(有离子参加的反应)(1)沉淀(2)气体(3)难电离物质(弱电解质)(4 )氧化还原反应4、离子方程式:用实际参加反应的离子的符号来表示离子反应的式子,叫离子方程式。电解质在溶液中的反应物质化合物
单质强酸
强碱
盐
弱酸
弱碱
氧化物可溶
微溶
难溶离子化学式强电解质弱电解质离子方程式的书写(1)写(2)改(3)删(4)查——写出化学方程式①易溶于水、易电离物质(强酸、强碱、可溶性盐)——写离子形式
②难溶于水、难电离物质(弱电解质)——写化学式
③单质、气体、氧化物——写化学式——删去方程式两边不参加反应的离子——查原子个数、查电荷离子反应方程式的意义:(1)表示所有同一类型的离子反应。
(2)判断离子能否共存与H+不共存的有①OH-、②弱酸的酸根离子和酸式根离子如CO32-、SO32-、S2-、PO43-、CH3COO-、ClO-
HCO3- 、HS-、HSO3-、HPO42-、H2PO4-与OH-不共存的有①H+②弱碱的金属离子(如NH4+、Cu2+、Fe2+、Fe3+)③弱酸的酸式根离子
如HCO3- 、HS-、HSO3-、HPO42-、H2PO4-(除Na+、K+、Ba2+外的阳离子)(除Cl-、SO42-、NO3-外的阴离子)离子方程式与化学方程式的互写离子方程式化学方程式一对一写、改、删、查一对n写、加、查完成下列反应的离子方程式⑴ 少量的二氧化碳通入澄清石灰水中⑵ 过量的二氧化碳通入澄清石灰水中⑶ 氯气通入石灰乳中⑷ 向澄清石灰水中加入稀硫酸⑸ 浓热硫酸与铜反应CO2 + OH - = HCO3-2CO2 + Ca(OH)2 = Ca(HCO3)22Cl2 + 2Ca(OH)2 = CaCl2+ Ca(ClO)2 +2H2O
(2)酸、碱、盐、部分金属氧化物是_电解质___,非金属氧化
物,大部分有机物为_非电解质___。
(3) 将SO3溶于水所形成的溶液能导电,SO3是否为电解质? 电解质和非电解质电解质:凡是在水溶液中或熔融状态下,能导电的化合物。非电解质:凡是在水溶液中和熔融状态下,都不能导电的化合物。凡是在水溶液中或熔融状态下,本身能电离出离子而导电的化合物。凡是在水溶液中和熔融状态下,本身不能电离出离子而导电的化合物。一定要搞清本质!电解质和非电解质讨论一:判断一个物质是否是电解质的依据是什么?问题与讨论讨论二:判断SO2、Cl2、NH3、盐酸是否是电解质?讨论三:电解质在水溶液中和熔融状态下都能导电?讨论四:化合物不是电解质就是非电解质?讨论五:氧化钠溶于水能导电,所以它是电解质。讨论六:固体氯化钠不导电,所以它不是电解质?溶液的导电性溶液导电示意图:定向运动自由移动的离子电解质溶液一定要搞清本质!电离外电场导电问题与讨论溶液的导电性讨论一:不同的电解质溶液导电能力为什么不同?讨论二:离子数目越多导电能力越强?讨论三:非电解质溶液不能导电?讨论四:水溶液能导电一定是把电解质加到水里了?讨论五:导电能力强的溶液里离子数目一定比导电能力
弱的溶液里离子数目多?讨论六:同条件下的电解质溶液导电能力不同,说明什
么问题?如盐酸和醋酸。判断正误:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质
5、BaSO4难溶于水,所以BaSO4是非电解质
6、电解质都能够导电,能导电的物质都是电解质
7、非电解质都不能导电,不能导电的物质不一定是非电解质。√XXXXXX2、强电解质和弱电解质强电解质:在水溶液中全部电离成离子的电解质弱电解质:在水溶液中部分电离成离子的电解质包括强酸 如
强碱 如
大多数盐 如 包括弱酸 如
弱碱 如
水盐酸硫酸硝酸NaOHKOHBa(OH)2NaClAgNO3BaSO4醋酸H3PO4H2SHClO氨水Al(OH)3Cu(OH)2Ca(OH)2CaCO3Fe(OH)31、电解质和非电解质——能否发生电离——电离程度强电解质和弱电解质强电解质:能全部电离成离子的电解质。强酸、强碱、大部分盐。弱电解质:能部分电离成离子的电解质。弱酸、弱碱、水。本质区别:是否能完全电离。存在电离平衡。注意区别!强电解质和弱电解质问题与讨论讨论一:强电解质溶液的导电能力一定强?讨论二:难溶物一定是弱电解质?讨论三:强电解质溶液的导电能力一定强于弱电解质?讨论四:同浓度的强电解质溶液的导电能力一定强于弱
电解质溶液的导电能力?讨论五:弱电解质一定不完全电离?练习:
1、下列各项中的物质能导电且属于强电解质的是( )
A、固态氯化镁(MgCl2)
B、液态氯化镁(MgCl2)
C、氨水 D、液态H3PO4
2、NaHSO4溶于水的电离方程式_________,
NaHSO4受热熔化的电离方程式_______。
二、电解质的电离
1、电离条件
(1)离子化合物型电解质电离的条件
① 溶于水(注意:难溶于水的、跟水反应的)
② 受热熔化(注意:受热反应的)
(2)共价化合物型电解质电离的条件
在水作用下
2、电离方程式
完全电离
部分电离
3、电离方程式的书写(1)强电解质——完全电离,用“=”(2)弱电解质——部分电离,用“ ”练习:下列物质中是电解质的写出电离方程式:
H2SO3、HClO、 Cl2、 CH3COOH、 Ba(OH)2、 Cu(OH)2 、 NH3、 NH3·H2O、 KCl、CaCO3、Na2SO4、CO2、
H2O 、KMnO4、H2SO4 、AgNO3、
NaHSO4、NaHCO3、 写出下列物质的电离方程式:
① H2SO4 、② HClO、③Ba(OH)2
④ Cu(OH)2 ⑤ NH3·H2O、 ⑥ KMnO4 、
⑦CaCO3⑧ NaHSO4⑨ NaHCO3 ⑩H2O ① H2SO4 2H++SO42-② HClO H++ClO-③ Ba(OH)2 Ba2++2OH-④ Cu(OH)2 Cu2++2OH-⑤ NH3·H2O NH4++OH-⑥KMnO4 K++MnO4-⑦CaCO3 Ca2++CO32-⑧NaHSO4 Na++H++SO42-⑨ NaHCO3 Na++HCO3-⑩H2O H++OH-我是弱电解质我是强电解质,我更亮!硫酸与氢氧化钡溶液混合改用醋酸与氨水混合做上述实验呢??二、离子反应1、概念:2、判断依据:3、发生的条件:电解质在溶液中进行(有离子参加的反应)(1)沉淀(2)气体(3)难电离物质(弱电解质)(4 )氧化还原反应4、离子方程式:用实际参加反应的离子的符号来表示离子反应的式子,叫离子方程式。电解质在溶液中的反应物质化合物
单质强酸
强碱
盐
弱酸
弱碱
氧化物可溶
微溶
难溶离子化学式强电解质弱电解质离子方程式的书写(1)写(2)改(3)删(4)查——写出化学方程式①易溶于水、易电离物质(强酸、强碱、可溶性盐)——写离子形式
②难溶于水、难电离物质(弱电解质)——写化学式
③单质、气体、氧化物——写化学式——删去方程式两边不参加反应的离子——查原子个数、查电荷离子反应方程式的意义:(1)表示所有同一类型的离子反应。
(2)判断离子能否共存与H+不共存的有①OH-、②弱酸的酸根离子和酸式根离子如CO32-、SO32-、S2-、PO43-、CH3COO-、ClO-
HCO3- 、HS-、HSO3-、HPO42-、H2PO4-与OH-不共存的有①H+②弱碱的金属离子(如NH4+、Cu2+、Fe2+、Fe3+)③弱酸的酸式根离子
如HCO3- 、HS-、HSO3-、HPO42-、H2PO4-(除Na+、K+、Ba2+外的阳离子)(除Cl-、SO42-、NO3-外的阴离子)离子方程式与化学方程式的互写离子方程式化学方程式一对一写、改、删、查一对n写、加、查完成下列反应的离子方程式⑴ 少量的二氧化碳通入澄清石灰水中⑵ 过量的二氧化碳通入澄清石灰水中⑶ 氯气通入石灰乳中⑷ 向澄清石灰水中加入稀硫酸⑸ 浓热硫酸与铜反应CO2 + OH - = HCO3-2CO2 + Ca(OH)2 = Ca(HCO3)22Cl2 + 2Ca(OH)2 = CaCl2+ Ca(ClO)2 +2H2O
