安徽省淮南市第四中学人教版化学选修四4.1原电池课件 (共20张PPT)
文档属性
| 名称 | 安徽省淮南市第四中学人教版化学选修四4.1原电池课件 (共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-10 22:27:31 | ||
图片预览








文档简介
课件20张PPT。
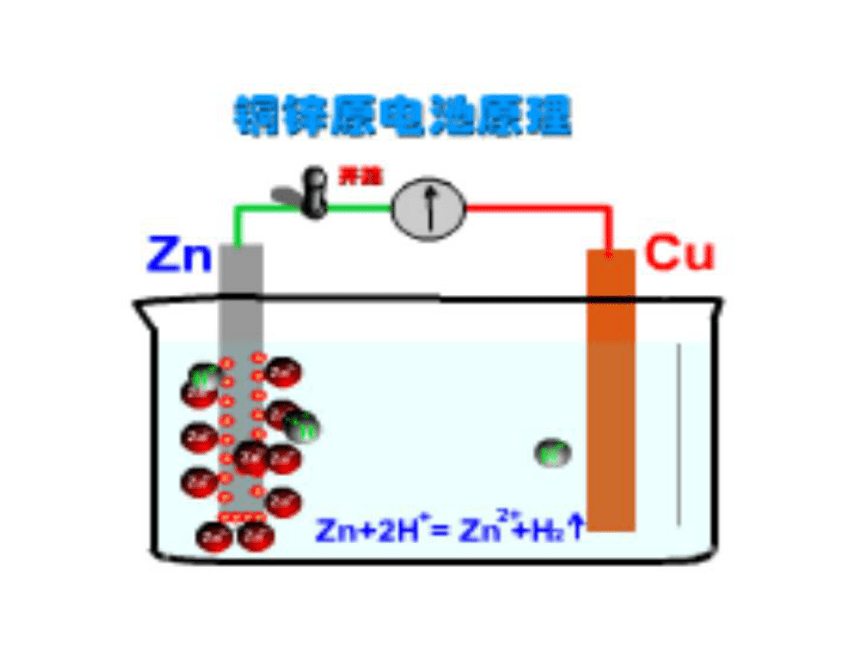
§4.1 原电池手机又没电了!环节一情景设置电池在生活中的广泛应用西红柿电池实验用品:
西红柿,锌片,铜片,夹导线,灵敏电流表,滤纸片,饱和氯化钠溶液,小刀,砂纸趣味实验1、通过观察实验总结实验现象:1、铜片上有气泡冒出
2、锌片溶解且有气泡冒出
3、电流表发生偏转环节二旧知回顾2、能不能写出电极反应式?负极:Zn-2e-=Zn2+正极:2H++2e-=H2↑(1)原理:外电路:这样整个电路构成了闭合回路,带电粒子的定向移动产生电流内电路: 1、原电池 的装置。 原电池反应的本质是发生_____ ________反应。 2、原电池的构成条件: 3、原电池正、负极规律 ①负极——电子 的极。通常是活泼性 的金属,发生 反应 ②正极——电子 的极。通常是活泼性 的金属或非金属导体,发生 反应 流出较强氧化流入较弱还原①有两种活泼性不同的金属(或其中一种为非金属导体)
②电解质溶液
③构成闭合回路
④能自发地发生氧化还原反应
将化学能转变为电能氧化还原2分钟后……环节三【研究问题】怎样改进才保证只有铜电极产生氢气,而避免锌电极上产生氢气?搭桥“手术”实验创新趣味小实验【结论1】改进后的原电池装置,工作时具有较高的能量转换率盐桥体验探究【思考】改进后的原电池装置有什么优点?1环节四ZnSO4溶液H2SO4溶液【思考】改进后的原电池装置还有什么优点?【结论2】改进后的原电池装置不工作时,化学能不会自动释放【启示】氧化剂和还原剂不直接接触也能发生反应体验探究盐桥1Zn2+e-
e- SO42-SO42-H+K+H2ZnK+Cl-K+Cl-K+Cl-K+Cl-K+Cl-Cl-K+K+Cl-K+K+K+Cl-Cl-K+Cl-Cl-Cl-ZnSO4溶液H2SO4溶液外电路盐桥的作用:(1)传递离子,使整个装置构成通路。
(2)平衡电荷,保持溶液成电中性。 内电路1饱和氯化钾的琼脂凝胶请你设计实验提供的实验用品:
铜片、锌片、电流表、鳄鱼夹导线、砂纸、
带盐桥的U形管、
1mol·L-1硫酸铜溶液、
1mol·L-1硫酸锌溶液。环节五课堂小结1、原电池原理:2、单液电池和双液电池的比较:正极→得电子→发生还原反应{单液电池:工作效率不高,无论断开还是闭合负极都会自动反应双液电池:能量转换率高,电流稳定,断开就不会反应放电1、请同学们根据下面氧化还原反应自选用品设计一个单液一个双液的原电池装置。
Mg(s)+Cu2+(aq)=Mg2+(aq)+Cu(s)
(1)画出此原电池的装置简图;
(2)写出两电极上的电极反应式。作业2.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( ?)
(A)X>Y>Z (B)X>Z>Y
(C)Y>X>Z (D)Y>Z>X
3.下列装置哪些可以形成原电池? 形成原电池的写出电极反应式,并指出电子流动方向。
C再见谢谢各位专家及同仁的观摩
谢谢各位同学们的配合
诚请各位专家和同仁
及同学们提出宝贵意见
谢谢2018-10-29
西红柿,锌片,铜片,夹导线,灵敏电流表,滤纸片,饱和氯化钠溶液,小刀,砂纸趣味实验1、通过观察实验总结实验现象:1、铜片上有气泡冒出
2、锌片溶解且有气泡冒出
3、电流表发生偏转环节二旧知回顾2、能不能写出电极反应式?负极:Zn-2e-=Zn2+正极:2H++2e-=H2↑(1)原理:外电路:这样整个电路构成了闭合回路,带电粒子的定向移动产生电流内电路: 1、原电池 的装置。 原电池反应的本质是发生_____ ________反应。 2、原电池的构成条件: 3、原电池正、负极规律 ①负极——电子 的极。通常是活泼性 的金属,发生 反应 ②正极——电子 的极。通常是活泼性 的金属或非金属导体,发生 反应 流出较强氧化流入较弱还原①有两种活泼性不同的金属(或其中一种为非金属导体)
②电解质溶液
③构成闭合回路
④能自发地发生氧化还原反应
将化学能转变为电能氧化还原2分钟后……环节三【研究问题】怎样改进才保证只有铜电极产生氢气,而避免锌电极上产生氢气?搭桥“手术”实验创新趣味小实验【结论1】改进后的原电池装置,工作时具有较高的能量转换率盐桥体验探究【思考】改进后的原电池装置有什么优点?1环节四ZnSO4溶液H2SO4溶液【思考】改进后的原电池装置还有什么优点?【结论2】改进后的原电池装置不工作时,化学能不会自动释放【启示】氧化剂和还原剂不直接接触也能发生反应体验探究盐桥1Zn2+e-
e- SO42-SO42-H+K+H2ZnK+Cl-K+Cl-K+Cl-K+Cl-K+Cl-Cl-K+K+Cl-K+K+K+Cl-Cl-K+Cl-Cl-Cl-ZnSO4溶液H2SO4溶液外电路盐桥的作用:(1)传递离子,使整个装置构成通路。
(2)平衡电荷,保持溶液成电中性。 内电路1饱和氯化钾的琼脂凝胶请你设计实验提供的实验用品:
铜片、锌片、电流表、鳄鱼夹导线、砂纸、
带盐桥的U形管、
1mol·L-1硫酸铜溶液、
1mol·L-1硫酸锌溶液。环节五课堂小结1、原电池原理:2、单液电池和双液电池的比较:正极→得电子→发生还原反应{单液电池:工作效率不高,无论断开还是闭合负极都会自动反应双液电池:能量转换率高,电流稳定,断开就不会反应放电1、请同学们根据下面氧化还原反应自选用品设计一个单液一个双液的原电池装置。
Mg(s)+Cu2+(aq)=Mg2+(aq)+Cu(s)
(1)画出此原电池的装置简图;
(2)写出两电极上的电极反应式。作业2.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( ?)
(A)X>Y>Z (B)X>Z>Y
(C)Y>X>Z (D)Y>Z>X
3.下列装置哪些可以形成原电池? 形成原电池的写出电极反应式,并指出电子流动方向。
C再见谢谢各位专家及同仁的观摩
谢谢各位同学们的配合
诚请各位专家和同仁
及同学们提出宝贵意见
谢谢2018-10-29
