人教版化学必修1第一章第二节 化学计量在实验中的应用——物质的量浓度计算练习 课件 (共29张PPT)
文档属性
| 名称 | 人教版化学必修1第一章第二节 化学计量在实验中的应用——物质的量浓度计算练习 课件 (共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 75.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-15 00:00:00 | ||
图片预览








文档简介
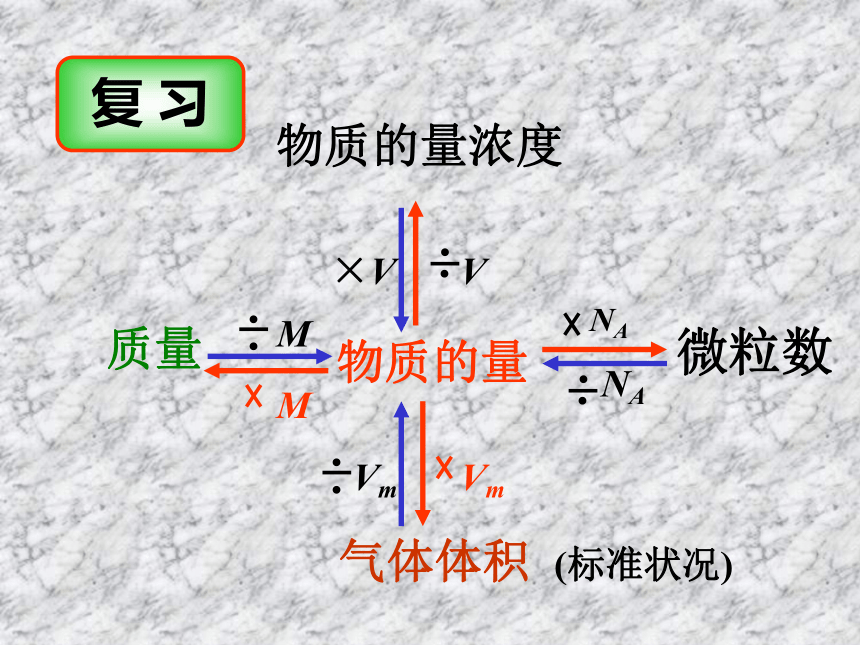
课件29张PPT。物质的量浓度有关计算复 习 物质的量微粒数 NANAMM质量
气体体积 (标准状况)Vm物质的量浓度×V有关物质的量浓度的计算例1.在标准状况下,11.2LNH3溶于水,配成400mL溶液,此氨水物质的量浓度为多少?
例2. 如何用Na2CO3·10H2O配制2.5升0.2 mol/L的Na2CO3溶液?
1.25mol/L取143g?配制溶液的计算【例3 】在200mL稀盐酸里溶有10.95g HCl ,计算溶液的物质的量浓度。解: n (HCl) = 10.95g 36.5g/mol = 0. 3 molV (HCl) = 200mL 1000mL/L = 0. 2 L C (HCl) = 0.3 mol 0.2L = 1.5 mol/L 答: 这种盐酸的浓度是 1.5 mol/L配制溶液的计算【例4 】计算配制 500 mL 0.1 mol/L 的NaOH 溶液所需NaOH的质量。V (NaOH) = 500mL 1000mL/L = 0. 5 Ln (NaOH) = 0. 1 mol/L × 0. 5 L = 0. 05 mol m (NaOH) = 0. 05 mol × 40 g/mol = 2g 答: 配制500mL 0.1mol/LNaOH溶液需NaOH 2g 。解:配制溶液的计算【例5 】标准状况下,将448L NH3 溶于1L 水中,得到密度为0.9 g/cm3 的氨水。求此氨水的物质的量浓度。解: n (NH3) = 448L 22.4L/mol = 20 molm (NH3) = 20 mol × 17g/mol = 340g V(氨水) = 1340g 0. 9g/mL ×1000mL/L= 1. 49 L 答: 此氨水的浓度是 13. 4 mol/Lm (氨水) = 340g + 1000g = 1340g C(氨水) = 20 mol 1. 49L=13. 4 mol/L有关溶液稀释的计算思考与交流如果将5ml浓硫酸稀释为20ml稀硫酸得到的稀硫酸与原浓硫酸中所含硫酸的物质的量相等吗?能说出你的理由吗?浓溶液配制稀溶液,稀释前后溶液中溶质的物质的量相等: C1V1=C2V2
溶液稀释的计算【例6 】要配制500mL 0.6mol/L 的NaOH溶液,需6 mol/L 的NaOH溶液多少毫升?6 mol/L×V = 0.6mol/L ×500mL V = 50 mL 答:需6 mol/L的NaOH溶液50mL 。解:设需6 mol/L NaOH 溶液的体积为V分析:稀释前后溶质的质量和物质的量不变,故有: C1V1 = C2V2 ( 体积单位相同则可)【例7 】 配制500mL1 mol/L的H2SO4溶液,需要密度为1.84g/mL的浓硫酸(98%硫酸)多少毫升?
根据稀释前后溶质质量相等,应有:
V.1.84.98%=0.5x1x98
V= 27.2ml
答:需要这样的浓硫酸27.2ml
有关溶液稀释的计算1、20%的蔗糖(C12H22O11)溶液200克稀释到1升,其物质的量浓度将是多少?
2、将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
342克/摩0.12mol/L40ml混合溶液物质的量浓度的计算【例7 】50 mL 0.5 mol/L BaCl2 溶液和100 mL 0.5 mol/L NaCl溶液混合后,求溶液中Cl- 的物质的量浓度(设溶液体积变化忽略不计)。C (Cl-) = 50mL ×0. 5mol/L ×2 + 100mL ×0. 5mol/L 50mL+ 100mL = 0. 67 mol/ L 答: 溶液中Cl- 的物质的量浓度是 0.67 mol/L解:1、 2 mol/L的盐酸溶液200L和4 mol/L的盐酸溶液100L混合,求:混合后溶液中盐酸的物质的量浓度。由:C3V3 = C1V1+C2V2 2x0.2+4x0.1=Cx(0.2+0.1)C= 2.67mol/L答:混合后溶液中盐酸的物质的量浓度为2.67mol/L 。
练习2、2 mol/L的盐酸200L和4 mol/L的硫酸100L混合,则混合后溶液中H+的物质的量浓度是多少?
4mol/L练习物质的量浓度与溶质质量分数的换算【分析 】设溶液的体积为1L ,溶液的质量分数为ω ,密度为ρ g/cm3,溶质的摩尔质量为 M g/mol则有: C = 而 ω = C mol/L×1L ×M g/mol 1000mL × ρ g/cm3 物质的量浓度与 溶质质量分数 的换算必须以密度为桥梁。 1000mL× ρ g/cm3 × ω
M g/mol ÷ 1L = 1000mL× ρ g/cm3 × ωM g/mol × 1L× 100%物质的量浓度与溶质质量分数的换算1、98%的密度为 1. 84 g/cm3 的浓硫酸,其物质的量浓度为多少?C ( H2SO4 ) = 1000mL×1. 84 g/cm3 × 98%98 g/mol × 1L = 18. 4 mol/L解:答:浓硫酸的物质的量浓度为 18 .4 mol/L2、37%的盐酸,密度为1.19g/cm3,求其物质的量浓度?
=12.06mol/LCHCl=1000x1.19x37%36.5答:盐酸的物质的量浓度是12.06mol/L质量分数与物质的量浓度的换算2、试求浓度为32%,密度为1.2g/mL的硝酸溶液的物质的量浓度?
3、98%的硫酸,密度为1.84g/cm3,求其物质的量浓度? 6.09mol/L18.4mol/L有关化学方程式的计算1、中和 1L 0. 5mol/L NaOH 溶液,需要多少升的1 mol/L H2SO4 溶液? 2 NaOH + H2SO4 = Na2SO4 + 2H2O解:答:需 1mol/L H2SO4 溶液 0.25L。设需 1 mol / L H2SO4 溶液的体积为 x 2 mol 1 mol (0. 5 mol/L)(1L) (1 mol/L)(x) 2 mol : ( 0. 5 mol/L)(1L)
= 1mol : ( 1 mol /L)( x )x = 0.25L?有关溶液反应的计算 2.中和1升0.5 mol/LNaOH溶液,需要多少升1 mol/LH2SO4溶液?
3.中和50mL 2 mol/LHNO3溶液共用去了NaOH溶液80mL,求此NaOH溶液的物质的量浓度和溶质的质量分数。(NaOH溶液的密度为1.05g/mL)0.25L1.25mol/L,4.76%4、配制500mL0.2 mol/L硝酸溶液,需要密度为1.4g/cm3的65%的硝酸多少毫升?
5、在VmLMgBr2溶液中含有m g的Mg2+,求Mg2+、MgBr2、Br-的物质的量浓度?
6、工业烧碱2g,制成500mL溶液,取25mL可与0.1 mol/L盐酸20mL完全中和,求烧碱的纯度? 6.9ml41.7m/v 83.3m/v80%随堂检测 欲配制1 mol/L的氢氧化钾溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。14烧杯少量冷却玻璃棒250随堂检测一 ③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 ________中并贴好标签。 2~3偏低1~2厘米胶头滴管偏低重新配制摇匀试剂瓶3、配制500mL1 mol/L的H2SO4溶液,需要密度为1.84g/mL的浓硫酸(98%硫酸)多少毫升?
根据稀释前后溶质质量相等,应有:
V.1.84.98%=0.5x1x98
V= 27.2ml
答:需要这样的浓硫酸27.2ml
有关溶液稀释的计算1、20%的蔗糖(C12H22O11)溶液200克稀释到1升,其物质的量浓度将是多少?
2、将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
342克/摩0.12mol/L40ml有关物质的量浓度的计算5.有关两种不同浓度溶液混合的计算
C3V3 == C1V1+C2V2
混合前后溶质的物质的量总和不变
6.有关溶液反应的计算
不同浓度溶液混合的计算1.2 mol/L的盐酸溶液200mL和4 mol/L的盐酸溶液100mL混合,求:混合后溶液中盐酸的物质的量浓度。由:C3V3 = C1V1+C2V2 2x0.2+4x0.1=Cx(0.2+0.1)C= 2.67mol/L答:混合后溶液中盐酸的物质的量浓度为2.67mol/L 。
2、2 mol/L的盐酸200mL和4 mol/L的硫酸100mL混合,则混合后溶液中H+的物质的量浓度是多少?
答:混合后溶液中H+的物质的量浓度是4mol/L练习CH+= 1.把19.6克H2SO4配成200ml稀H2SO4,其物质的量浓度为多少?
19.6克硫酸物质的量为:
n=
=0.2mol=1mol/L19.6g98g/molCH2SO4=0.2mol0.2L答:它的物质的量浓度是1mol/L练习课堂练习 下列关于0.1mol/L硝酸钾溶液配制的说法中,错误的是( )
(A)0.01molKNO3溶于100mL水配制而成
(B)0.05molKNO3溶于水配制成500mL水溶液
(C)0.2mol/LKNO3100mL稀释成200mL
(D)0.1molKNO3溶于1L水配制而成A、D
气体体积 (标准状况)Vm物质的量浓度×V有关物质的量浓度的计算例1.在标准状况下,11.2LNH3溶于水,配成400mL溶液,此氨水物质的量浓度为多少?
例2. 如何用Na2CO3·10H2O配制2.5升0.2 mol/L的Na2CO3溶液?
1.25mol/L取143g?配制溶液的计算【例3 】在200mL稀盐酸里溶有10.95g HCl ,计算溶液的物质的量浓度。解: n (HCl) = 10.95g 36.5g/mol = 0. 3 molV (HCl) = 200mL 1000mL/L = 0. 2 L C (HCl) = 0.3 mol 0.2L = 1.5 mol/L 答: 这种盐酸的浓度是 1.5 mol/L配制溶液的计算【例4 】计算配制 500 mL 0.1 mol/L 的NaOH 溶液所需NaOH的质量。V (NaOH) = 500mL 1000mL/L = 0. 5 Ln (NaOH) = 0. 1 mol/L × 0. 5 L = 0. 05 mol m (NaOH) = 0. 05 mol × 40 g/mol = 2g 答: 配制500mL 0.1mol/LNaOH溶液需NaOH 2g 。解:配制溶液的计算【例5 】标准状况下,将448L NH3 溶于1L 水中,得到密度为0.9 g/cm3 的氨水。求此氨水的物质的量浓度。解: n (NH3) = 448L 22.4L/mol = 20 molm (NH3) = 20 mol × 17g/mol = 340g V(氨水) = 1340g 0. 9g/mL ×1000mL/L= 1. 49 L 答: 此氨水的浓度是 13. 4 mol/Lm (氨水) = 340g + 1000g = 1340g C(氨水) = 20 mol 1. 49L=13. 4 mol/L有关溶液稀释的计算思考与交流如果将5ml浓硫酸稀释为20ml稀硫酸得到的稀硫酸与原浓硫酸中所含硫酸的物质的量相等吗?能说出你的理由吗?浓溶液配制稀溶液,稀释前后溶液中溶质的物质的量相等: C1V1=C2V2
溶液稀释的计算【例6 】要配制500mL 0.6mol/L 的NaOH溶液,需6 mol/L 的NaOH溶液多少毫升?6 mol/L×V = 0.6mol/L ×500mL V = 50 mL 答:需6 mol/L的NaOH溶液50mL 。解:设需6 mol/L NaOH 溶液的体积为V分析:稀释前后溶质的质量和物质的量不变,故有: C1V1 = C2V2 ( 体积单位相同则可)【例7 】 配制500mL1 mol/L的H2SO4溶液,需要密度为1.84g/mL的浓硫酸(98%硫酸)多少毫升?
根据稀释前后溶质质量相等,应有:
V.1.84.98%=0.5x1x98
V= 27.2ml
答:需要这样的浓硫酸27.2ml
有关溶液稀释的计算1、20%的蔗糖(C12H22O11)溶液200克稀释到1升,其物质的量浓度将是多少?
2、将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
342克/摩0.12mol/L40ml混合溶液物质的量浓度的计算【例7 】50 mL 0.5 mol/L BaCl2 溶液和100 mL 0.5 mol/L NaCl溶液混合后,求溶液中Cl- 的物质的量浓度(设溶液体积变化忽略不计)。C (Cl-) = 50mL ×0. 5mol/L ×2 + 100mL ×0. 5mol/L 50mL+ 100mL = 0. 67 mol/ L 答: 溶液中Cl- 的物质的量浓度是 0.67 mol/L解:1、 2 mol/L的盐酸溶液200L和4 mol/L的盐酸溶液100L混合,求:混合后溶液中盐酸的物质的量浓度。由:C3V3 = C1V1+C2V2 2x0.2+4x0.1=Cx(0.2+0.1)C= 2.67mol/L答:混合后溶液中盐酸的物质的量浓度为2.67mol/L 。
练习2、2 mol/L的盐酸200L和4 mol/L的硫酸100L混合,则混合后溶液中H+的物质的量浓度是多少?
4mol/L练习物质的量浓度与溶质质量分数的换算【分析 】设溶液的体积为1L ,溶液的质量分数为ω ,密度为ρ g/cm3,溶质的摩尔质量为 M g/mol则有: C = 而 ω = C mol/L×1L ×M g/mol 1000mL × ρ g/cm3 物质的量浓度与 溶质质量分数 的换算必须以密度为桥梁。 1000mL× ρ g/cm3 × ω
M g/mol ÷ 1L = 1000mL× ρ g/cm3 × ωM g/mol × 1L× 100%物质的量浓度与溶质质量分数的换算1、98%的密度为 1. 84 g/cm3 的浓硫酸,其物质的量浓度为多少?C ( H2SO4 ) = 1000mL×1. 84 g/cm3 × 98%98 g/mol × 1L = 18. 4 mol/L解:答:浓硫酸的物质的量浓度为 18 .4 mol/L2、37%的盐酸,密度为1.19g/cm3,求其物质的量浓度?
=12.06mol/LCHCl=1000x1.19x37%36.5答:盐酸的物质的量浓度是12.06mol/L质量分数与物质的量浓度的换算2、试求浓度为32%,密度为1.2g/mL的硝酸溶液的物质的量浓度?
3、98%的硫酸,密度为1.84g/cm3,求其物质的量浓度? 6.09mol/L18.4mol/L有关化学方程式的计算1、中和 1L 0. 5mol/L NaOH 溶液,需要多少升的1 mol/L H2SO4 溶液? 2 NaOH + H2SO4 = Na2SO4 + 2H2O解:答:需 1mol/L H2SO4 溶液 0.25L。设需 1 mol / L H2SO4 溶液的体积为 x 2 mol 1 mol (0. 5 mol/L)(1L) (1 mol/L)(x) 2 mol : ( 0. 5 mol/L)(1L)
= 1mol : ( 1 mol /L)( x )x = 0.25L?有关溶液反应的计算 2.中和1升0.5 mol/LNaOH溶液,需要多少升1 mol/LH2SO4溶液?
3.中和50mL 2 mol/LHNO3溶液共用去了NaOH溶液80mL,求此NaOH溶液的物质的量浓度和溶质的质量分数。(NaOH溶液的密度为1.05g/mL)0.25L1.25mol/L,4.76%4、配制500mL0.2 mol/L硝酸溶液,需要密度为1.4g/cm3的65%的硝酸多少毫升?
5、在VmLMgBr2溶液中含有m g的Mg2+,求Mg2+、MgBr2、Br-的物质的量浓度?
6、工业烧碱2g,制成500mL溶液,取25mL可与0.1 mol/L盐酸20mL完全中和,求烧碱的纯度? 6.9ml41.7m/v 83.3m/v80%随堂检测 欲配制1 mol/L的氢氧化钾溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。14烧杯少量冷却玻璃棒250随堂检测一 ③用少量蒸馏水冲洗 次,将冲洗液移入 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入 ________中并贴好标签。 2~3偏低1~2厘米胶头滴管偏低重新配制摇匀试剂瓶3、配制500mL1 mol/L的H2SO4溶液,需要密度为1.84g/mL的浓硫酸(98%硫酸)多少毫升?
根据稀释前后溶质质量相等,应有:
V.1.84.98%=0.5x1x98
V= 27.2ml
答:需要这样的浓硫酸27.2ml
有关溶液稀释的计算1、20%的蔗糖(C12H22O11)溶液200克稀释到1升,其物质的量浓度将是多少?
2、将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
342克/摩0.12mol/L40ml有关物质的量浓度的计算5.有关两种不同浓度溶液混合的计算
C3V3 == C1V1+C2V2
混合前后溶质的物质的量总和不变
6.有关溶液反应的计算
不同浓度溶液混合的计算1.2 mol/L的盐酸溶液200mL和4 mol/L的盐酸溶液100mL混合,求:混合后溶液中盐酸的物质的量浓度。由:C3V3 = C1V1+C2V2 2x0.2+4x0.1=Cx(0.2+0.1)C= 2.67mol/L答:混合后溶液中盐酸的物质的量浓度为2.67mol/L 。
2、2 mol/L的盐酸200mL和4 mol/L的硫酸100mL混合,则混合后溶液中H+的物质的量浓度是多少?
答:混合后溶液中H+的物质的量浓度是4mol/L练习CH+= 1.把19.6克H2SO4配成200ml稀H2SO4,其物质的量浓度为多少?
19.6克硫酸物质的量为:
n=
=0.2mol=1mol/L19.6g98g/molCH2SO4=0.2mol0.2L答:它的物质的量浓度是1mol/L练习课堂练习 下列关于0.1mol/L硝酸钾溶液配制的说法中,错误的是( )
(A)0.01molKNO3溶于100mL水配制而成
(B)0.05molKNO3溶于水配制成500mL水溶液
(C)0.2mol/LKNO3100mL稀释成200mL
(D)0.1molKNO3溶于1L水配制而成A、D
