九年级化学(粤教版)下册课件:7.1 溶解现象 (共24张PPT)
文档属性
| 名称 | 九年级化学(粤教版)下册课件:7.1 溶解现象 (共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 549.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-14 00:00:00 | ||
图片预览







文档简介
课件24张PPT。7.1 溶解现象学习目标:1、认识溶解现象,了解溶液、溶质和溶剂的概念。
2、找出影响溶解快慢的因素。【观察活动】【实验7-1】分别把少量硫酸铜、酒精、泥沙、食用油加入10mL的水中,充分振荡。研究 溶液的形成√√√硫酸铜、酒精能溶解于水中泥沙、食用油不能溶解于水中√ 在通常情况下,我们把
一种物质的分子或离子均匀
分散到另一种物质中的过程,
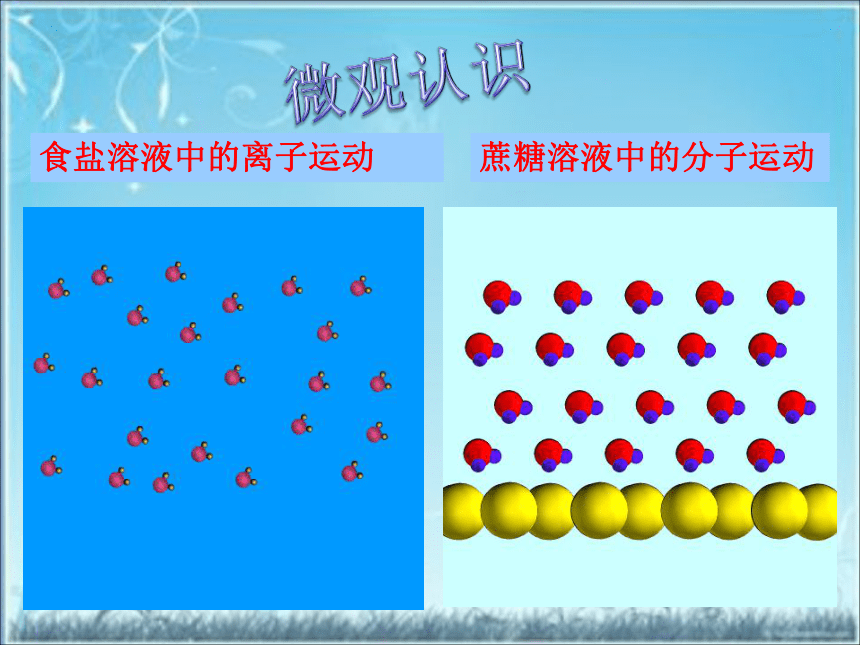
叫做物质的溶解。蔗糖溶液中的分子运动食盐溶液中的离子运动微观认识什么叫溶液?溶液具有怎样的特征?均一、稳定、混合物什么溶剂?什么是溶质? 在通常情况下,溶质可以
是固体,也可以是液体或气体。
溶剂可以是水以及其他液体。 能溶解其他物质的物质叫做溶剂,
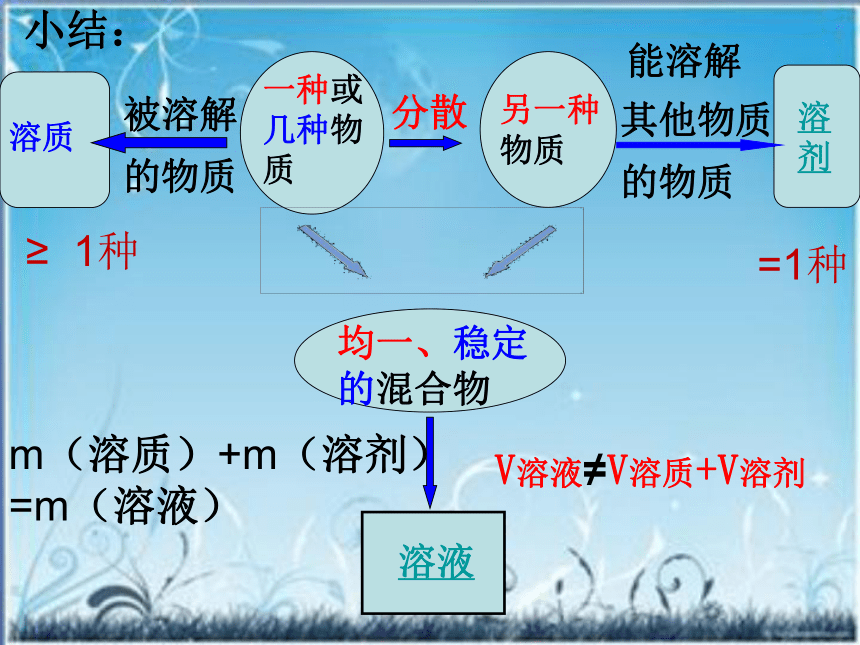
被溶解的物质叫做溶质。小结:m(溶质)+m(溶剂)
=m(溶液)V溶液≠V溶质+V溶剂≥ 1种=1种一种或几种物质分散到另一种物质 里,形成均一的、稳定的混合物。一、溶液 溶液的特征:(1)均一性:(2)稳定性:(3)混合物2、组成被溶解的物质能溶解其它物质的物质1、定义:各组成部分性质相同(密度、浓度、性质等)
外界条件不变,组成不会改变 m溶液= m溶质+ m溶剂 V溶液≠V溶质+V溶剂讨论:溶液中溶质和溶剂是如何确定的?气体液体固体液体量少量多非水物水练习: 判断下列溶液中的溶质和溶剂NaOHH2OCa(OH)2NaClH2OH2OC2H5OHH2OI2H2OC2H5OHHCl气体H2SO4H2O汽油植物油酒精 水[交流与讨论]
在许多情况下,人们希望能较快地溶解某些固体物质。怎样才能达到上述目的?
影响物质溶解性的因素有哪些? 【分组实验】
探究影响硫酸铜晶体溶解快慢的因素实验一快快高 在2个同等大小的烧杯中分别注入同等质量的冷水和热水,再同时加入同等质量的硫酸铜。实验二慢快 在2个同等大小的烧杯中分别注入同等质量的冷水,再同时加入同等质量的硫酸铜晶体(块状)和硫酸铜粉末。实验三快快 在2个同等大小的烧杯中分别注入同等质量的冷水,再同时加入同等质量的硫酸铜,用玻璃棒搅拌其中一个烧杯内的水。通过上述实验,可以归纳出下来结论:水的温度高低硫酸铜颗粒的大小是否搅拌水的温度越高,溶解就更快溶质颗粒越小,溶解就越快不断搅拌使物质溶解更快实验探究 在两支试管中各加入2mL~3mL水,分别加入1~2小粒碘或高锰酸钾;另取两支试管各加入2mL~3mL汽油,再分别加入1~2小粒碘或高锰酸钾。振荡,观察现象。 实验现象纪录几乎不溶(溶液黄色) 溶解,溶液紫红色溶解,溶液紫红色几乎不溶物质的溶解性不仅与溶质有关,还与溶剂的性质有关。说一说-关于溶液的认识
(1)溶液一定是无色透明的吗?
(2)均一、稳定的液体一定是溶液吗?
(3)将蔗糖溶液和NaCl溶液混合后还是
溶液吗?
(4)溶液里的溶质只能是一种物质吗?
注意①清澈透明,但不一定是无色。
②溶液中的溶质,可以是一种或几种。可以是分子,也可是离子。
③均一稳定的液体不一定是溶液。
④水是常见的溶剂,汽油、酒精等也可做溶剂。1、溶液、溶质、溶剂的概念。2、溶液的基本特征——均一、稳定、
混合物。3、 m溶液= m溶质+ m溶剂
本节收获4、 溶解速度不仅与溶剂温度高低、溶质颗粒大小以及是否搅拌等因素有关,还与溶剂的性质有关。
练习1:烧杯中有100毫升NaCl溶液,请比较A处和B处密度的大小( )
A:?A > ?B B: ?A < ?B
C:?A= ?B D: 不能确定ABC练习2:当水分不蒸发,温度不改变时,KNO3溶液放置一年时间后,KNO3将( )
A:会沉降下来 B:不会分离出来
C:会浮上水面 D:不能确定B小试牛刀下列小实验不能得到溶液的是( )食盐粉尘植物油蔗糖水水水汽油 现有一杯糖水,取出一部分,测其密度为a g/cm3,则剩余糖水的密度是( )
A.小于 a g/cm3 B.等于 a g/cm3 C.大于a g/cm3 D.无法确定BABCDB再见
2、找出影响溶解快慢的因素。【观察活动】【实验7-1】分别把少量硫酸铜、酒精、泥沙、食用油加入10mL的水中,充分振荡。研究 溶液的形成√√√硫酸铜、酒精能溶解于水中泥沙、食用油不能溶解于水中√ 在通常情况下,我们把
一种物质的分子或离子均匀
分散到另一种物质中的过程,
叫做物质的溶解。蔗糖溶液中的分子运动食盐溶液中的离子运动微观认识什么叫溶液?溶液具有怎样的特征?均一、稳定、混合物什么溶剂?什么是溶质? 在通常情况下,溶质可以
是固体,也可以是液体或气体。
溶剂可以是水以及其他液体。 能溶解其他物质的物质叫做溶剂,
被溶解的物质叫做溶质。小结:m(溶质)+m(溶剂)
=m(溶液)V溶液≠V溶质+V溶剂≥ 1种=1种一种或几种物质分散到另一种物质 里,形成均一的、稳定的混合物。一、溶液 溶液的特征:(1)均一性:(2)稳定性:(3)混合物2、组成被溶解的物质能溶解其它物质的物质1、定义:各组成部分性质相同(密度、浓度、性质等)
外界条件不变,组成不会改变 m溶液= m溶质+ m溶剂 V溶液≠V溶质+V溶剂讨论:溶液中溶质和溶剂是如何确定的?气体液体固体液体量少量多非水物水练习: 判断下列溶液中的溶质和溶剂NaOHH2OCa(OH)2NaClH2OH2OC2H5OHH2OI2H2OC2H5OHHCl气体H2SO4H2O汽油植物油酒精 水[交流与讨论]
在许多情况下,人们希望能较快地溶解某些固体物质。怎样才能达到上述目的?
影响物质溶解性的因素有哪些? 【分组实验】
探究影响硫酸铜晶体溶解快慢的因素实验一快快高 在2个同等大小的烧杯中分别注入同等质量的冷水和热水,再同时加入同等质量的硫酸铜。实验二慢快 在2个同等大小的烧杯中分别注入同等质量的冷水,再同时加入同等质量的硫酸铜晶体(块状)和硫酸铜粉末。实验三快快 在2个同等大小的烧杯中分别注入同等质量的冷水,再同时加入同等质量的硫酸铜,用玻璃棒搅拌其中一个烧杯内的水。通过上述实验,可以归纳出下来结论:水的温度高低硫酸铜颗粒的大小是否搅拌水的温度越高,溶解就更快溶质颗粒越小,溶解就越快不断搅拌使物质溶解更快实验探究 在两支试管中各加入2mL~3mL水,分别加入1~2小粒碘或高锰酸钾;另取两支试管各加入2mL~3mL汽油,再分别加入1~2小粒碘或高锰酸钾。振荡,观察现象。 实验现象纪录几乎不溶(溶液黄色) 溶解,溶液紫红色溶解,溶液紫红色几乎不溶物质的溶解性不仅与溶质有关,还与溶剂的性质有关。说一说-关于溶液的认识
(1)溶液一定是无色透明的吗?
(2)均一、稳定的液体一定是溶液吗?
(3)将蔗糖溶液和NaCl溶液混合后还是
溶液吗?
(4)溶液里的溶质只能是一种物质吗?
注意①清澈透明,但不一定是无色。
②溶液中的溶质,可以是一种或几种。可以是分子,也可是离子。
③均一稳定的液体不一定是溶液。
④水是常见的溶剂,汽油、酒精等也可做溶剂。1、溶液、溶质、溶剂的概念。2、溶液的基本特征——均一、稳定、
混合物。3、 m溶液= m溶质+ m溶剂
本节收获4、 溶解速度不仅与溶剂温度高低、溶质颗粒大小以及是否搅拌等因素有关,还与溶剂的性质有关。
练习1:烧杯中有100毫升NaCl溶液,请比较A处和B处密度的大小( )
A:?A > ?B B: ?A < ?B
C:?A= ?B D: 不能确定ABC练习2:当水分不蒸发,温度不改变时,KNO3溶液放置一年时间后,KNO3将( )
A:会沉降下来 B:不会分离出来
C:会浮上水面 D:不能确定B小试牛刀下列小实验不能得到溶液的是( )食盐粉尘植物油蔗糖水水水汽油 现有一杯糖水,取出一部分,测其密度为a g/cm3,则剩余糖水的密度是( )
A.小于 a g/cm3 B.等于 a g/cm3 C.大于a g/cm3 D.无法确定BABCDB再见
