鲁教版九年级全册(新) 第八单元第三节 海水制碱(1)纯碱的性质课件(19张PPT) (共19张PPT)
文档属性
| 名称 | 鲁教版九年级全册(新) 第八单元第三节 海水制碱(1)纯碱的性质课件(19张PPT) (共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-14 22:39:04 | ||
图片预览





文档简介
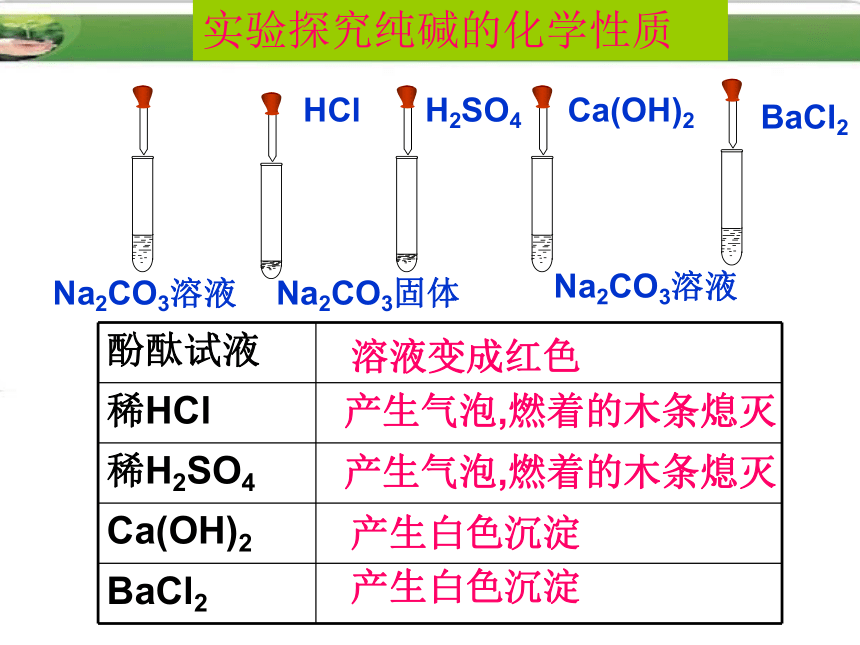
课件19张PPT。第八单元 海水中的化学第三节 海水“制碱”(1)纯碱的性质纯碱(苏打)在生活中的用途Na2CO3盐第八单元 海水中的化学第三节 海水“制碱”(1)纯碱的性质白色粉末状固体,易溶于水二、纯碱(Na2CO3)的性质1、物理性质2、化学性质回忆一下,你已经知道Na2CO3都可以和哪些物质反应?实验探究纯碱的化学性质溶液变成红色产生气泡,燃着的木条熄灭产生气泡,燃着的木条熄灭产生白色沉淀产生白色沉淀Na2CO3固体Na2CO3溶液HClH2SO4Ca(OH)2BaCl2Na2CO3溶液1. Na2CO3与指示剂作用(酚酞)
2. Na2CO3与稀HCl﹑稀H2SO4反应
3. Na2CO3与Ca(OH)2反应
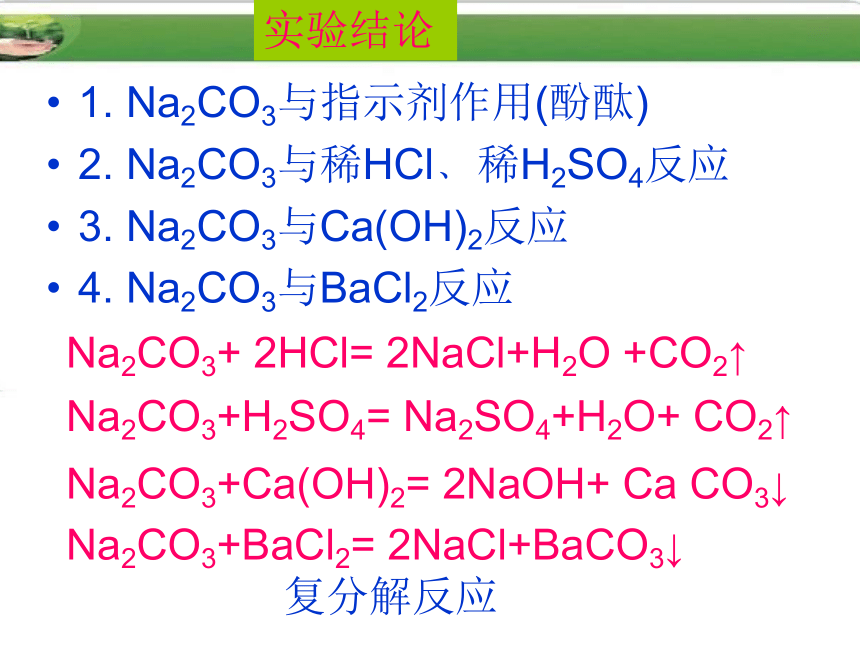
4. Na2CO3与BaCl2反应实验结论Na2CO3+ 2HCl= 2NaCl+H2O +CO2↑Na2CO3+H2SO4= Na2SO4+H2O+ CO2↑Na2CO3+Ca(OH)2= 2NaOH+ Ca CO3↓ Na2CO3+BaCl2= 2NaCl+BaCO3↓复分解反应纯碱的化学性质1.碳酸钠溶液呈碱性,能使指示剂变色。
2.碳酸钠能与酸发生复分解反应生成二氧化碳
Na2CO3 + 2HCl=2NaCl+H2O+CO2↑
Na2CO3 + H2SO4=Na2SO4+H2O+CO2↑
3.碳酸钠与碱溶液发生复分解反应
Na2CO3 + Ca(OH)2=CaCO3 ↓+2NaOH
4.碳酸钠与盐溶液发生复分解反应
Na2CO3 +BaCl2=BaCO3 ↓+2NaCl小结三、盐在水溶液中发生的反应酸碱盐盐复分解反应反应物可均溶(↑ 或↓或H2O)CaCO3+ Ba(OH)2Na2CO3+ Ba(OH)2 只用一种试剂来鉴别NaOH、Ca(OH)2、稀H2SO4三种溶液,这种试剂是_______
A.氯化钡溶液 B.紫色石蕊试液
C.碳酸钠溶液 D.酚酞试液CNaOH
Ca(OH)2
H2SO4
BaCl2
NaOH
Ca(OH)2
H2SO4
Na2CO3
小苏打在生产和生活中的用途NaHCO3盐写出下列化学方程式
CaCO3 + HCl---
Na2CO3 + HCl---
NaHCO3 + HCl---
Na2CO3 + H2SO4---
思考如何检验鸡蛋壳中含有碳酸根?碳酸根的检验方法加稀盐酸并将产生的气体通入澄清石灰水中CaCO3+ 2HCl= CaCl2+H2O +CO2↑CO2 + Ca(OH)2= CaCO3↓ + H2O我的收获纯碱的性质物理性质:白色粉末状固体,易溶于水。化学性质:
1.碳酸钠溶液呈碱性
2.碳酸钠与酸反应生成二氧化碳
Na2CO3 + 2HCl=2NaCl+H2O+CO2↑
3.碳酸钠与碱溶液反应
Na2CO3 + Ca(OH)2=CaCO3 ↓+2NaOH
4.碳酸钠与盐溶液反应
Na2CO3 +BaCl2=BaCO3 ↓+2NaCl盐在水溶液中发生的反应1、除去氯化钠中的杂质碳酸钠,下列方法不能实现的是________
A.加适量盐酸,蒸发结晶
B.加适量氯化钙,过滤后蒸发结晶
C.加适量氢氧化钡,过滤后蒸发结晶
D.加适量氢氧化钠,过滤后蒸发结晶挑战自我C、D2、检验碳酸盐的正确方法是_____
A.滴加盐酸,产生使木条火焰熄灭的气体
B.滴加BaCl2溶液产生白色沉淀
C.加热,产生使澄清石灰水变浑浊的气体
D.滴加盐酸产生使澄清石灰水变浑浊的气体挑战自我D3、学习碳酸钠知识时,老师做碳酸钠溶液和澄清石灰水反应演示实验,并对浑浊液过滤,得到澄清滤液.课堂上老师的提问和同学们的回答如图所示:挑战自我可能是NaOH和Ca(OH)2(1)假设你是丁同学,请你也提出一个与甲、乙、丙同学不同的猜想,把猜想写在对话框中.并对你自己的猜想设计一个简单的实验加以证明.挑战自我(2)你认为甲、乙、丙同学的猜想都合理吗?如有不合理的请说明理由:__________
_________________________________.滴加Na2CO3溶液,有白色沉淀生成Na2CO3和Ca(OH)2能发生反应,不能共存。乙不合理(3)甲同学针对自己的猜想进行了如下实验:
(甲同学认为可能含有NaOH和Na2CO3)挑战自我你认为甲同学的实验设计是否正确?______请说明理由:___________________________________. 不正确有NaOH存在,滴入少量盐酸先与NaOH反应就不会有CO2放出,但Na2CO3可能存在。再见!
2. Na2CO3与稀HCl﹑稀H2SO4反应
3. Na2CO3与Ca(OH)2反应
4. Na2CO3与BaCl2反应实验结论Na2CO3+ 2HCl= 2NaCl+H2O +CO2↑Na2CO3+H2SO4= Na2SO4+H2O+ CO2↑Na2CO3+Ca(OH)2= 2NaOH+ Ca CO3↓ Na2CO3+BaCl2= 2NaCl+BaCO3↓复分解反应纯碱的化学性质1.碳酸钠溶液呈碱性,能使指示剂变色。
2.碳酸钠能与酸发生复分解反应生成二氧化碳
Na2CO3 + 2HCl=2NaCl+H2O+CO2↑
Na2CO3 + H2SO4=Na2SO4+H2O+CO2↑
3.碳酸钠与碱溶液发生复分解反应
Na2CO3 + Ca(OH)2=CaCO3 ↓+2NaOH
4.碳酸钠与盐溶液发生复分解反应
Na2CO3 +BaCl2=BaCO3 ↓+2NaCl小结三、盐在水溶液中发生的反应酸碱盐盐复分解反应反应物可均溶(↑ 或↓或H2O)CaCO3+ Ba(OH)2Na2CO3+ Ba(OH)2 只用一种试剂来鉴别NaOH、Ca(OH)2、稀H2SO4三种溶液,这种试剂是_______
A.氯化钡溶液 B.紫色石蕊试液
C.碳酸钠溶液 D.酚酞试液CNaOH
Ca(OH)2
H2SO4
BaCl2
NaOH
Ca(OH)2
H2SO4
Na2CO3
小苏打在生产和生活中的用途NaHCO3盐写出下列化学方程式
CaCO3 + HCl---
Na2CO3 + HCl---
NaHCO3 + HCl---
Na2CO3 + H2SO4---
思考如何检验鸡蛋壳中含有碳酸根?碳酸根的检验方法加稀盐酸并将产生的气体通入澄清石灰水中CaCO3+ 2HCl= CaCl2+H2O +CO2↑CO2 + Ca(OH)2= CaCO3↓ + H2O我的收获纯碱的性质物理性质:白色粉末状固体,易溶于水。化学性质:
1.碳酸钠溶液呈碱性
2.碳酸钠与酸反应生成二氧化碳
Na2CO3 + 2HCl=2NaCl+H2O+CO2↑
3.碳酸钠与碱溶液反应
Na2CO3 + Ca(OH)2=CaCO3 ↓+2NaOH
4.碳酸钠与盐溶液反应
Na2CO3 +BaCl2=BaCO3 ↓+2NaCl盐在水溶液中发生的反应1、除去氯化钠中的杂质碳酸钠,下列方法不能实现的是________
A.加适量盐酸,蒸发结晶
B.加适量氯化钙,过滤后蒸发结晶
C.加适量氢氧化钡,过滤后蒸发结晶
D.加适量氢氧化钠,过滤后蒸发结晶挑战自我C、D2、检验碳酸盐的正确方法是_____
A.滴加盐酸,产生使木条火焰熄灭的气体
B.滴加BaCl2溶液产生白色沉淀
C.加热,产生使澄清石灰水变浑浊的气体
D.滴加盐酸产生使澄清石灰水变浑浊的气体挑战自我D3、学习碳酸钠知识时,老师做碳酸钠溶液和澄清石灰水反应演示实验,并对浑浊液过滤,得到澄清滤液.课堂上老师的提问和同学们的回答如图所示:挑战自我可能是NaOH和Ca(OH)2(1)假设你是丁同学,请你也提出一个与甲、乙、丙同学不同的猜想,把猜想写在对话框中.并对你自己的猜想设计一个简单的实验加以证明.挑战自我(2)你认为甲、乙、丙同学的猜想都合理吗?如有不合理的请说明理由:__________
_________________________________.滴加Na2CO3溶液,有白色沉淀生成Na2CO3和Ca(OH)2能发生反应,不能共存。乙不合理(3)甲同学针对自己的猜想进行了如下实验:
(甲同学认为可能含有NaOH和Na2CO3)挑战自我你认为甲同学的实验设计是否正确?______请说明理由:___________________________________. 不正确有NaOH存在,滴入少量盐酸先与NaOH反应就不会有CO2放出,但Na2CO3可能存在。再见!
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
