第一节酸及其性质课件(28PPT) (共28张PPT)
文档属性
| 名称 | 第一节酸及其性质课件(28PPT) (共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-14 23:14:53 | ||
图片预览








文档简介
课件28张PPT。第一节
酸及其性质2.能使电解质发生电离的条件是
______或_______。溶于水受热熔化3、写出硫酸、盐酸、硝酸的电离方程式H2SO4 === 2H+ + SO42—HCl === H+ + Cl—HNO3 === H+ + NO3—这节课我们讨论酸的性质。1,酸是________________的化合物.电离时产生的阳离子全部是氢离子 你已经知道哪些酸和碱?了解它们的性质吗?它们在生产、生活中有哪些应用?讨论:1、人的胃液里含有什么酸?
2、汽车电瓶里含有什么酸?
3、食醋里含有什么酸?
4、酸雨里含有什么酸?1、人的胃液里含有盐酸;
2、汽车电瓶里含有硫酸;
3、食醋里含有醋酸,也叫乙酸;
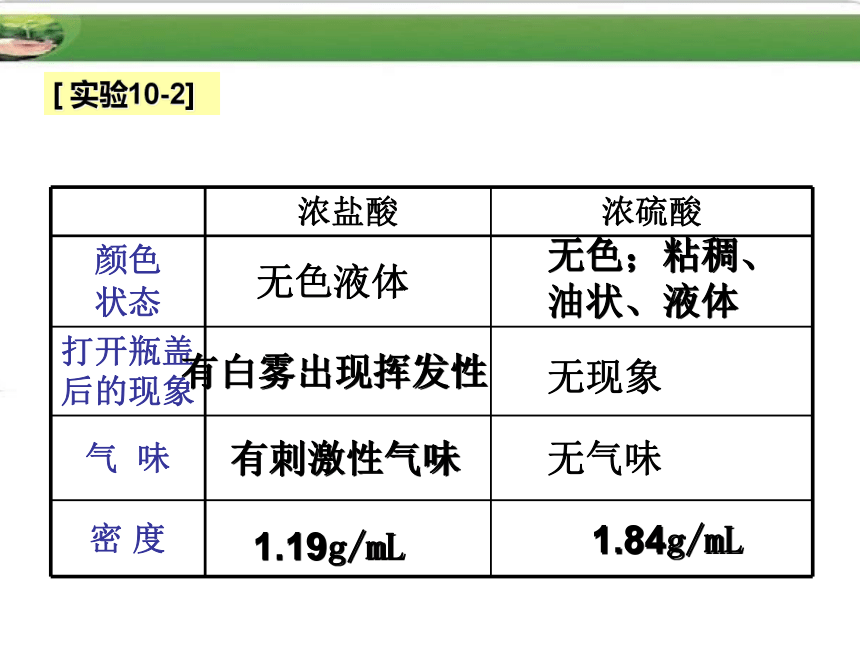
4、酸雨里含有亚硫酸,也可能含有硝酸。探究一:浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法[ 实验10-2]无色液体无色;粘稠、油状、液体有白雾出现挥发性无现象有刺激性气味无气味1.19g/mL1.84g/mL浓盐酸1.无色,有刺激性气味
2.工业品为黄色(有+3铁离子)
3.浓盐酸的质量分数37%~38%
4.浓盐酸的密度为1.18克每毫升
5.浓盐酸具有挥发性,敞口放置形成白雾(原因?)
浓硫酸1.无色无味的油状液体
2.浓硫酸的质量分数为98%
3.吸水性
4.脱水性
5.腐蚀性
6.强氧化性
浓硫酸的性质有吸水性 — 干燥一些气体(O2 N2 CO2 H2等)浓硫酸的脱水性 浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的水分 ( 氢、氧元素 ), 生成黑色的炭和水。 纯净的硫酸是____ 色液体,不易挥发。
浓硫酸有 性,所以可作干燥剂,浓硫酸对皮肤和衣服有很强的_______性。
在稀释浓硫酸时,一定要把 _______沿 , _______注入水中,并用 _______ 不断搅拌。
无吸水腐蚀浓硫酸器壁慢慢玻璃棒[实验10-4]浓硫酸稀释的正确操作, 浓硫酸的稀释 — 放出大量的热 注意!
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里事故的处理:水冲洗—涂上3-5%的NaHCO3溶液活动一:“明星”档案无色液体无色粘稠状液体有无无无有有有有否是 浓盐酸是 色液体,有 气味,打开浓盐酸瓶盖,会见到 ,原因是什么? 无刺激性白雾 浓盐酸挥发出的氯化氢气体遇到空气中的水蒸气形成了盐酸小液滴 浓盐酸挥发出了氯化氢气体使浓盐酸中的溶质质量变小。而浓硫酸则吸收了空气中的水蒸气,使溶剂质量变大。 浓盐酸、浓硫酸长期敞口放置在空气中,溶质质量分数将如何变化?为什么?答:都减小。讨论探究酸的化学性质⒈ 酸溶液能与指示剂反应:结论:结论1、酸能使指示剂变色,其中能使紫色石蕊试液变红色,使无色酚酞试液不变色。A、情景和问题的提出稀盐酸可以用于除铁锈,可观察到_____________,反应的化学方程式为__________________。可是,后来看到铁表面有气泡生成,而铁锈中的氧化铁与稀盐酸反应时却没有气体产生,那么这气体是怎么来的?是什么?是否是铁与稀盐酸反应产生的呢?铁锈逐渐溶解,溶液变成黄色。Fe2O3 + 6HCl === 2FeCl3 + 3 H2O B、你的假设是:铁等金属能与酸反应产生气体。2、盐酸 +金属 = 盐 + 氢气C、设计实验:HCl溶液锌粒(Zn)实验现象:A试管B试管C试管A试管中Fe2O3溶解,溶液变黄色,无气泡产生。B试管中铁钉表面产生气泡。C试管中锌粒表面产生气泡。D实验结论:铁等金属能跟稀盐酸反应产生气体,且产生的气体是氢气。也说明了酸溶液能跟许多金属反应产生氢气。酸 + 某些金属 === 盐 + 氢气锌、铁与稀盐酸反应的化学方程式是:Fe + 2HCl === FeCl2 + H2 ↑
Zn + 2HCl === ZnCl2 + H2↑HCl溶液 FeCl3溶液 a、向盛有一枚生锈的铁钉的试管中加入盐酸,振荡,过会儿观察现象? ____________________________________. 铁锈消失,溶液变成黄色 6HCI + Fe2O3 = 2FeCI3+3H2O红棕色 黄色3、盐酸 +金属氧化物= 盐 + 水 b、向盛有少量氧化铜粉末的试管中加入盐酸,微微加热,观察现象?
______________________________________ 黑色粉末消失,溶液变成蓝色2HCI + CuO = CuCI2 + H2O黑色 蓝色结论3、酸能与金属氧化物反应生成盐和水 盐酸 +金属氧化物= 盐 + 水 a、把鸡蛋壳(主要成分是碳酸钙)放入盛有盐酸的试管中,将燃着的火柴伸入试管口,你看到什么现象?______________________________.蛋壳表面产生气泡,燃着的木条伸入后会熄灭 化学方程式:2HCI + CaCO3 = CaCI2 + H2O + CO2↑4、盐酸 + 盐 = 新盐 + 新酸*? CO32-的检验:加盐酸,能产生使澄清石灰水变浑浊的气体(二氧化碳) Ca(OH)2 + CO2 = CaCO3 ↓ + H2Ob、碳酸钠和盐酸的反应,观察现象?产生的气体通过澄清石灰水,观察现象?2HCI + Na2CO3 = 2NaCI + H2O + CO2 ↑C、在盛有少量稀盐酸的试管里滴入几滴硝酸银溶液,观察现象,再滴稀硝酸,又观察其现象。现象:化学方程式:HCl+AgNO3= AgCl↓+HNO3
白色沉淀有白色沉淀生成,再加入稀硝酸后,白色沉淀不消失。稀盐酸硝酸银 实验室中常用这种方法检验盐酸或能电离出氯离子(Cl-)的物质的存在。 AgCl沉淀是一种既不溶于水,又不溶于酸的沉淀结论5、酸能与盐反应生成新盐和新酸。 酸 + 盐 = 新盐 + 新酸 请你通过盐酸、硫酸的化学性质归纳出酸有哪些共性(通性).1、酸能使紫色的石蕊变红,无色
酚酞不变色4、酸 + 碱 = 盐 + 水 5、酸 + 盐 =新盐 + 新酸3、酸 +金属氧化物= 盐 + 水2、酸+金属 = 盐 + 氢气思考:为什么不同的酸具有共同的化学性质呢?盐+水盐+水新盐+新酸盐+水CaCO3+2HCl=CaCl2+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑Ca (OH)2+2HCl = Ca Cl2+2H2O
Na OH+HCl = NaCl+H2OFe2O3+6HCl= 2FeCl3 + 3H2O
Fe2O3+3H2SO4= Fe2(SO4)3 + 3H2O2NaOH +SO2 = Na2SO3 +H2O
2NaOH +CO2 = Na2CO3 +H2O
酸及其性质2.能使电解质发生电离的条件是
______或_______。溶于水受热熔化3、写出硫酸、盐酸、硝酸的电离方程式H2SO4 === 2H+ + SO42—HCl === H+ + Cl—HNO3 === H+ + NO3—这节课我们讨论酸的性质。1,酸是________________的化合物.电离时产生的阳离子全部是氢离子 你已经知道哪些酸和碱?了解它们的性质吗?它们在生产、生活中有哪些应用?讨论:1、人的胃液里含有什么酸?
2、汽车电瓶里含有什么酸?
3、食醋里含有什么酸?
4、酸雨里含有什么酸?1、人的胃液里含有盐酸;
2、汽车电瓶里含有硫酸;
3、食醋里含有醋酸,也叫乙酸;
4、酸雨里含有亚硫酸,也可能含有硝酸。探究一:浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法[ 实验10-2]无色液体无色;粘稠、油状、液体有白雾出现挥发性无现象有刺激性气味无气味1.19g/mL1.84g/mL浓盐酸1.无色,有刺激性气味
2.工业品为黄色(有+3铁离子)
3.浓盐酸的质量分数37%~38%
4.浓盐酸的密度为1.18克每毫升
5.浓盐酸具有挥发性,敞口放置形成白雾(原因?)
浓硫酸1.无色无味的油状液体
2.浓硫酸的质量分数为98%
3.吸水性
4.脱水性
5.腐蚀性
6.强氧化性
浓硫酸的性质有吸水性 — 干燥一些气体(O2 N2 CO2 H2等)浓硫酸的脱水性 浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的水分 ( 氢、氧元素 ), 生成黑色的炭和水。 纯净的硫酸是____ 色液体,不易挥发。
浓硫酸有 性,所以可作干燥剂,浓硫酸对皮肤和衣服有很强的_______性。
在稀释浓硫酸时,一定要把 _______沿 , _______注入水中,并用 _______ 不断搅拌。
无吸水腐蚀浓硫酸器壁慢慢玻璃棒[实验10-4]浓硫酸稀释的正确操作, 浓硫酸的稀释 — 放出大量的热 注意!
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里事故的处理:水冲洗—涂上3-5%的NaHCO3溶液活动一:“明星”档案无色液体无色粘稠状液体有无无无有有有有否是 浓盐酸是 色液体,有 气味,打开浓盐酸瓶盖,会见到 ,原因是什么? 无刺激性白雾 浓盐酸挥发出的氯化氢气体遇到空气中的水蒸气形成了盐酸小液滴 浓盐酸挥发出了氯化氢气体使浓盐酸中的溶质质量变小。而浓硫酸则吸收了空气中的水蒸气,使溶剂质量变大。 浓盐酸、浓硫酸长期敞口放置在空气中,溶质质量分数将如何变化?为什么?答:都减小。讨论探究酸的化学性质⒈ 酸溶液能与指示剂反应:结论:结论1、酸能使指示剂变色,其中能使紫色石蕊试液变红色,使无色酚酞试液不变色。A、情景和问题的提出稀盐酸可以用于除铁锈,可观察到_____________,反应的化学方程式为__________________。可是,后来看到铁表面有气泡生成,而铁锈中的氧化铁与稀盐酸反应时却没有气体产生,那么这气体是怎么来的?是什么?是否是铁与稀盐酸反应产生的呢?铁锈逐渐溶解,溶液变成黄色。Fe2O3 + 6HCl === 2FeCl3 + 3 H2O B、你的假设是:铁等金属能与酸反应产生气体。2、盐酸 +金属 = 盐 + 氢气C、设计实验:HCl溶液锌粒(Zn)实验现象:A试管B试管C试管A试管中Fe2O3溶解,溶液变黄色,无气泡产生。B试管中铁钉表面产生气泡。C试管中锌粒表面产生气泡。D实验结论:铁等金属能跟稀盐酸反应产生气体,且产生的气体是氢气。也说明了酸溶液能跟许多金属反应产生氢气。酸 + 某些金属 === 盐 + 氢气锌、铁与稀盐酸反应的化学方程式是:Fe + 2HCl === FeCl2 + H2 ↑
Zn + 2HCl === ZnCl2 + H2↑HCl溶液 FeCl3溶液 a、向盛有一枚生锈的铁钉的试管中加入盐酸,振荡,过会儿观察现象? ____________________________________. 铁锈消失,溶液变成黄色 6HCI + Fe2O3 = 2FeCI3+3H2O红棕色 黄色3、盐酸 +金属氧化物= 盐 + 水 b、向盛有少量氧化铜粉末的试管中加入盐酸,微微加热,观察现象?
______________________________________ 黑色粉末消失,溶液变成蓝色2HCI + CuO = CuCI2 + H2O黑色 蓝色结论3、酸能与金属氧化物反应生成盐和水 盐酸 +金属氧化物= 盐 + 水 a、把鸡蛋壳(主要成分是碳酸钙)放入盛有盐酸的试管中,将燃着的火柴伸入试管口,你看到什么现象?______________________________.蛋壳表面产生气泡,燃着的木条伸入后会熄灭 化学方程式:2HCI + CaCO3 = CaCI2 + H2O + CO2↑4、盐酸 + 盐 = 新盐 + 新酸*? CO32-的检验:加盐酸,能产生使澄清石灰水变浑浊的气体(二氧化碳) Ca(OH)2 + CO2 = CaCO3 ↓ + H2Ob、碳酸钠和盐酸的反应,观察现象?产生的气体通过澄清石灰水,观察现象?2HCI + Na2CO3 = 2NaCI + H2O + CO2 ↑C、在盛有少量稀盐酸的试管里滴入几滴硝酸银溶液,观察现象,再滴稀硝酸,又观察其现象。现象:化学方程式:HCl+AgNO3= AgCl↓+HNO3
白色沉淀有白色沉淀生成,再加入稀硝酸后,白色沉淀不消失。稀盐酸硝酸银 实验室中常用这种方法检验盐酸或能电离出氯离子(Cl-)的物质的存在。 AgCl沉淀是一种既不溶于水,又不溶于酸的沉淀结论5、酸能与盐反应生成新盐和新酸。 酸 + 盐 = 新盐 + 新酸 请你通过盐酸、硫酸的化学性质归纳出酸有哪些共性(通性).1、酸能使紫色的石蕊变红,无色
酚酞不变色4、酸 + 碱 = 盐 + 水 5、酸 + 盐 =新盐 + 新酸3、酸 +金属氧化物= 盐 + 水2、酸+金属 = 盐 + 氢气思考:为什么不同的酸具有共同的化学性质呢?盐+水盐+水新盐+新酸盐+水CaCO3+2HCl=CaCl2+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑Ca (OH)2+2HCl = Ca Cl2+2H2O
Na OH+HCl = NaCl+H2OFe2O3+6HCl= 2FeCl3 + 3H2O
Fe2O3+3H2SO4= Fe2(SO4)3 + 3H2O2NaOH +SO2 = Na2SO3 +H2O
2NaOH +CO2 = Na2CO3 +H2O
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
