高中化学人教《选修一 化学与生活》3.2 金属的腐蚀与防护 课件 (共37张PPT)
文档属性
| 名称 | 高中化学人教《选修一 化学与生活》3.2 金属的腐蚀与防护 课件 (共37张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-17 00:00:00 | ||
图片预览











文档简介
课件37张PPT。第三章:探索生活材料
第2节:金属的腐蚀和防护
铁锈斑斑,让人心酸;导入:铜器表面生成一层薄薄的铜绿[铜绿的主要成分是Cu2(OH)2CO3]钢铁生锈,大桥断裂!金属腐蚀的危害,惊心动魄 据有关专家介绍,全球每一分钟就有1吨钢腐蚀成铁锈,目前我国由于金属材料的腐蚀损失每年大约5000亿元人民币,约占我国国民生产总值的6%左右。 第二节金属的腐蚀与防护一、金属的腐蚀 指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。1、定义:2、本质:金属失去电子被氧化M - ne- = Mn+3、分类:化学腐蚀电化学腐蚀根据接触的介质和反应原理可分为 金属跟接触到的物质(如O2、CI2、SO2等)直接发生化学反应而引起的腐蚀 定义:影响因素:金属的活泼性
环境的温度
氧化剂浓度等化学腐蚀原理:氧化还原反应例如:铁与氯气直接反应而被腐蚀钢管被原油中的含硫化合物腐蚀左边家用燃气灶的中心部位很容易生锈,而右边的食品罐头放在南极90多年了,却很少生锈升温可加快金属腐蚀温度对化学腐蚀的影响: 升温加快金属腐蚀
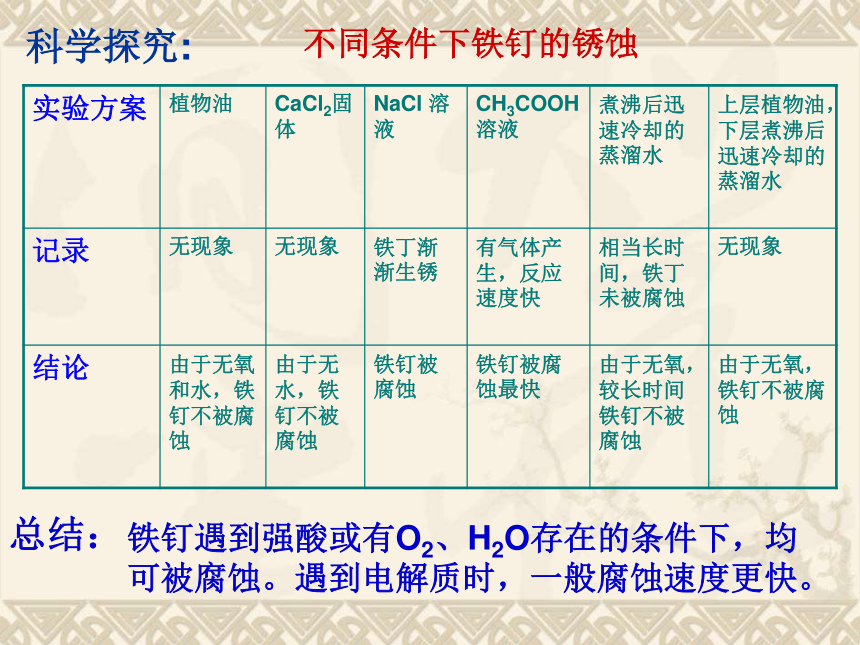
降温减慢金属腐蚀不同条件下铁钉的锈蚀科学探究:总结:铁钉遇到强酸或有O2、H2O存在的条件下,均可被腐蚀。遇到电解质时,一般腐蚀速度更快。电化学腐蚀定义:不纯的金属(或合金)跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化。原理:原电池反应本质:氧化还原反应例如:钢铁在潮湿的空气中被腐蚀复习:原电池反应原理 1.有电解质溶液
2.有活泼性不同的两种金属
(或其中一种是非金属)
3.闭合电路电极判断:比较活泼的一极是负极比较不活泼的是正极条件钢铁的腐蚀为什么钢铁在潮湿的空气中更容易腐蚀?原因:空气中溶解CO2的水分酸性增强(形成电解质溶液)Fe和C构成原电池的两极Fe:负C:正形成了原电池加快金属的腐蚀 负极: Fe – 2e- = Fe2+
正极: 2H+ + 2e- = H2↑
电极反应:电解质溶液呈弱酸性、中性、碱性时:负极: Fe – 2e- = Fe2+
正极: 2H2O + O2 + 4 e- = 4OH–
(1) 吸氧腐蚀电解质溶液呈较强酸性时(2) 析氢腐蚀化学腐蚀与电化学腐蚀的比较 化学腐蚀电化学腐蚀条件现象本质相互
联系金属跟氧化性物质
直接接触不纯金属或合金跟电解质溶液及氧化剂接触无电流产生有微弱电流产生金属被氧化较活泼金属被氧化两者往往同时发生,电化腐蚀更普遍
注意:(1)电化腐蚀是通过构成无数微小的原电池而发生的,作为负极的较活泼金属将不断被腐蚀。而不活泼的金属(或非金属或其它杂质)则被保护。
(2)电化学腐蚀,只有当金属跟电解质溶液接触时,才会发生,并伴有微电流产生。
(3)升温、原电池反应都可加快金属腐蚀海边的铁制品比较容易生锈,为什么?1、请你预测一下,铁在月球上会不会生锈?为什么? 月球上没有空气(目前尚不确定是否存在水),所以铁在月球上不会生锈2、在新疆吐鲁番和海南省两地,哪个地区铁生锈相对慢一些?为什么? 新疆吐鲁番空气干燥,铁生锈相对慢一些二、金属的防护1、影响金属腐蚀的因素 ①本性
金属越活泼,就越容易失去电子而被腐蚀,如果金属中能导电的杂质不如该金属活泼,则容易形成原电池而使金属发生电化学腐蚀。
②介质
金属在潮湿的空气中、接触腐蚀性气体或电解质溶液,都容易被腐蚀。 2、金属防护的常用方法——排除造成腐蚀的因素(1)在金属表面覆盖保护层,如:涂油漆、镀Zn、镀Sn、镀Cr等,或制成氧化膜。
(2)在要保护的金属上连接一种比该金属更易失去电子的金属。
(3)改变金属的内部组织结构,如:将钢铁制成不锈钢。 自行车如何防生锈? 为了防止自行车的金属构件生锈,主要采取在金属构件的表面上加防护层的方法。例如:在链条和齿轮上涂机油,在车架和挡泥板上烤一层漆,将车座弹簧用一层“烤蓝”(Fe3O4保护层)保护,将车把、钢圈和车辐条进行电镀(车把、钢圈一般采用三层电镀:底层镀铜,中间镀镍,表层镀铬,车辐条表面一般镀锌),等等。此外,用不锈钢制作车辐条,用铝合金代替钢铁制作一些构件也是防止自行车的金属构件生锈的常用方法。健身器材如何防锈?刷油漆衣架和电线如何防锈?外面包上一层塑料层某些工具的“机械传动部位” ,能用油漆来防锈吗?不能用油漆来防锈,而是选用油脂应选用什么呢?船身如何防腐蚀的?用牺牲锌块的方法来保护船身上装锌块 如何防止地下钢铁管道的腐蚀?用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块要定期更换1、给你一块铁,请你设法对它进行防护思考与交流(1)保持表面干燥 (2)涂油、漆 (3)镀锌(白铁桶) (4)镀锡(马口铁) (5)合金 2、假如你是设计师,正计划用钢材在杭州西湖内建造能使用20年左右的一座大桥,有三种防锈措施供选择,你优先选择哪种方法?各种方法有什么优、缺点?
(1)涂上油漆
(2)使用镀铬的钢
(3)使用不锈钢 方法(1)的优点是成本较高,缺点是油漆层容易脱落,保护作用一般,不太适合大桥要使用多年的要求,而且也不适合在风景区使用。 方法(2)的优点是保护作用优良,外表美观,适合在风景区使用。 方法(3)的优点是保护作用优良,外表美观,但成本较高,应酌情考虑。练习1.下列方法可用于金属防护的是( )
①原电池反应 ②涂油漆 ③电镀 ④置于干燥环境
A.①③④ B.①②③
C.②③④ D.全部D2.有关金属腐蚀的论述,正确的是( )
A.金属的腐蚀一定伴有电流产生
B.Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀
C.发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀
D.发生电化腐蚀时都有能量的转变,且被腐蚀的金属总是失电子D3、如图, 水槽中试管内有一枚铁钉,放置数天观察: 若液面下降,则溶液呈________性,发生_________腐蚀,电极反应式为: 负极:__________________________,
正极:_________________________________ (1)(2)若液面上升,则溶液呈____________性,发生________腐蚀,电极反应式为: 负极:____________________________,
正极:_______________________________中或碱 吸氧Fe–2e- =Fe2+O2+2H2O+4e- =4OH-酸析氢Fe–2e-=Fe2+2H++2e- =H2↑ 钢铁的吸氧腐蚀示意图
第2节:金属的腐蚀和防护
铁锈斑斑,让人心酸;导入:铜器表面生成一层薄薄的铜绿[铜绿的主要成分是Cu2(OH)2CO3]钢铁生锈,大桥断裂!金属腐蚀的危害,惊心动魄 据有关专家介绍,全球每一分钟就有1吨钢腐蚀成铁锈,目前我国由于金属材料的腐蚀损失每年大约5000亿元人民币,约占我国国民生产总值的6%左右。 第二节金属的腐蚀与防护一、金属的腐蚀 指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。1、定义:2、本质:金属失去电子被氧化M - ne- = Mn+3、分类:化学腐蚀电化学腐蚀根据接触的介质和反应原理可分为 金属跟接触到的物质(如O2、CI2、SO2等)直接发生化学反应而引起的腐蚀 定义:影响因素:金属的活泼性
环境的温度
氧化剂浓度等化学腐蚀原理:氧化还原反应例如:铁与氯气直接反应而被腐蚀钢管被原油中的含硫化合物腐蚀左边家用燃气灶的中心部位很容易生锈,而右边的食品罐头放在南极90多年了,却很少生锈升温可加快金属腐蚀温度对化学腐蚀的影响: 升温加快金属腐蚀
降温减慢金属腐蚀不同条件下铁钉的锈蚀科学探究:总结:铁钉遇到强酸或有O2、H2O存在的条件下,均可被腐蚀。遇到电解质时,一般腐蚀速度更快。电化学腐蚀定义:不纯的金属(或合金)跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化。原理:原电池反应本质:氧化还原反应例如:钢铁在潮湿的空气中被腐蚀复习:原电池反应原理 1.有电解质溶液
2.有活泼性不同的两种金属
(或其中一种是非金属)
3.闭合电路电极判断:比较活泼的一极是负极比较不活泼的是正极条件钢铁的腐蚀为什么钢铁在潮湿的空气中更容易腐蚀?原因:空气中溶解CO2的水分酸性增强(形成电解质溶液)Fe和C构成原电池的两极Fe:负C:正形成了原电池加快金属的腐蚀 负极: Fe – 2e- = Fe2+
正极: 2H+ + 2e- = H2↑
电极反应:电解质溶液呈弱酸性、中性、碱性时:负极: Fe – 2e- = Fe2+
正极: 2H2O + O2 + 4 e- = 4OH–
(1) 吸氧腐蚀电解质溶液呈较强酸性时(2) 析氢腐蚀化学腐蚀与电化学腐蚀的比较 化学腐蚀电化学腐蚀条件现象本质相互
联系金属跟氧化性物质
直接接触不纯金属或合金跟电解质溶液及氧化剂接触无电流产生有微弱电流产生金属被氧化较活泼金属被氧化两者往往同时发生,电化腐蚀更普遍
注意:(1)电化腐蚀是通过构成无数微小的原电池而发生的,作为负极的较活泼金属将不断被腐蚀。而不活泼的金属(或非金属或其它杂质)则被保护。
(2)电化学腐蚀,只有当金属跟电解质溶液接触时,才会发生,并伴有微电流产生。
(3)升温、原电池反应都可加快金属腐蚀海边的铁制品比较容易生锈,为什么?1、请你预测一下,铁在月球上会不会生锈?为什么? 月球上没有空气(目前尚不确定是否存在水),所以铁在月球上不会生锈2、在新疆吐鲁番和海南省两地,哪个地区铁生锈相对慢一些?为什么? 新疆吐鲁番空气干燥,铁生锈相对慢一些二、金属的防护1、影响金属腐蚀的因素 ①本性
金属越活泼,就越容易失去电子而被腐蚀,如果金属中能导电的杂质不如该金属活泼,则容易形成原电池而使金属发生电化学腐蚀。
②介质
金属在潮湿的空气中、接触腐蚀性气体或电解质溶液,都容易被腐蚀。 2、金属防护的常用方法——排除造成腐蚀的因素(1)在金属表面覆盖保护层,如:涂油漆、镀Zn、镀Sn、镀Cr等,或制成氧化膜。
(2)在要保护的金属上连接一种比该金属更易失去电子的金属。
(3)改变金属的内部组织结构,如:将钢铁制成不锈钢。 自行车如何防生锈? 为了防止自行车的金属构件生锈,主要采取在金属构件的表面上加防护层的方法。例如:在链条和齿轮上涂机油,在车架和挡泥板上烤一层漆,将车座弹簧用一层“烤蓝”(Fe3O4保护层)保护,将车把、钢圈和车辐条进行电镀(车把、钢圈一般采用三层电镀:底层镀铜,中间镀镍,表层镀铬,车辐条表面一般镀锌),等等。此外,用不锈钢制作车辐条,用铝合金代替钢铁制作一些构件也是防止自行车的金属构件生锈的常用方法。健身器材如何防锈?刷油漆衣架和电线如何防锈?外面包上一层塑料层某些工具的“机械传动部位” ,能用油漆来防锈吗?不能用油漆来防锈,而是选用油脂应选用什么呢?船身如何防腐蚀的?用牺牲锌块的方法来保护船身上装锌块 如何防止地下钢铁管道的腐蚀?用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块要定期更换1、给你一块铁,请你设法对它进行防护思考与交流(1)保持表面干燥 (2)涂油、漆 (3)镀锌(白铁桶) (4)镀锡(马口铁) (5)合金 2、假如你是设计师,正计划用钢材在杭州西湖内建造能使用20年左右的一座大桥,有三种防锈措施供选择,你优先选择哪种方法?各种方法有什么优、缺点?
(1)涂上油漆
(2)使用镀铬的钢
(3)使用不锈钢 方法(1)的优点是成本较高,缺点是油漆层容易脱落,保护作用一般,不太适合大桥要使用多年的要求,而且也不适合在风景区使用。 方法(2)的优点是保护作用优良,外表美观,适合在风景区使用。 方法(3)的优点是保护作用优良,外表美观,但成本较高,应酌情考虑。练习1.下列方法可用于金属防护的是( )
①原电池反应 ②涂油漆 ③电镀 ④置于干燥环境
A.①③④ B.①②③
C.②③④ D.全部D2.有关金属腐蚀的论述,正确的是( )
A.金属的腐蚀一定伴有电流产生
B.Fe在干燥的氯气里比在潮湿的空气里更易被腐蚀
C.发生化学能转变为电能的腐蚀时较活泼的金属总是作正极而被腐蚀
D.发生电化腐蚀时都有能量的转变,且被腐蚀的金属总是失电子D3、如图, 水槽中试管内有一枚铁钉,放置数天观察: 若液面下降,则溶液呈________性,发生_________腐蚀,电极反应式为: 负极:__________________________,
正极:_________________________________ (1)(2)若液面上升,则溶液呈____________性,发生________腐蚀,电极反应式为: 负极:____________________________,
正极:_______________________________中或碱 吸氧Fe–2e- =Fe2+O2+2H2O+4e- =4OH-酸析氢Fe–2e-=Fe2+2H++2e- =H2↑ 钢铁的吸氧腐蚀示意图
