九年级科学上册第一章第3节 常见的酸
图片预览



文档简介
第一章
第3节
常见的酸
知识导航
第3节
常见的酸
酸和碱都有腐蚀性,使用时一定要小心!
提示:闻溶液气味的方法是:用手在瓶口轻轻扇动,使少许气体飘进鼻孔(如下图
所示),千万不要直接凑近鼻子闻,因为这样做很危险!
知识点
1
盐酸──氯化氢气体的水溶液
1.浓盐酸是无色,有刺激性气味和酸味的液体,具有挥发性和腐蚀性。浓盐酸挥发出的氯化氢气体
遇空气中的水蒸气形成白雾(盐酸小液滴)。工业用浓盐酸因含有杂质
Fe3+而略带黄色。
2.盐酸能与
AgNO3、CaCO3
等反应
AgNO3
+
HCl
=AgCl↓+
HNO3
CaCO3
+
2HCl=CaCl2
+
CO2↑+
H2O
注:AgCl是不溶于水或酸的白色沉淀,所以硝酸银溶液可以用于检验盐酸或氯离子的存在。
3.盐酸能与金属氧化物反应。
Fe2O3
+
6HCl=2FeCl3
+
3H2O
CuO
+
2HCl=CuCl2
+
H2O
应用:在工业上,可利用该性质除去金属表面的锈
4.酸能与某些金属反应,生成氢气
2Al+6HCl=2AlCl3+3H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
例题1
下列说法正确的是(
)
①浓盐酸会在空气中形成白烟
②液态氯化氢就是盐酸
③盐酸遇石蕊变红
④浓盐酸受热易分解
A.①
B.②和③
C.③和④
D.都不对
答案:D
例题2
向试管中放入几小块镁片,
把试管固定在盛有饱和石灰水(
25℃)
的烧杯中,
再向试
管中滴入约
5mL
盐酸,
如图所示.
请回答:
(
1)
实验中观察到的明显现象有:
①剧烈反应,
有气泡产生;
②镁条逐渐溶解;
③
.
(
2)
产生上述现象③的原因是:
①
;
②
.
(
3)
写出相关的化学反应方程式:
.
答案
:(
1)饱和石灰水变浑浊
(
2)镁和盐酸反应放出大量的热
氢氧化钙的溶解度随
着温度的升高而减小
(
3)
Mg+2HCl=MgCl2+H2↑
知识点
2
硫酸
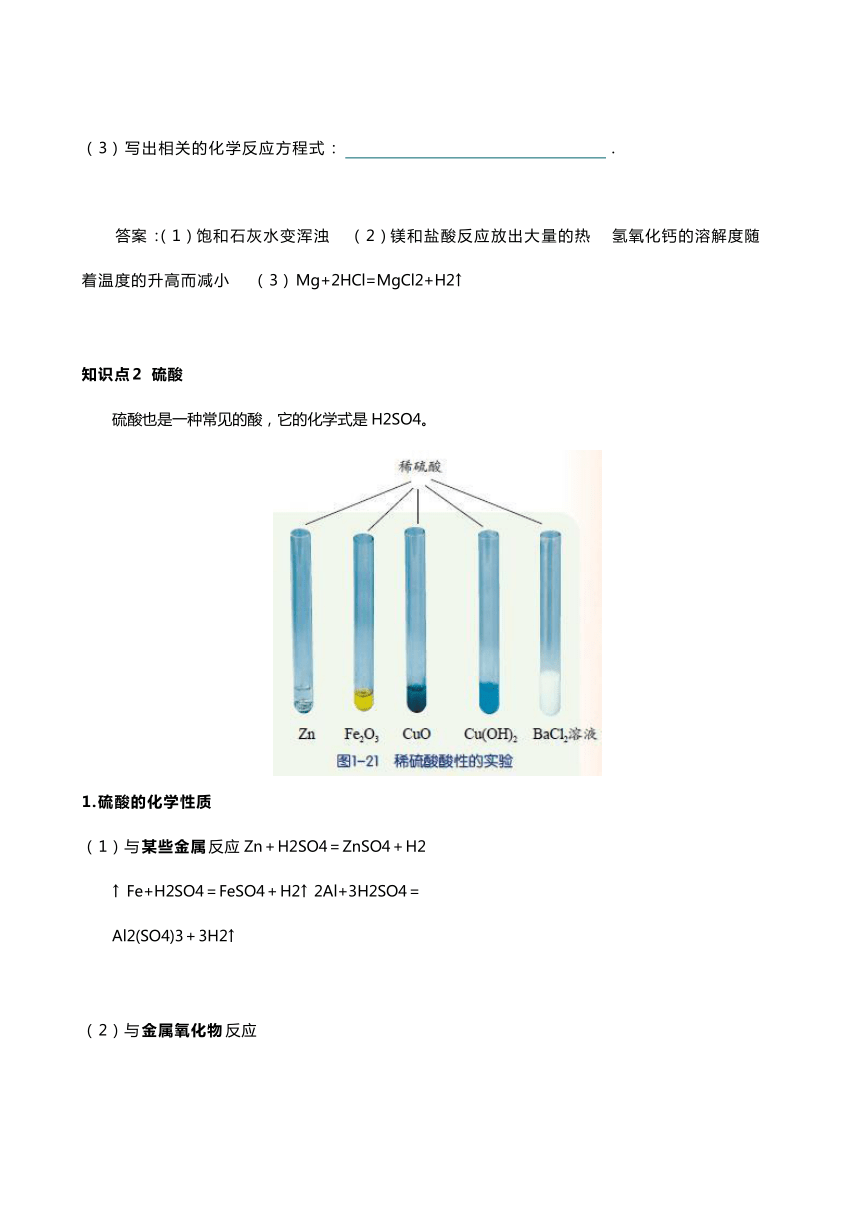
硫酸也是一种常见的酸,它的化学式是
H2SO4。
1.硫酸的化学性质
(
1)与
某些金属
反应
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
(
2)与
金属氧化物
反应
H2SO4+CuO=CuSO4+H2O
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(3)与碱反应
H2SO4+Cu(OH)2=CuSO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
(4)与
BaCl2
反应
BaCl2
+
H2SO4
=
BaSO4↓
+
2HCl
浓硫酸
纯硫酸是无色、黏稠、油状的液体,不容易挥发。常用的浓硫酸中
H2SO4
的质量分数为
98%。
密度为
1.84g/mL。
(
实验
放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
纸上出现黑色字迹
用小木条蘸少量浓硫酸
小木条逐渐变黑
将浓硫酸滴到布上
布逐渐变黑并出现小洞
)(1)浓硫酸有很强的腐蚀性,做实验时必须小心操作。如果浓硫酸不慎溅到皮肤上,要先用干布
拭去,然后用大量清水冲洗,最后用小苏打溶液冲洗,严重时应立即送医院。
(2)浓硫酸还具有脱水性,脱水性是指将原物质中的H、O两种元素按2:1的原子个数比的比例脱
去,是化学变化。植物纤维(如棉花、麻、造纸的木纤维)、人的皮肤等含有碳、氢、氧3种元素,浓硫
酸能把其中的氢元素和氧元素“脱出”结合成水。
(3)浓硫酸还能直接吸收空气中的水分,具有吸水性(物理变化)。因此,实验室常用浓硫酸做干燥
剂,用来干燥氧气、氢气、二氧化碳等气体。但不可用来干燥氨气、硫化氢等气体,因为浓硫酸可以与
它们反应。
注:浓硫酸暴露在空气中,能吸收空气中的水蒸气,使溶液的浓度变小,溶液质量增加,故浓硫酸
贮存时需要密封保存。
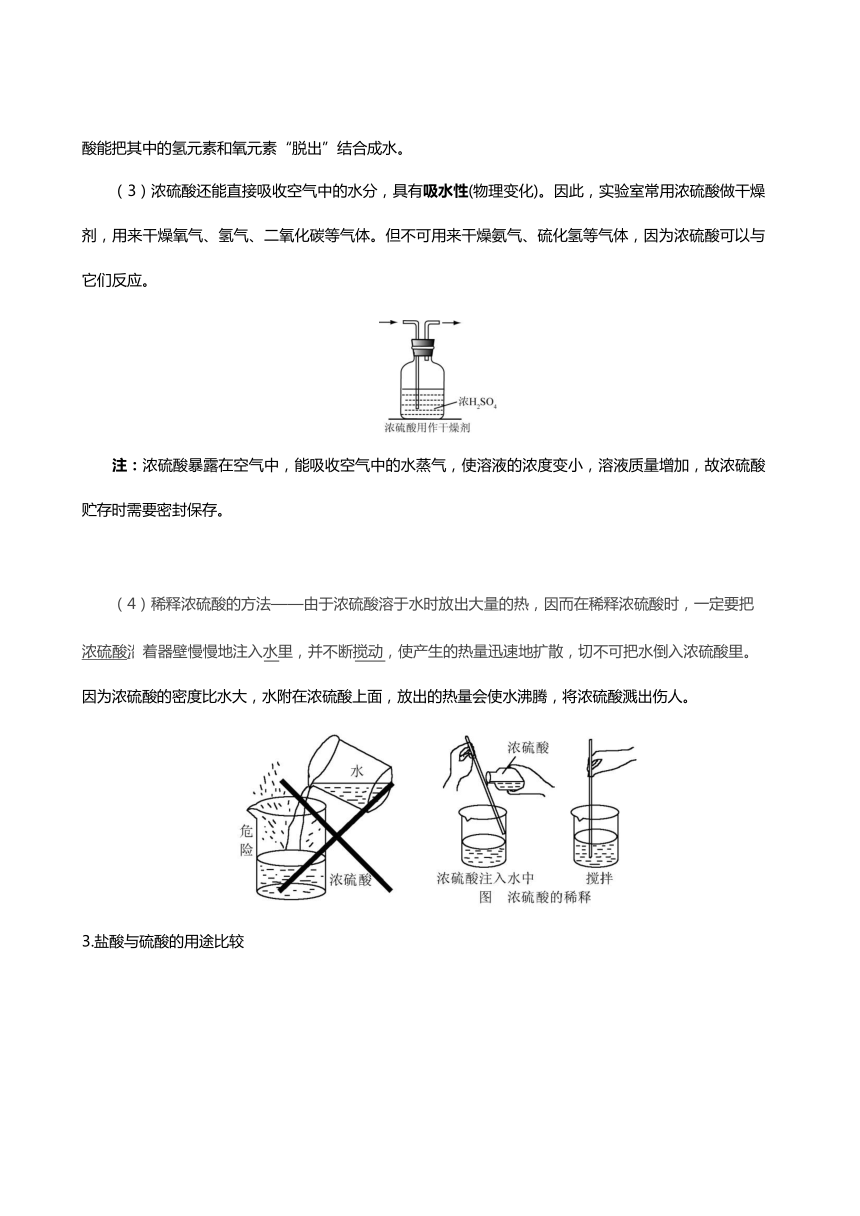
(4)稀释浓硫酸的方法——由于浓硫酸溶于水时放出大量的热,因而在稀释浓硫酸时,一定要把
浓硫酸沿
着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
因为浓硫酸的密度比水大,水附在浓硫酸上面,放出的热量会使水沸腾,将浓硫酸溅出伤人。
3.盐酸与硫酸的用途比较
4.硝酸也是一种在工业上有着广泛用途的强酸,它也有很强的腐蚀性,化学式是HNO3。硝酸具有挥发
性,且见光易分解,所以需要密封在棕色的试剂瓶中。
例题
3
实验室常用浓硫酸做某些气体的干燥剂,这是利用浓硫酸的(
)
A.腐蚀性
B.脱水性
C.吸水性
D.氧化性
答案:C
【提升】有酸参加的化学反应,溶液的颜色变化有4种情况:
(1)溶液由无色变为浅绿色:生成含Fe2+的溶液,如Fe与稀盐酸、稀硫酸反应后生成的溶液为浅
绿色。
(2)溶液由无色变为棕黄色:生成含的Fe3+溶液,如铁锈与与稀盐酸、稀硫酸反应后生成的溶液
为棕黄色。
(3)溶液由无色变为蓝色:生成含的Cu2+溶液,如氧化铜与与稀盐酸、稀硫酸反应后生成的溶液
为蓝色。
(4)溶液由无色变为红色:如紫色石蕊试液遇酸性溶液会变成红色;无色酚酞试液遇碱性溶液也
会变成红色。
【离子的鉴定】Cl-
和
SO42-
两种离子的鉴定
Cl-:先向待测液中滴加
AgNO3溶液,出现白色沉淀后再滴加稀
HNO3,沉淀不消失。
SO42-:先向待测液中滴加
Ba(NO3)2溶液,出现白色沉淀后再滴加稀
HNO3,沉淀不消失。
【酸的性质】(1)与指示剂反应
紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸
+
活泼金属
=
盐
+
氢气。
(3)酸
+
某些金属氧化物
=
盐
+
水。
(4)酸
+
碱
=
盐
+
水。
(5)酸
+
盐
=
新盐
+
新酸。
巩固练习
【练1】下列对实验意外事故处理错误的是(
)
A.若不慎将燃着的酒精灯碰倒,洒出的酒精在桌上燃烧,应立刻用湿抹布扑盖
B.若不慎将腐蚀性药液溅入眼睛,要先用手揉眼睛,再立即用水冲洗
C.若不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上
3%~5%的碳酸氢钠溶液
D.若不慎将玻璃仪器打碎,要赶紧把碎玻璃清理干净。
【练2】浓盐酸在空气中会形成白雾的原因是(
)
A.浓盐酸电离出氯离子
B.浓盐酸中挥发出的水蒸气形成了白雾
C.浓盐酸与空气中的二氧化碳反应,生成了碳酸小液滴
D,浓盐酸中挥发出的氯化氢气体和空气中的水蒸气结合,形成了盐酸小液滴
【练
3】
厕所用清洁剂中含有盐
酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有
气体产生.这种气体是(
)
A.二氧化碳
B.
二
氧
化
硫
C.氢气
D.氧气
【练4】下列物质能与盐酸反应,但不能生成沉淀或气体的是(
)
A.碳酸钠
B.铁
C.硝酸银溶液
D.氧化铜
【练5】在实验室常用浓硫酸作干燥剂,这是利用浓硫酸的(
)
A.酸性
B.吸水性
C.脱水性
D.氧化性
【练6】下列关于浓硫酸的描述错误的是(
)
A.溶于水时放出大量的热
B.有强烈的腐蚀性
C.稀释浓硫酸时,切不可将水倒进浓硫酸中
D.可在量筒中用浓硫酸配制稀硫酸
【练7】下列物质的性质属于物理性质的是(
)
A.浓盐酸的挥发性
B.浓硫酸的脱水性
C.硝酸的氧化性
D.碳酸的不稳定性
【练8】(2015
嘉舟
24)对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸的
化学性质后,初步归纳出稀硫酸与其它物质相互反应的关系,如图所示“(
一”
表示相连的两种物质能发生反应,五个圈中的物质属于不同的类别)。
(1)已知
X
是金属单质,则
X
可以是
。(填一种即可)
(2)请写出稀硫酸与
Y
反应的一个化学方程式
。
【练9】化学是一门以实验为基
础的科学
,化学所取得的丰硕成果与实验的重要作用分不
开.结合下列实验仪器回答问题:
(1)写出指定仪器的名称:
A
;
E
.
(
2)上述仪器中稀释浓硫酸还缺少的玻璃仪器是
;
稀
释
浓
硫
酸
的
正
确
操
作
是
;
若不慎将浓硫酸沾到皮
肤上,应立即
,
然
后
涂
上
3%~
5%的
碳
酸
氢
钠
溶
液
.
请
写
出
碳
酸氢钠溶液与硫酸反应的化学方程式
.
【练10】实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究。请根据
要求回答问题:
(1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有
(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如下装置(脱脂棉团因喷有稀氢氧
化钠与酚酞混合液而呈红色)进行实验,实验过程中将观察到的现象是
,发生反应
的化学方程式为
。
(2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体产生。
据此现象可推知浓硝酸具有
(填一条化学性质)。
(3)通过上述两个实验可知,实验室应如何保存浓硝酸?
答:
。
答案:1~7
BDADB
DA
(
10
)
8.(1)Zn、Fe
等活泼金属
(2)H2SO4+BaCl2=BaSO4↓
9.(
1)
量筒
;
酒精灯
.(
2)
玻璃棒
;
将浓硫酸沿着烧杯壁慢慢注入水中
,
并不断用玻璃棒
搅拌
.
用大量水洗
,
2NaHCO3
+H2
SO4
═Na2
SO4
+2H2
O+2CO2
↑
10.
(
11
)
第3节
常见的酸
知识导航
第3节
常见的酸
酸和碱都有腐蚀性,使用时一定要小心!
提示:闻溶液气味的方法是:用手在瓶口轻轻扇动,使少许气体飘进鼻孔(如下图
所示),千万不要直接凑近鼻子闻,因为这样做很危险!
知识点
1
盐酸──氯化氢气体的水溶液
1.浓盐酸是无色,有刺激性气味和酸味的液体,具有挥发性和腐蚀性。浓盐酸挥发出的氯化氢气体
遇空气中的水蒸气形成白雾(盐酸小液滴)。工业用浓盐酸因含有杂质
Fe3+而略带黄色。
2.盐酸能与
AgNO3、CaCO3
等反应
AgNO3
+
HCl
=AgCl↓+
HNO3
CaCO3
+
2HCl=CaCl2
+
CO2↑+
H2O
注:AgCl是不溶于水或酸的白色沉淀,所以硝酸银溶液可以用于检验盐酸或氯离子的存在。
3.盐酸能与金属氧化物反应。
Fe2O3
+
6HCl=2FeCl3
+
3H2O
CuO
+
2HCl=CuCl2
+
H2O
应用:在工业上,可利用该性质除去金属表面的锈
4.酸能与某些金属反应,生成氢气
2Al+6HCl=2AlCl3+3H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
例题1
下列说法正确的是(
)
①浓盐酸会在空气中形成白烟
②液态氯化氢就是盐酸
③盐酸遇石蕊变红
④浓盐酸受热易分解
A.①
B.②和③
C.③和④
D.都不对
答案:D
例题2
向试管中放入几小块镁片,
把试管固定在盛有饱和石灰水(
25℃)
的烧杯中,
再向试
管中滴入约
5mL
盐酸,
如图所示.
请回答:
(
1)
实验中观察到的明显现象有:
①剧烈反应,
有气泡产生;
②镁条逐渐溶解;
③
.
(
2)
产生上述现象③的原因是:
①
;
②
.
(
3)
写出相关的化学反应方程式:
.
答案
:(
1)饱和石灰水变浑浊
(
2)镁和盐酸反应放出大量的热
氢氧化钙的溶解度随
着温度的升高而减小
(
3)
Mg+2HCl=MgCl2+H2↑
知识点
2
硫酸
硫酸也是一种常见的酸,它的化学式是
H2SO4。
1.硫酸的化学性质
(
1)与
某些金属
反应
Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
(
2)与
金属氧化物
反应
H2SO4+CuO=CuSO4+H2O
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(3)与碱反应
H2SO4+Cu(OH)2=CuSO4+2H2O
H2SO4+2NaOH=Na2SO4+2H2O
(4)与
BaCl2
反应
BaCl2
+
H2SO4
=
BaSO4↓
+
2HCl
浓硫酸
纯硫酸是无色、黏稠、油状的液体,不容易挥发。常用的浓硫酸中
H2SO4
的质量分数为
98%。
密度为
1.84g/mL。
(
实验
放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上写字
纸上出现黑色字迹
用小木条蘸少量浓硫酸
小木条逐渐变黑
将浓硫酸滴到布上
布逐渐变黑并出现小洞
)(1)浓硫酸有很强的腐蚀性,做实验时必须小心操作。如果浓硫酸不慎溅到皮肤上,要先用干布
拭去,然后用大量清水冲洗,最后用小苏打溶液冲洗,严重时应立即送医院。
(2)浓硫酸还具有脱水性,脱水性是指将原物质中的H、O两种元素按2:1的原子个数比的比例脱
去,是化学变化。植物纤维(如棉花、麻、造纸的木纤维)、人的皮肤等含有碳、氢、氧3种元素,浓硫
酸能把其中的氢元素和氧元素“脱出”结合成水。
(3)浓硫酸还能直接吸收空气中的水分,具有吸水性(物理变化)。因此,实验室常用浓硫酸做干燥
剂,用来干燥氧气、氢气、二氧化碳等气体。但不可用来干燥氨气、硫化氢等气体,因为浓硫酸可以与
它们反应。
注:浓硫酸暴露在空气中,能吸收空气中的水蒸气,使溶液的浓度变小,溶液质量增加,故浓硫酸
贮存时需要密封保存。
(4)稀释浓硫酸的方法——由于浓硫酸溶于水时放出大量的热,因而在稀释浓硫酸时,一定要把
浓硫酸沿
着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
因为浓硫酸的密度比水大,水附在浓硫酸上面,放出的热量会使水沸腾,将浓硫酸溅出伤人。
3.盐酸与硫酸的用途比较
4.硝酸也是一种在工业上有着广泛用途的强酸,它也有很强的腐蚀性,化学式是HNO3。硝酸具有挥发
性,且见光易分解,所以需要密封在棕色的试剂瓶中。
例题
3
实验室常用浓硫酸做某些气体的干燥剂,这是利用浓硫酸的(
)
A.腐蚀性
B.脱水性
C.吸水性
D.氧化性
答案:C
【提升】有酸参加的化学反应,溶液的颜色变化有4种情况:
(1)溶液由无色变为浅绿色:生成含Fe2+的溶液,如Fe与稀盐酸、稀硫酸反应后生成的溶液为浅
绿色。
(2)溶液由无色变为棕黄色:生成含的Fe3+溶液,如铁锈与与稀盐酸、稀硫酸反应后生成的溶液
为棕黄色。
(3)溶液由无色变为蓝色:生成含的Cu2+溶液,如氧化铜与与稀盐酸、稀硫酸反应后生成的溶液
为蓝色。
(4)溶液由无色变为红色:如紫色石蕊试液遇酸性溶液会变成红色;无色酚酞试液遇碱性溶液也
会变成红色。
【离子的鉴定】Cl-
和
SO42-
两种离子的鉴定
Cl-:先向待测液中滴加
AgNO3溶液,出现白色沉淀后再滴加稀
HNO3,沉淀不消失。
SO42-:先向待测液中滴加
Ba(NO3)2溶液,出现白色沉淀后再滴加稀
HNO3,沉淀不消失。
【酸的性质】(1)与指示剂反应
紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸
+
活泼金属
=
盐
+
氢气。
(3)酸
+
某些金属氧化物
=
盐
+
水。
(4)酸
+
碱
=
盐
+
水。
(5)酸
+
盐
=
新盐
+
新酸。
巩固练习
【练1】下列对实验意外事故处理错误的是(
)
A.若不慎将燃着的酒精灯碰倒,洒出的酒精在桌上燃烧,应立刻用湿抹布扑盖
B.若不慎将腐蚀性药液溅入眼睛,要先用手揉眼睛,再立即用水冲洗
C.若不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上
3%~5%的碳酸氢钠溶液
D.若不慎将玻璃仪器打碎,要赶紧把碎玻璃清理干净。
【练2】浓盐酸在空气中会形成白雾的原因是(
)
A.浓盐酸电离出氯离子
B.浓盐酸中挥发出的水蒸气形成了白雾
C.浓盐酸与空气中的二氧化碳反应,生成了碳酸小液滴
D,浓盐酸中挥发出的氯化氢气体和空气中的水蒸气结合,形成了盐酸小液滴
【练
3】
厕所用清洁剂中含有盐
酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有
气体产生.这种气体是(
)
A.二氧化碳
B.
二
氧
化
硫
C.氢气
D.氧气
【练4】下列物质能与盐酸反应,但不能生成沉淀或气体的是(
)
A.碳酸钠
B.铁
C.硝酸银溶液
D.氧化铜
【练5】在实验室常用浓硫酸作干燥剂,这是利用浓硫酸的(
)
A.酸性
B.吸水性
C.脱水性
D.氧化性
【练6】下列关于浓硫酸的描述错误的是(
)
A.溶于水时放出大量的热
B.有强烈的腐蚀性
C.稀释浓硫酸时,切不可将水倒进浓硫酸中
D.可在量筒中用浓硫酸配制稀硫酸
【练7】下列物质的性质属于物理性质的是(
)
A.浓盐酸的挥发性
B.浓硫酸的脱水性
C.硝酸的氧化性
D.碳酸的不稳定性
【练8】(2015
嘉舟
24)对知识的及时整理与归纳是学习科学的重要方法。某同学在学习了硫酸的
化学性质后,初步归纳出稀硫酸与其它物质相互反应的关系,如图所示“(
一”
表示相连的两种物质能发生反应,五个圈中的物质属于不同的类别)。
(1)已知
X
是金属单质,则
X
可以是
。(填一种即可)
(2)请写出稀硫酸与
Y
反应的一个化学方程式
。
【练9】化学是一门以实验为基
础的科学
,化学所取得的丰硕成果与实验的重要作用分不
开.结合下列实验仪器回答问题:
(1)写出指定仪器的名称:
A
;
E
.
(
2)上述仪器中稀释浓硫酸还缺少的玻璃仪器是
;
稀
释
浓
硫
酸
的
正
确
操
作
是
;
若不慎将浓硫酸沾到皮
肤上,应立即
,
然
后
涂
上
3%~
5%的
碳
酸
氢
钠
溶
液
.
请
写
出
碳
酸氢钠溶液与硫酸反应的化学方程式
.
【练10】实验室新进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究。请根据
要求回答问题:
(1)打开盛装浓硝酸的试剂瓶,立即观察到瓶口有白雾产生。据此可知,浓硝酸具有
(填一条物理性质)。为进一步证明浓硝酸具有该性质,兴趣小组设计如下装置(脱脂棉团因喷有稀氢氧
化钠与酚酞混合液而呈红色)进行实验,实验过程中将观察到的现象是
,发生反应
的化学方程式为
。
(2)将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体产生。
据此现象可推知浓硝酸具有
(填一条化学性质)。
(3)通过上述两个实验可知,实验室应如何保存浓硝酸?
答:
。
答案:1~7
BDADB
DA
(
10
)
8.(1)Zn、Fe
等活泼金属
(2)H2SO4+BaCl2=BaSO4↓
9.(
1)
量筒
;
酒精灯
.(
2)
玻璃棒
;
将浓硫酸沿着烧杯壁慢慢注入水中
,
并不断用玻璃棒
搅拌
.
用大量水洗
,
2NaHCO3
+H2
SO4
═Na2
SO4
+2H2
O+2CO2
↑
10.
(
11
)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
