人教版必修二 第二节 元素周期律原子核外电子排布和元素周期律(理科)教学课件共40张PPT(共40张PPT)
文档属性
| 名称 | 人教版必修二 第二节 元素周期律原子核外电子排布和元素周期律(理科)教学课件共40张PPT(共40张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-17 19:56:35 | ||
图片预览








文档简介
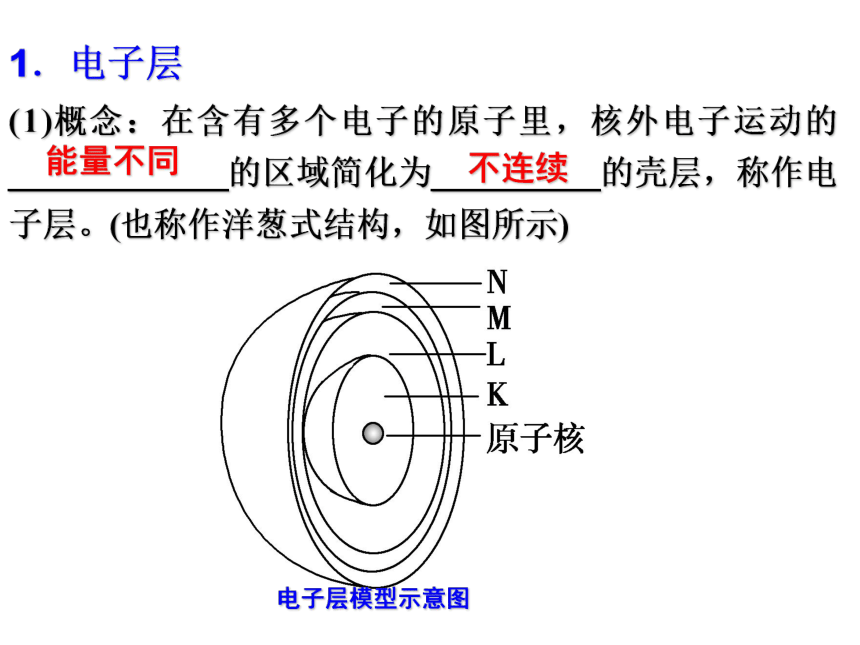
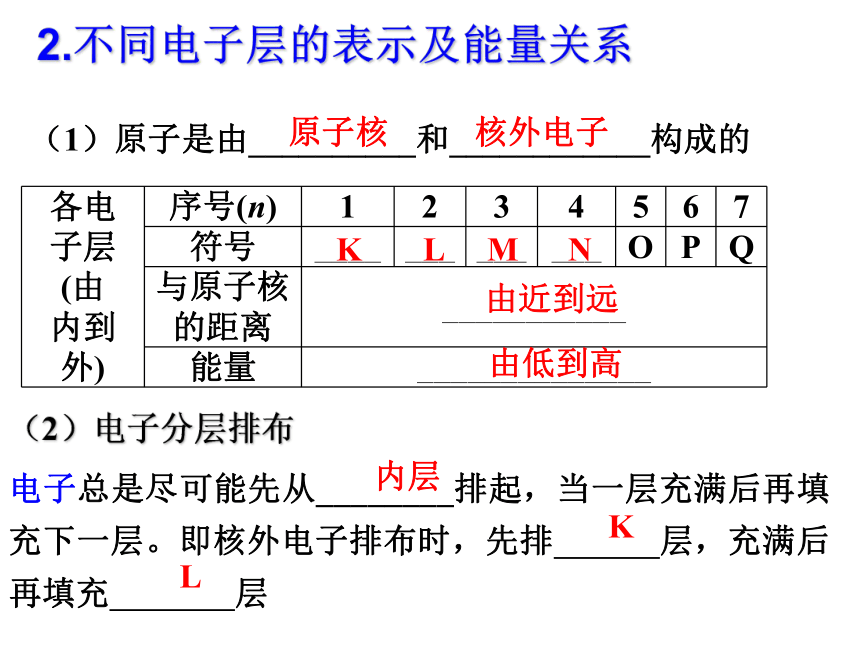
课件40张PPT。第二节 元素周期律?原子核外电子的排布洋 葱这是什么呢?(1)概念:在含有多个电子的原子里,核外电子运动的_____________的区域简化为__________的壳层,称作电子层。(也称作洋葱式结构,如图所示)能量不同不连续1.电子层电子层模型示意图KLMN由近到远由低到高2.不同电子层的表示及能量关系(1)原子是由__________和____________构成的原子核核外电子(2)电子分层排布
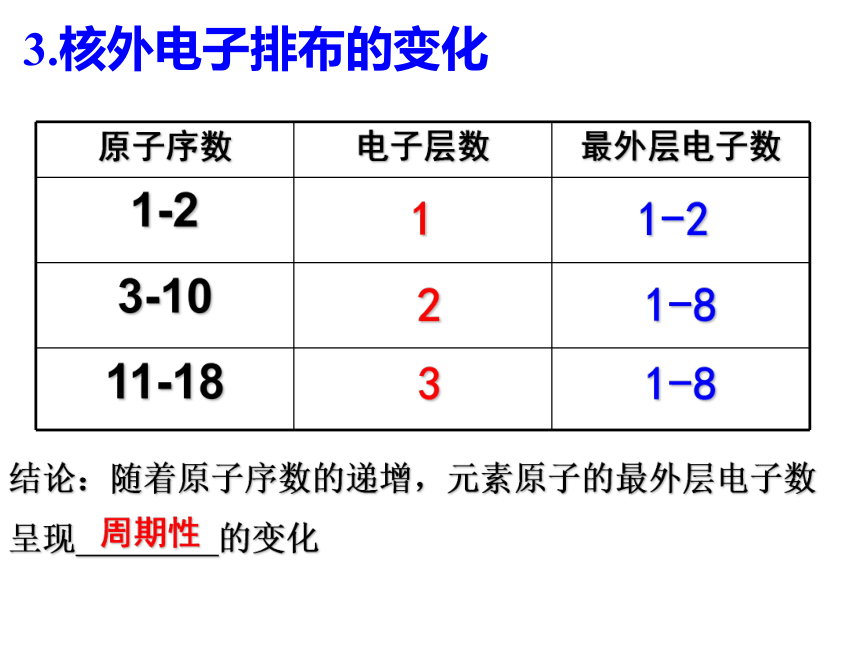
电子总是尽可能先从________排起,当一层充满后再填充下一层。即核外电子排布时,先排 层,充满后再填充 层内层KL3.核外电子排布的变化11-221-831-8结论:随着原子序数的递增,元素原子的最外层电子数
呈现 的变化周期性4.核外电子分层排布的一般规律2个8个18个2n2注意:(1)核外电子排布的规律是相互联系的,
如当M层不是最外层时,最多可以排布18个电子,
而当M层它是最外层时,最多可以排布8个电子。
(2)电子不一定排满M层才排N层,如K和Ca的核外电子排布情况分别为:Cl5.核外电子排布的表示方法BrX是什么元素?101011101、画出Li、K的原子结构示意图。
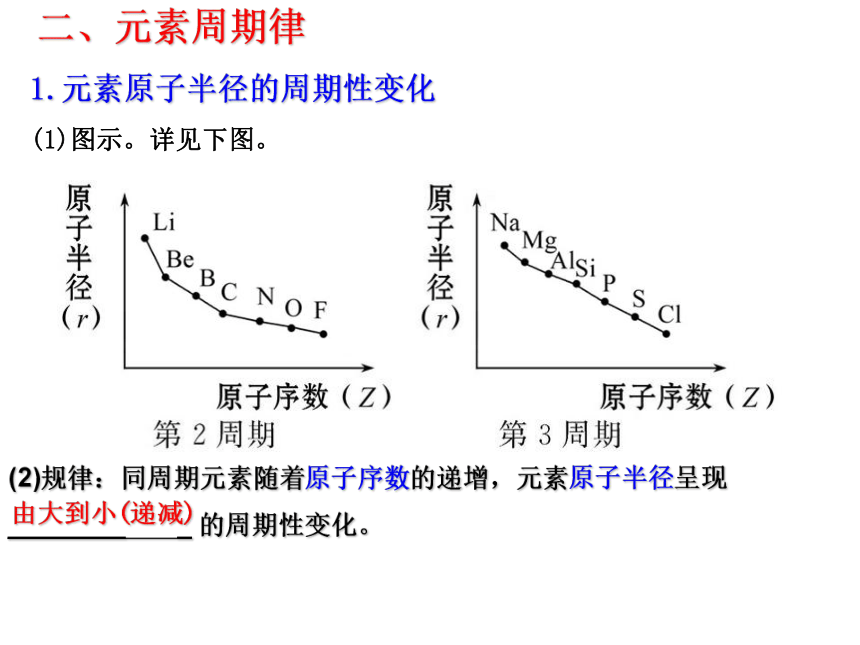
2、画出K+、 Cl-的离子结构示意图。元素周期律?Li Be B C N O F NeH He1. 课本P14 科学探究表格Na Mg Al Si P S Cl Ar1.元素原子半径的周期性变化
(1)图示。详见下图。
由大到小(递减)(2)规律:同周期元素随着原子序数的递增,元素原子半径呈现
________ _ 的周期性变化。 二、元素周期律2.原子的核外电子排布的变化规律
(1)图示。详见下图。1-8 (2)规律:随着原子序数的递增,元素原子的最外层电子数
呈现_______的周期性变化(第1周期除外)。 3.元素主要化合价的周期性变化
(1)图示。详见下图。
+1→+7-4→-1(2)规律:随着原子序数的递增,元素的最高正化合价呈现_______,
最低负化合价呈现_________的周期性变化。
(1)主族元素最高正化合价=_______=___________或_________。
(2)非金属元素的化合价
①最高正价等于原子所能失去或偏移的_____________。
②最低负价等于使它达到______稳定结构所需得到的电子数。族序数最外层电子价电子数最外层电子数8电子元素的化合价与元素在周期表中位置的关系a. 最低负化合价=最外层电子数-8b.最高正价+ |最低负价| = 8 (O、F除外)(2)核外电子排布与元素性质的关系元素的原子半径由________________决定
元素的化学性质主要由________________决定
元素的化合价主要由_________________决定质子数、电子层数最外层电子数最外层电子数第三周期元素为例对比同一周期的元素
金属性和非金属性的比较比较钠、镁、铝与水的反应(回忆钠与水的反应及现象)加热前有少量的气泡产生,加热后,有更多的气泡产生。滴加酚酞溶液溶液变浅红。要在高温下才能反应,反应现象不明显2Na+2H2O====2NaOH+H2↑有气泡产生,四处游动,迅速融化成小球,发出嘶嘶响声,反应剧烈想一想:
对比Na、Mg、AI与水反应所生成的碱,碱性由大到小的顺序: 。NaOH>Mg(OH)2>Al(OH)3实验二 比较钠、镁、铝与盐酸的反应铝条缓慢熔化,缓慢有气泡产生。镁条熔化,有气泡产生。Mg+2HCl====MgCl2+H2↑2Al+6HCl====2AlCl3+3H2↑金属钠迅速熔化,有气泡产生。2Na+2HCl====2NaCl+H2↑想一想:
对比Na、Mg、AI置换出水(或酸)中的氢时,由易到难的顺序: 。Na、Mg、AlNa、Mg、AlNaOH>Mg(OH)2>Al(OH)3Na>Mg>Al对比同周期的Na、Mg、Al金属性强弱的比较阅 读Cl、S、P、SiHClO4>H2SO4>H3PO4>H2SiO3Cl>S>P>Si(2)Si、P、S、Cl非金属性强弱的比较。总结:同周期元素性质的递变规律(自左至右)。
元素的金属性_____,非金属性_____。 减 弱增 强元素周期表中的递变规律 电子层数相同递增最外层电子数递增相同原子半径减小增大金属单质与水或
酸置换出H2的难易易→难难→易最高价氧化物
对应水化物酸性碱性增强减弱减弱增强非金属气
态氢化物形成难易稳定性难→易增强易→难减弱金属性
(还原性、失电子能力)非金属性
(氧化性、得电子能力)减弱增强增强减弱(1)内容:元素的性质随原子序数的递增而呈_______变化的规律。
(2)实质:元素性质周期性变化是______________周期性变化的结果。周期性原子核外电子排布5.元素周期律一、元素周期表和元素周期律的应用
1.根据元素在周期表中的位置推测其原子结构和性质。
2.根据元素的原子结构推测它在周期表中的位置。
3.指导新元素的发现及预测它们的原子结构和性质。 各区位置:分界线左下方为___________,分界线右上方为_____________。分界线附近元素的性质:既表现_________,又表现____________。金属元素区非金属元素区金属性非金属性1、元素的性质与元素在周期表中位置的关系增强增强增强增强非金属金属2.元素金属性和非金属性的递变规律FCs3.元素周期表和元素周期律的科学技术指导作用
阅读课本P18指导其他与化学相关的科学技术。
将下面左右两侧对应内容连线: 1.同周期
(1)规律:同周期,左→右,原子半径减小。
举例:第三周期中的元素
r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)
2.同主族
规律:同主族,上→下,原子(或离子)半径增大(1)r(Li)<r(Na)<r(K)<r(Rb)<r(Cs)
(2)r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)(1)比较Li、Na、K、Rb、Cs的原子半径大小
(2)比较Li+ 、 Na+ 、 K+ 、 Rb+ 、 Cs+的离子半径大小3.同元素
规律: r(阴)>r(原)>r(阳),
r(低价阳离子)>r(高价阳离子)练一练:Cl-和Cl,Na和Na+,Fe、Fe2+、Fe3+的原子(离子)半径大小r(Cl-)>r(Cl),
r(Na)>r(Na+),
r(Fe)>r(Fe2+)>r(Fe3+)阴大阳小4.同结构
(1)规律:电子层结构相同的离子,核电荷数越大,离子半径越小。r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)特别提醒:粒子半径大小比较是考试中的热点,通常题目中进行粒子大小比较时用以上“四同”比较即可,但有时用以上方法不能直接解决时,可借助参照物,练一练:O 2-、 F-、Na+、 Mg 2+、 Al 3+的离子半径的大小例如:比较K+、Mg 2+、Na+的离子半径大小r(K+)>r(Na+)>r(Mg 2+)变式训练3 下列微粒半径大小比较正确的是
( )
A.Na+<Mg2+<Al3+<O2-
B.S2->Cl->Na+>Al3+
C.Na< Na+
D.Cs<Rb<K<Na
B 1. (2011年高考天津卷改编题)以下有关原子结构及元素周期律的叙述正确的是( )
A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径减小
C.第ⅦA族元素从上到下,其氢化物的稳定性增强
D.同主族元素从上到下,金属性减弱B 2. (2010年高考广东卷)短周期金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断正确的是
( )
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
C1.请结合元素周期律分析,金属性和非金属性最强的分别是什么元素?
提示:由元素周期律可知:同一周期,随着原子序数的递增,金属性减弱,非金属性增强;同一主族,从上到下,金属性增强,非金属性减弱。所以金属性最强的元素位于元素周期表的左下角,非金属性最强的元素位于元素周期表的右上角,即金属性最强的应该为钫元素,但由于钫是放射性元素,在自然界中不能稳定存在,所以铯的金属性最强,氟的非金属性最强。1.(2011年大连高一检测)下列叙述正确的是( )
A.电子的能量越低,运动区域离原子核越远
B.核外电子的分层排布即是核外电子的分层运动
C.稀有气体元素原子的最外层都排有8个电子
D.当M层是最外层时,最多可排布18个电子B【解析】 A项,137Cs比133Cs多4个中子,两者质子数相等。C项,氢化物的稳定性随元素非金属性的增强而增强。D项,同主族元素从上到下,金属性增强。
【答案】 B
电子总是尽可能先从________排起,当一层充满后再填充下一层。即核外电子排布时,先排 层,充满后再填充 层内层KL3.核外电子排布的变化11-221-831-8结论:随着原子序数的递增,元素原子的最外层电子数
呈现 的变化周期性4.核外电子分层排布的一般规律2个8个18个2n2注意:(1)核外电子排布的规律是相互联系的,
如当M层不是最外层时,最多可以排布18个电子,
而当M层它是最外层时,最多可以排布8个电子。
(2)电子不一定排满M层才排N层,如K和Ca的核外电子排布情况分别为:Cl5.核外电子排布的表示方法BrX是什么元素?101011101、画出Li、K的原子结构示意图。
2、画出K+、 Cl-的离子结构示意图。元素周期律?Li Be B C N O F NeH He1. 课本P14 科学探究表格Na Mg Al Si P S Cl Ar1.元素原子半径的周期性变化
(1)图示。详见下图。
由大到小(递减)(2)规律:同周期元素随着原子序数的递增,元素原子半径呈现
________ _ 的周期性变化。 二、元素周期律2.原子的核外电子排布的变化规律
(1)图示。详见下图。1-8 (2)规律:随着原子序数的递增,元素原子的最外层电子数
呈现_______的周期性变化(第1周期除外)。 3.元素主要化合价的周期性变化
(1)图示。详见下图。
+1→+7-4→-1(2)规律:随着原子序数的递增,元素的最高正化合价呈现_______,
最低负化合价呈现_________的周期性变化。
(1)主族元素最高正化合价=_______=___________或_________。
(2)非金属元素的化合价
①最高正价等于原子所能失去或偏移的_____________。
②最低负价等于使它达到______稳定结构所需得到的电子数。族序数最外层电子价电子数最外层电子数8电子元素的化合价与元素在周期表中位置的关系a. 最低负化合价=最外层电子数-8b.最高正价+ |最低负价| = 8 (O、F除外)(2)核外电子排布与元素性质的关系元素的原子半径由________________决定
元素的化学性质主要由________________决定
元素的化合价主要由_________________决定质子数、电子层数最外层电子数最外层电子数第三周期元素为例对比同一周期的元素
金属性和非金属性的比较比较钠、镁、铝与水的反应(回忆钠与水的反应及现象)加热前有少量的气泡产生,加热后,有更多的气泡产生。滴加酚酞溶液溶液变浅红。要在高温下才能反应,反应现象不明显2Na+2H2O====2NaOH+H2↑有气泡产生,四处游动,迅速融化成小球,发出嘶嘶响声,反应剧烈想一想:
对比Na、Mg、AI与水反应所生成的碱,碱性由大到小的顺序: 。NaOH>Mg(OH)2>Al(OH)3实验二 比较钠、镁、铝与盐酸的反应铝条缓慢熔化,缓慢有气泡产生。镁条熔化,有气泡产生。Mg+2HCl====MgCl2+H2↑2Al+6HCl====2AlCl3+3H2↑金属钠迅速熔化,有气泡产生。2Na+2HCl====2NaCl+H2↑想一想:
对比Na、Mg、AI置换出水(或酸)中的氢时,由易到难的顺序: 。Na、Mg、AlNa、Mg、AlNaOH>Mg(OH)2>Al(OH)3Na>Mg>Al对比同周期的Na、Mg、Al金属性强弱的比较阅 读Cl、S、P、SiHClO4>H2SO4>H3PO4>H2SiO3Cl>S>P>Si(2)Si、P、S、Cl非金属性强弱的比较。总结:同周期元素性质的递变规律(自左至右)。
元素的金属性_____,非金属性_____。 减 弱增 强元素周期表中的递变规律 电子层数相同递增最外层电子数递增相同原子半径减小增大金属单质与水或
酸置换出H2的难易易→难难→易最高价氧化物
对应水化物酸性碱性增强减弱减弱增强非金属气
态氢化物形成难易稳定性难→易增强易→难减弱金属性
(还原性、失电子能力)非金属性
(氧化性、得电子能力)减弱增强增强减弱(1)内容:元素的性质随原子序数的递增而呈_______变化的规律。
(2)实质:元素性质周期性变化是______________周期性变化的结果。周期性原子核外电子排布5.元素周期律一、元素周期表和元素周期律的应用
1.根据元素在周期表中的位置推测其原子结构和性质。
2.根据元素的原子结构推测它在周期表中的位置。
3.指导新元素的发现及预测它们的原子结构和性质。 各区位置:分界线左下方为___________,分界线右上方为_____________。分界线附近元素的性质:既表现_________,又表现____________。金属元素区非金属元素区金属性非金属性1、元素的性质与元素在周期表中位置的关系增强增强增强增强非金属金属2.元素金属性和非金属性的递变规律FCs3.元素周期表和元素周期律的科学技术指导作用
阅读课本P18指导其他与化学相关的科学技术。
将下面左右两侧对应内容连线: 1.同周期
(1)规律:同周期,左→右,原子半径减小。
举例:第三周期中的元素
r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)
2.同主族
规律:同主族,上→下,原子(或离子)半径增大(1)r(Li)<r(Na)<r(K)<r(Rb)<r(Cs)
(2)r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)(1)比较Li、Na、K、Rb、Cs的原子半径大小
(2)比较Li+ 、 Na+ 、 K+ 、 Rb+ 、 Cs+的离子半径大小3.同元素
规律: r(阴)>r(原)>r(阳),
r(低价阳离子)>r(高价阳离子)练一练:Cl-和Cl,Na和Na+,Fe、Fe2+、Fe3+的原子(离子)半径大小r(Cl-)>r(Cl),
r(Na)>r(Na+),
r(Fe)>r(Fe2+)>r(Fe3+)阴大阳小4.同结构
(1)规律:电子层结构相同的离子,核电荷数越大,离子半径越小。r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)特别提醒:粒子半径大小比较是考试中的热点,通常题目中进行粒子大小比较时用以上“四同”比较即可,但有时用以上方法不能直接解决时,可借助参照物,练一练:O 2-、 F-、Na+、 Mg 2+、 Al 3+的离子半径的大小例如:比较K+、Mg 2+、Na+的离子半径大小r(K+)>r(Na+)>r(Mg 2+)变式训练3 下列微粒半径大小比较正确的是
( )
A.Na+<Mg2+<Al3+<O2-
B.S2->Cl->Na+>Al3+
C.Na< Na+
D.Cs<Rb<K<Na
B 1. (2011年高考天津卷改编题)以下有关原子结构及元素周期律的叙述正确的是( )
A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径减小
C.第ⅦA族元素从上到下,其氢化物的稳定性增强
D.同主族元素从上到下,金属性减弱B 2. (2010年高考广东卷)短周期金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断正确的是
( )
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
C1.请结合元素周期律分析,金属性和非金属性最强的分别是什么元素?
提示:由元素周期律可知:同一周期,随着原子序数的递增,金属性减弱,非金属性增强;同一主族,从上到下,金属性增强,非金属性减弱。所以金属性最强的元素位于元素周期表的左下角,非金属性最强的元素位于元素周期表的右上角,即金属性最强的应该为钫元素,但由于钫是放射性元素,在自然界中不能稳定存在,所以铯的金属性最强,氟的非金属性最强。1.(2011年大连高一检测)下列叙述正确的是( )
A.电子的能量越低,运动区域离原子核越远
B.核外电子的分层排布即是核外电子的分层运动
C.稀有气体元素原子的最外层都排有8个电子
D.当M层是最外层时,最多可排布18个电子B【解析】 A项,137Cs比133Cs多4个中子,两者质子数相等。C项,氢化物的稳定性随元素非金属性的增强而增强。D项,同主族元素从上到下,金属性增强。
【答案】 B
