人教版必修二3.3生活中常见的两种有机物 (共24张PPT)
文档属性
| 名称 | 人教版必修二3.3生活中常见的两种有机物 (共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-18 08:34:26 | ||
图片预览






文档简介
课件24张PPT。生活中两种常见的有机物乙醇的物理性质颜色:状态:气味:密度:沸点:溶解性:无色透明特殊香味液体比水小(20℃ 0.789 g/㎝3)能够溶解多种有机物和无机物
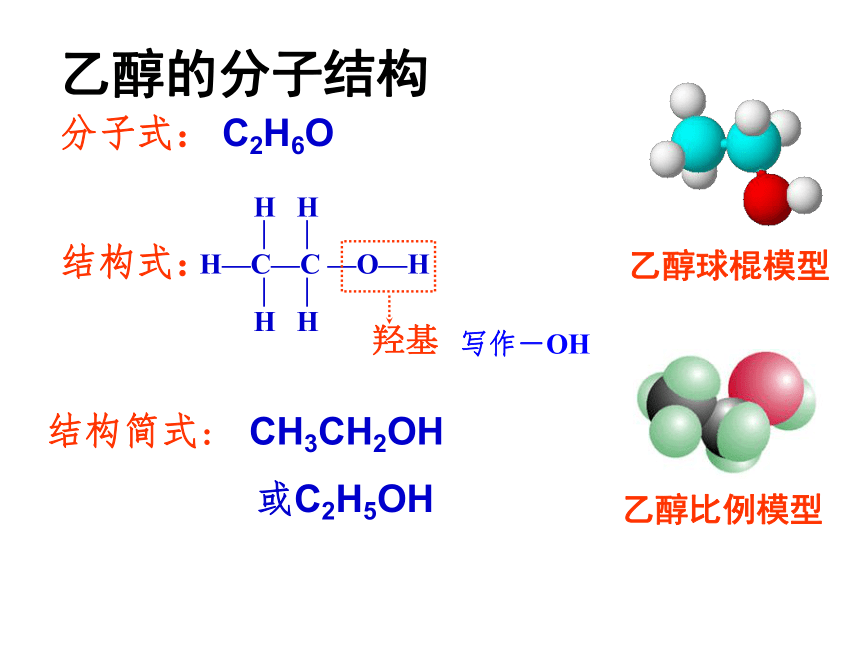
与水以任意比互溶78.5℃——易挥发熔点:–117.3℃乙醇的分子结构分子式:结构式:乙醇球棍模型羟基
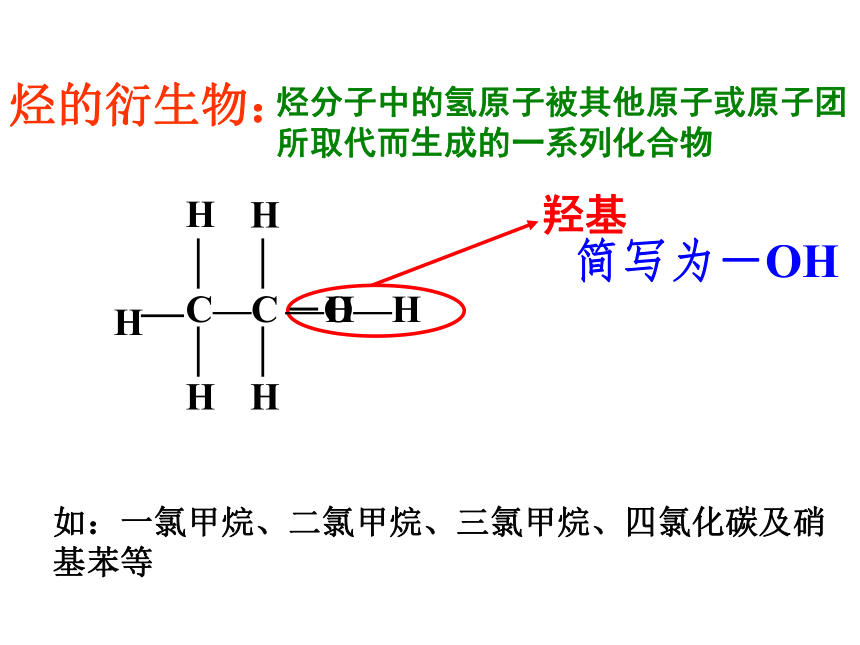
结构简式:CH3CH2OH或C2H5OHC2H6O写作-OH乙醇比例模型烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物如:一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳及硝基苯等烃的衍生物:C—CHHHHH 羟基 —O—H简写为-OHH — C — C —O — H ︳
H ︳
H H
︳ H
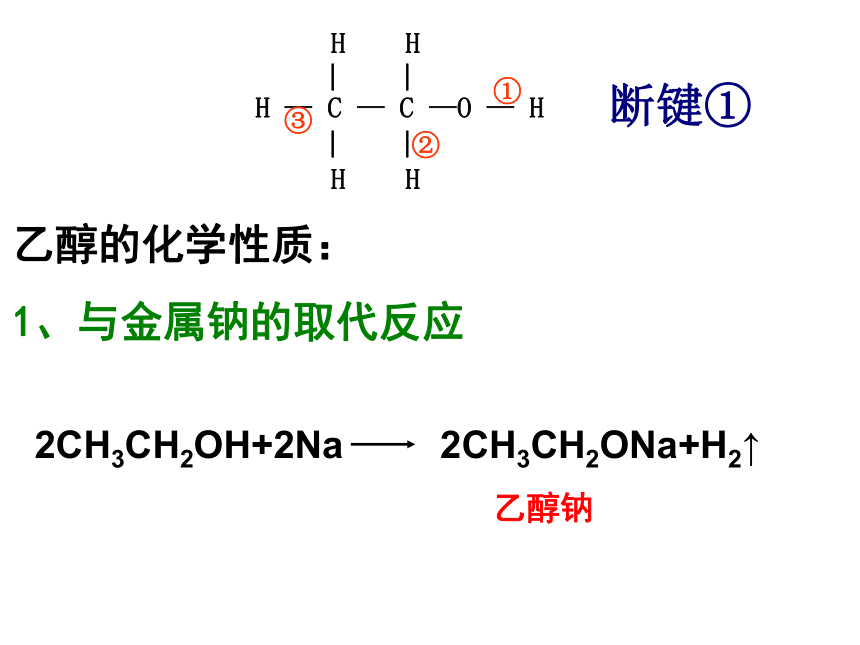
︳①②③断键①乙醇钠乙醇的化学性质:
1、与金属钠的取代反应 其它活泼金属如钾、钙等也可与乙醇反应练习:写出乙醇与钙反应的化学方程式2CH3CH2OH+Ca→(CH3CH2O)2Ca+H2↑钠与水、与乙醇反应对比(1)、二者均能反应放出氢气是由什么决定的?
(2)、从二者反应剧烈程度不同分析,乙醇和水分子的羟基中的H原子哪个较活泼?羟基中的H原子的活泼性:乙醇<水决定有机化合物的化学特性的原子或原子团官能团 如:卤素原子( -X)、羟基( -OH)、硝基( -NO2)、碳碳双键等羟基 用途:乙醇可用作内燃机的燃料,实验室里也常用它作为燃料。2、氧化反应(1)乙醇在空气中燃烧?: ①用小试管取2mL无水乙醇
②加热一端绕成螺旋状的铜丝至红热
③将铜丝趁热插到盛有乙醇的试管底部
④反复操作几次,观察铜丝颜色和液体
气味的变化a.铜丝红色→黑色→红色反复变化[实验现象]b.在试管口可以闻到刺激性气味红色→黑色黑色→红色总反应方程式:?乙醛
刺激性气味液体铜丝在实验中作催化剂 (2)乙醇催化氧化: 工业上利用此原理生产乙醛Cu或AgC2H6OC2H4O乙醇还可以与酸性高锰酸钾溶液或酸性重铬酸钾(K2Cr2O7)溶液反应,被直接氧化成乙酸①与活泼金属反应
②氧化反应——燃烧
——催化氧化
分子结构:
物理性质:
化学性质:
反应中乙醇断键位置官能团-OH 传说古代山西省有个酿酒高手叫杜康。他儿子黑塔跟父亲也学会了酿酒技术。后来,从山西迁到镇江。黑塔觉得酿酒后把酒糟扔掉可惜,把酒糟浸泡在水缸里。到了第二十一日的酉时,一开缸,一股浓郁的香气扑鼻而来。黑塔忍不住尝了一口,酸酸的,味道很美。烧菜时放了一些,味道特别鲜美,便贮藏着作为“调味酱”。乙酸俗称醋酸,是无色有强烈刺激性气味的液体,易溶于水和乙醇,沸点117.9℃,熔点16.6℃,温度低于熔点时凝结成冰一样的晶体,因此纯净的乙酸称为冰醋酸乙酸分子比例模型乙酸组成与结构C2H4O2CH3COOH简写为—COOH羧基乙酸的化学性质1、乙酸具有酸的通性酸性: 乙酸_____碳酸 2CH3COOH + CaCO3 = (CH3COO)2Ca+CO2↑ + H2O>(CH3COO)2Mg + H2 ↑(CH3COO)2Cu + 2H2O使紫色石蕊溶液变红水垢主要成分:CaCO3用醋除水壶中的水垢为什么呢? 厨师烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香醇,特别鲜美。为什么呢?浓硫酸作用:催化剂、吸水剂 饱和碳酸钠的作用:降低酯的溶解度,利于酯的分层析出;中和乙酸;吸收乙醇。2、乙酸的酯化反应-----酸和醇反应生成酯和水酯化反应实质:酸脱羟基醇脱氢小 结一.乙酸的物理性质
二.乙酸的分子结构
结构简式: 官能团:
三.乙酸的化学性质
1.乙酸的酸性:弱酸,其酸性大于碳酸
2.乙酸的酯化反应(取代) CH3COOH—COOH(羧基)
与水以任意比互溶78.5℃——易挥发熔点:–117.3℃乙醇的分子结构分子式:结构式:乙醇球棍模型羟基
结构简式:CH3CH2OH或C2H5OHC2H6O写作-OH乙醇比例模型烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物如:一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳及硝基苯等烃的衍生物:C—CHHHHH 羟基 —O—H简写为-OHH — C — C —O — H ︳
H ︳
H H
︳ H
︳①②③断键①乙醇钠乙醇的化学性质:
1、与金属钠的取代反应 其它活泼金属如钾、钙等也可与乙醇反应练习:写出乙醇与钙反应的化学方程式2CH3CH2OH+Ca→(CH3CH2O)2Ca+H2↑钠与水、与乙醇反应对比(1)、二者均能反应放出氢气是由什么决定的?
(2)、从二者反应剧烈程度不同分析,乙醇和水分子的羟基中的H原子哪个较活泼?羟基中的H原子的活泼性:乙醇<水决定有机化合物的化学特性的原子或原子团官能团 如:卤素原子( -X)、羟基( -OH)、硝基( -NO2)、碳碳双键等羟基 用途:乙醇可用作内燃机的燃料,实验室里也常用它作为燃料。2、氧化反应(1)乙醇在空气中燃烧?: ①用小试管取2mL无水乙醇
②加热一端绕成螺旋状的铜丝至红热
③将铜丝趁热插到盛有乙醇的试管底部
④反复操作几次,观察铜丝颜色和液体
气味的变化a.铜丝红色→黑色→红色反复变化[实验现象]b.在试管口可以闻到刺激性气味红色→黑色黑色→红色总反应方程式:?乙醛
刺激性气味液体铜丝在实验中作催化剂 (2)乙醇催化氧化: 工业上利用此原理生产乙醛Cu或AgC2H6OC2H4O乙醇还可以与酸性高锰酸钾溶液或酸性重铬酸钾(K2Cr2O7)溶液反应,被直接氧化成乙酸①与活泼金属反应
②氧化反应——燃烧
——催化氧化
分子结构:
物理性质:
化学性质:
反应中乙醇断键位置官能团-OH 传说古代山西省有个酿酒高手叫杜康。他儿子黑塔跟父亲也学会了酿酒技术。后来,从山西迁到镇江。黑塔觉得酿酒后把酒糟扔掉可惜,把酒糟浸泡在水缸里。到了第二十一日的酉时,一开缸,一股浓郁的香气扑鼻而来。黑塔忍不住尝了一口,酸酸的,味道很美。烧菜时放了一些,味道特别鲜美,便贮藏着作为“调味酱”。乙酸俗称醋酸,是无色有强烈刺激性气味的液体,易溶于水和乙醇,沸点117.9℃,熔点16.6℃,温度低于熔点时凝结成冰一样的晶体,因此纯净的乙酸称为冰醋酸乙酸分子比例模型乙酸组成与结构C2H4O2CH3COOH简写为—COOH羧基乙酸的化学性质1、乙酸具有酸的通性酸性: 乙酸_____碳酸 2CH3COOH + CaCO3 = (CH3COO)2Ca+CO2↑ + H2O>(CH3COO)2Mg + H2 ↑(CH3COO)2Cu + 2H2O使紫色石蕊溶液变红水垢主要成分:CaCO3用醋除水壶中的水垢为什么呢? 厨师烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香醇,特别鲜美。为什么呢?浓硫酸作用:催化剂、吸水剂 饱和碳酸钠的作用:降低酯的溶解度,利于酯的分层析出;中和乙酸;吸收乙醇。2、乙酸的酯化反应-----酸和醇反应生成酯和水酯化反应实质:酸脱羟基醇脱氢小 结一.乙酸的物理性质
二.乙酸的分子结构
结构简式: 官能团:
三.乙酸的化学性质
1.乙酸的酸性:弱酸,其酸性大于碳酸
2.乙酸的酯化反应(取代) CH3COOH—COOH(羧基)
