北京市西城区重点中学 2016年北京市高考理综化学第26题解析 课件(24张)
文档属性
| 名称 | 北京市西城区重点中学 2016年北京市高考理综化学第26题解析 课件(24张) |  | |
| 格式 | zip | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-20 14:48:33 | ||
图片预览






文档简介
课件24张PPT。2016年北京市高考理综化学第26题解析
一、高考题解析
二、高考题赏析—“逻辑之美”
①解题思路逻辑
②设问逻辑
③答案逻辑
④试题结构逻辑
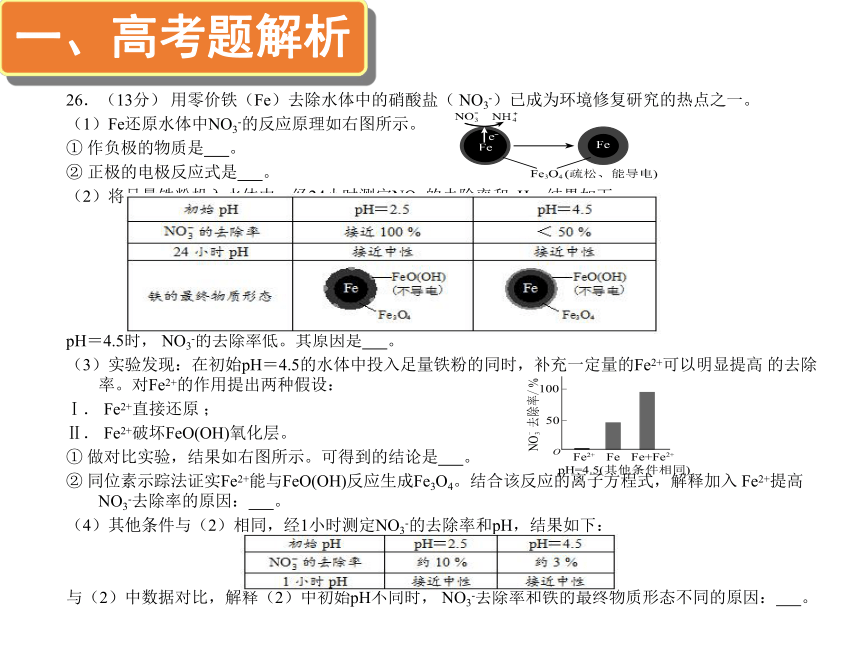
三、教学启示内容26.(13分) 用零价铁(Fe)去除水体中的硝酸盐( NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如右图所示。
① 作负极的物质是 。
② 正极的电极反应式是 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时, NO3-的去除率低。其原因是 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高 的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原 ;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
① 做对比实验,结果如右图所示。可得到的结论是 。
② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入 Fe2+提高 NO3-去除率的原因: 。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
与(2)中数据对比,解释(2)中初始pH不同时, NO3-去除率和铁的最终物质形态不同的原因: 。
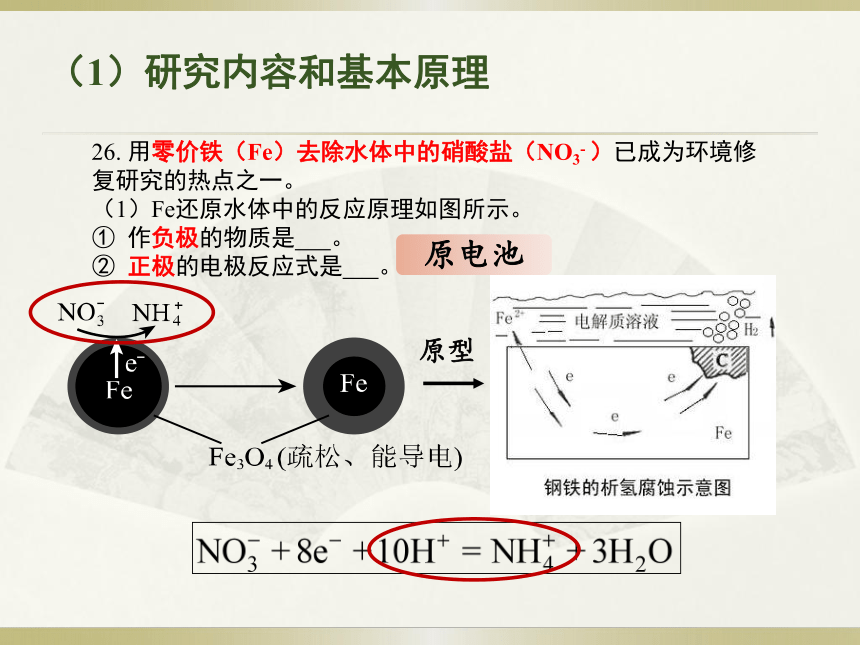
一、高考题解析26. 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一。
(1)Fe还原水体中的反应原理如图所示。
① 作负极的物质是 。
② 正极的电极反应式是 。
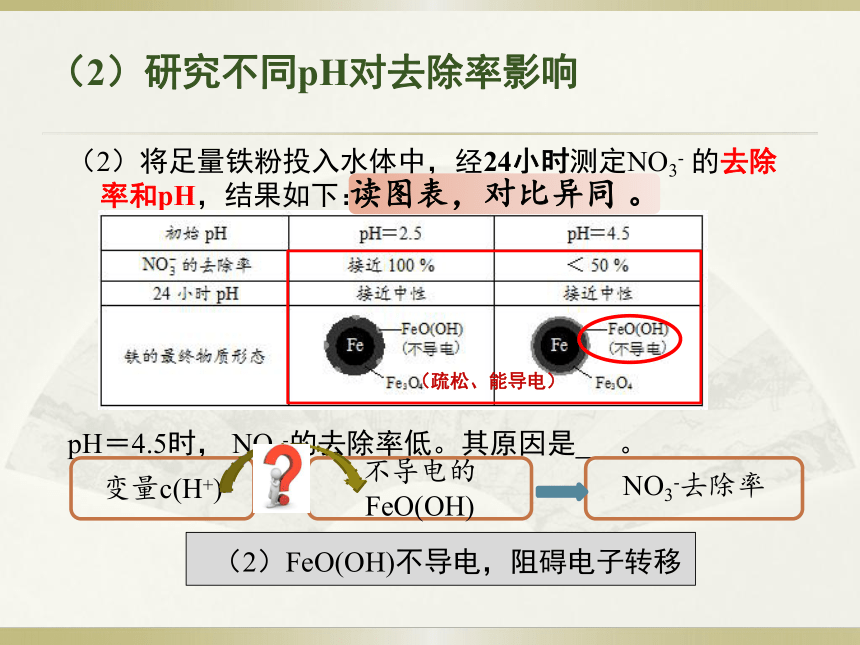
原型原电池(1)研究内容和基本原理(2)将足量铁粉投入水体中,经24小时测定NO3- 的去除率和pH,结果如下:
pH=4.5时, NO3-的去除率低。其原因是 。
(疏松、能导电)读图表,对比异同 。变量c(H+)不导电的FeO(OH)NO3-去除率(2)FeO(OH)不导电,阻碍电子转移(2)研究不同pH对去除率影响(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3- ;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
① 做对比实验,结果如右图所示。可得到的结论是 。
② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因: 。
不成立(3)研究Fe2+影响去除率的机理
教学漏洞:非此即彼。假设需要实验验证。
错误答案标准答案(3)① 本实验条件下,Fe2+不能直接还原FeO(OH);在Fe和Fe2+共同作用下能提高的去除率。学生困惑(3)研究Fe2+影响去除率的机理Ⅰ.Fe2+直接还原NO3- ;
① 做对比实验,结果如图所示。可得到的结论是 。
Ⅱ. Fe2+破坏FeO(OH)氧化层。
② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入提高NO3-去除率的原因: 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:(3)研究Fe2+影响去除率的机理
假设需要实验验证。
信息: (3)方程式② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释Fe2+加入提高去除率NO3-的原因: 。FeO(OH)不导电,阻碍电子转移信息: (1)方程式信息: (2)解释 (3)Fe2+ +2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(O)转化为可导电的Fe3O4,利于电子转移 (3)研究Fe2+影响去除率的机理(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
与(2)中数据对比,解释(2)中初始pH不同时, NO3-去除率和铁的最终物质形态不同的原因: 。
(4)研究H+影响去除率的机理自变量c(H+)不导电的FeO(OH)NO3-去除率因变量c(Fe2+)(2)(3)(4)(4)初始pH低时,产生的Fe2+充足;
初始pH高时,产生的Fe2+不足。(4)研究H+影响去除率的机理二、高考题赏析-“逻辑”之美①解题思路逻辑自变量c(H+)不导电的FeO(OH)NO3-去除率因变量c(Fe2+)(2)(3)(4)二、高考题赏析-“逻辑”之美②设问逻辑环环相扣,层层递进(2)FeO(OH)不导电,阻碍电子转移(3)Fe2+ +2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(O)转化为可导电的Fe3O4,利于电子转移 (4)初始pH低时,产生的Fe2+充足;
初始pH高时,产生的Fe2+不足。(1)二、高考题赏析-“逻辑”之美③答案逻辑抓问题的主要矛盾(1) 研究背景
和基本原理(2)研究宏观铁
的形态影响(3)研究影响铁的
形态的机理④试题结构逻辑26.(13分) 用零价铁(Fe)去除水体中的硝酸盐( NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如右图所示。
① 作负极的物质是 。
② 正极的电极反应式是 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时, NO3-的去除率低。其原因是 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高 的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原 ;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
① 做对比实验,结果如右图所示。可得到的结论是 。
② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入 Fe2+提高 NO3-去除率的原因: 。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
与(2)中数据对比,解释(2)中初始pH不同时, NO3-去除率和铁的最终物质形态不同的原因: 。
(4)微观解释H+
的作用机理
试题特点:
①图表丰富
②探究→研究型试题
素材赏析—文献来源如何提高学生
接收、吸收、整合化学信息的能力;分析和解决化学问题的能力解题文献讲题不能就题论题。体会科研的一般思路方法
体会实验探究过程的逻辑关注设问的逻辑关系,前面的方程式和回答对后面解题具有指导意义。对老师,领会命题意图;对学生,复杂问题不纠结尝试让学生读简单文献,体会科研过程。三、教学启示26(4)优秀学生思路展现提取整合信息能力
逻辑分析推理能力26(4)优秀学生思路展现提取整合信息能力
逻辑分析推理能力观察假说理论推论实验科学研究一般方法1.许多有机化合物具有酸碱性。 完成下列填空: (1)苯酚、苯甲醇、苯甲酸、碳酸、水的酸性(电离氢离子能力)由强到弱的顺序为:______________。苯胺具有______。(“酸性”、“碱性”或“中性”) (2)常常利用物质的酸碱性分离混合液。某一混合液含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如下图:
已知:苯甲醇、苯甲酸、苯胺微溶于水。 A、B、C分别是:A_______? B_________? C_____________ 上述方案中,若首先仅仅将苯甲酸与其他三种物质分开,则应加入________。 (3)欲将 转化为 ,则应加入____________。千万别把孩子的翅膀折了谢谢!
一、高考题解析
二、高考题赏析—“逻辑之美”
①解题思路逻辑
②设问逻辑
③答案逻辑
④试题结构逻辑
三、教学启示内容26.(13分) 用零价铁(Fe)去除水体中的硝酸盐( NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如右图所示。
① 作负极的物质是 。
② 正极的电极反应式是 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时, NO3-的去除率低。其原因是 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高 的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原 ;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
① 做对比实验,结果如右图所示。可得到的结论是 。
② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入 Fe2+提高 NO3-去除率的原因: 。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
与(2)中数据对比,解释(2)中初始pH不同时, NO3-去除率和铁的最终物质形态不同的原因: 。
一、高考题解析26. 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一。
(1)Fe还原水体中的反应原理如图所示。
① 作负极的物质是 。
② 正极的电极反应式是 。
原型原电池(1)研究内容和基本原理(2)将足量铁粉投入水体中,经24小时测定NO3- 的去除率和pH,结果如下:
pH=4.5时, NO3-的去除率低。其原因是 。
(疏松、能导电)读图表,对比异同 。变量c(H+)不导电的FeO(OH)NO3-去除率(2)FeO(OH)不导电,阻碍电子转移(2)研究不同pH对去除率影响(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3- ;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
① 做对比实验,结果如右图所示。可得到的结论是 。
② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因: 。
不成立(3)研究Fe2+影响去除率的机理
教学漏洞:非此即彼。假设需要实验验证。
错误答案标准答案(3)① 本实验条件下,Fe2+不能直接还原FeO(OH);在Fe和Fe2+共同作用下能提高的去除率。学生困惑(3)研究Fe2+影响去除率的机理Ⅰ.Fe2+直接还原NO3- ;
① 做对比实验,结果如图所示。可得到的结论是 。
Ⅱ. Fe2+破坏FeO(OH)氧化层。
② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入提高NO3-去除率的原因: 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:(3)研究Fe2+影响去除率的机理
假设需要实验验证。
信息: (3)方程式② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释Fe2+加入提高去除率NO3-的原因: 。FeO(OH)不导电,阻碍电子转移信息: (1)方程式信息: (2)解释 (3)Fe2+ +2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(O)转化为可导电的Fe3O4,利于电子转移 (3)研究Fe2+影响去除率的机理(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
与(2)中数据对比,解释(2)中初始pH不同时, NO3-去除率和铁的最终物质形态不同的原因: 。
(4)研究H+影响去除率的机理自变量c(H+)不导电的FeO(OH)NO3-去除率因变量c(Fe2+)(2)(3)(4)(4)初始pH低时,产生的Fe2+充足;
初始pH高时,产生的Fe2+不足。(4)研究H+影响去除率的机理二、高考题赏析-“逻辑”之美①解题思路逻辑自变量c(H+)不导电的FeO(OH)NO3-去除率因变量c(Fe2+)(2)(3)(4)二、高考题赏析-“逻辑”之美②设问逻辑环环相扣,层层递进(2)FeO(OH)不导电,阻碍电子转移(3)Fe2+ +2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(O)转化为可导电的Fe3O4,利于电子转移 (4)初始pH低时,产生的Fe2+充足;
初始pH高时,产生的Fe2+不足。(1)二、高考题赏析-“逻辑”之美③答案逻辑抓问题的主要矛盾(1) 研究背景
和基本原理(2)研究宏观铁
的形态影响(3)研究影响铁的
形态的机理④试题结构逻辑26.(13分) 用零价铁(Fe)去除水体中的硝酸盐( NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如右图所示。
① 作负极的物质是 。
② 正极的电极反应式是 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
pH=4.5时, NO3-的去除率低。其原因是 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高 的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原 ;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
① 做对比实验,结果如右图所示。可得到的结论是 。
② 同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入 Fe2+提高 NO3-去除率的原因: 。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
与(2)中数据对比,解释(2)中初始pH不同时, NO3-去除率和铁的最终物质形态不同的原因: 。
(4)微观解释H+
的作用机理
试题特点:
①图表丰富
②探究→研究型试题
素材赏析—文献来源如何提高学生
接收、吸收、整合化学信息的能力;分析和解决化学问题的能力解题文献讲题不能就题论题。体会科研的一般思路方法
体会实验探究过程的逻辑关注设问的逻辑关系,前面的方程式和回答对后面解题具有指导意义。对老师,领会命题意图;对学生,复杂问题不纠结尝试让学生读简单文献,体会科研过程。三、教学启示26(4)优秀学生思路展现提取整合信息能力
逻辑分析推理能力26(4)优秀学生思路展现提取整合信息能力
逻辑分析推理能力观察假说理论推论实验科学研究一般方法1.许多有机化合物具有酸碱性。 完成下列填空: (1)苯酚、苯甲醇、苯甲酸、碳酸、水的酸性(电离氢离子能力)由强到弱的顺序为:______________。苯胺具有______。(“酸性”、“碱性”或“中性”) (2)常常利用物质的酸碱性分离混合液。某一混合液含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如下图:
已知:苯甲醇、苯甲酸、苯胺微溶于水。 A、B、C分别是:A_______? B_________? C_____________ 上述方案中,若首先仅仅将苯甲酸与其他三种物质分开,则应加入________。 (3)欲将 转化为 ,则应加入____________。千万别把孩子的翅膀折了谢谢!
同课章节目录
