江西万载株潭中学2017届高三化学选修四第一章化学反应与能量能力提升检测试题
文档属性
| 名称 | 江西万载株潭中学2017届高三化学选修四第一章化学反应与能量能力提升检测试题 |  | |
| 格式 | zip | ||
| 文件大小 | 171.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-22 07:23:01 | ||
图片预览




文档简介
江西万载株潭中学2017届高三化学选修四第一章化学反应与能量能力提升检测试题
第I卷 选择题
一、选择题(每小题4分,共48分)。
1.下列能量转化过程中化学能转化为热能的是
A.铝热反应 B.酸碱的中和反应
C.冰雪融化 D.绿色植物的光合作用
2.下列有关能源与能量的说法正确的是 ( )
A.煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B.蒸汽属于一次能源
C.凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D.反应物和生成物的总能量决定反应是放热还是吸热
3.下列图示与对应的叙述相符的是( )
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C.图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
4.参照反应Br+H2HBr+H的能量对反应历程的示意图,下列叙述正确的是
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
5.据新浪网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
A.①② B.③④ C.②③ D.①②③④
6.下列热化学方程式表达正确的是(的绝对值均正确)
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D.2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
7.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是 ( )
A.△H1>△H2>△H3
B.△H1>△H2=△H3
C.△H1<△H2<△H3
D.△H1=△H2<△H3
8.下列说法中错误的是
A.电解饱和食盐水,生成物总能量比反应物总能量高
B.能自发进行的化学反应,不一定是△H<0,△S>0
C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高
D.食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害
9.下列变化中生成物的总能量大于反应物的总能量的是
A.H + H = H—H
B.H—Cl = H + Cl
C.Mg + 2HCl = MgCl2 + H2 ↑
D.H2SO4 + 2NaOH = Na2SO4 + 2H2O
10.已知反应: ①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀醋酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀盐酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
11.下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C(s)+1/2O2(g)=CO(g);ΔH=-110.5kJ·mol-1(燃烧热)
B.2H2O(g)=2H2(g)+O2(g);ΔH=+483.6 kJ·mol-1(反应热)
C.C2H5OH+3O2=2CO2+3H2O;ΔH=-1368.8 kJ·mol-1(反应热)
D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l);ΔH=-114.6 kJ·mol-1(中和热)
12.下列说法中不正确的是( )
A.分解反应大多数是吸热反应
B.氢氧化钾与硝酸的反应是放热反应
C.燃料有足够的空气就能充分燃烧
D.放热反应的过程,都可以看成是“储存”在物质内部的能量转化为热能、光能、电能等被释放出来的过程
13.下列反应或过程属于吸热的是
A.盐酸与NaOH溶液的反应 B.H + H= H2
C.Al和Fe2O3的铝热反应 D.Ba(OH)2.8H2O与NH4Cl反应
14.已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)== CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s) △H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为( )
A.-1641.0kJ/mol B.+3081kJ/mol
C.+663.5kJ/mol D.-2507.0kJ/mol
15.下列有关热化学方程式的叙述正确的是
A.2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
B.已知C(石墨,s)= C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)==2CO2(g);△H1 ;2C(s)+O2(g)=2CO(g) △H2。则△H1>△H2
16.已知:2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ/mol,下列说法错误的是( )
A.该反应原理可用于设计氢氧燃料电池
B.破坏1mol H-O键需要的能量是926.8kJ
C.H2O(g)=H2(g)+O2(g)△H=+241.8kJ/mol
D.H2(g)中的H-H键比H2O(g)中的H-O键能小
第II卷 非选择题
二、非选择题(共52分)
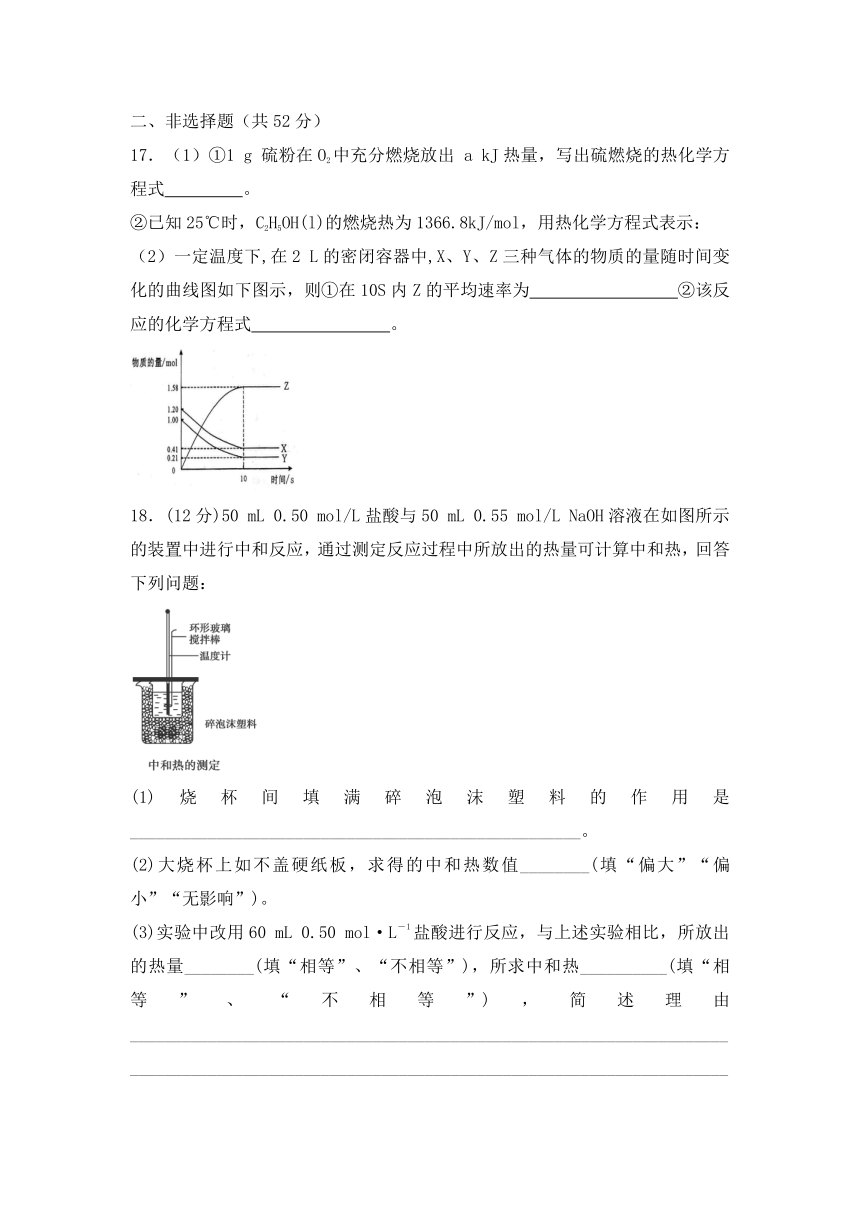
17.(1)①1 g 硫粉在O2中充分燃烧放出 a kJ热量,写出硫燃烧的热化学方程式 。
②已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示:
(2)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线图如下图示,则①在10S内Z的平均速率为 ②该反应的化学方程式 。
18.(12分)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是____________________________________________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”),简述理由_____________________________________________________________________
___________________________________________________________________________________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”“无影响”)。
19.(9分)用右图所示装置进行中和热测定实验,请回答下列问题:
(1)大小烧杯之间填满碎泡沫塑料的作用是????????????????????????????????????????????? ,从实验装置上看,图中缺少的一种玻璃仪器是???????????????????????????????? 。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的?比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=??????????????????????????????? ,
H2SO4与NaOH反应的热化学方程式为????????????????????????????? ?????????????。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量???????????????????? ?(填“相等”.“不相等”),所求中和热????????????????? ?(填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会???????????????????? ?(填“偏大”、“偏小”、“不受影响”)。
20.利用下图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)如右图所示,仪器A的名称是_________ ______;
(2)NaOH溶液稍过量的原因 ____________________________。
(3)加入NaOH溶液的正确操作是_______(填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是 ________ __________________。
(5)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________________
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?_______ ____________________
21.X、Y、Z、T、W五种元素的性质或原子结构如下表:
元素
元素性质或原子结构
X
原子的最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物的水溶液呈碱性
Z
基态原子最外层电子排布式为(n+1)sn(n+1)pn+2
T
与Z同周期,元素最高价是+7价
W
原子序数为Y、T元素之和,不锈钢中含有该元素
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化 曲线如下图所示:
请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。
参考答案
1.AB
试题分析:A.铝热反应为放热反应,故将化学能转化成热能。
B.酸碱中和为放热反应,故将化学能转化成热能。
C.冰雪融化为物理变化,且是吸热变化。
D.光合作用是将光能转化为化学能。
2.D
试题分析:煤和石油属不可再生能源,故A错误;蒸汽属于二次能源,故B错误;反应放热、吸热与反应条件无关,故C错误;反应物和生成物的总能量决定反应是放热还是吸热,故D正确。
3.C
试题分析:图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化,故A错误;等量锌粉与足量的等浓度的盐酸反应,滴加CuSO4溶液生成氢气速率加快,但生成氢气量减少,故B错误;图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液,故C正确;图4表示某可逆反应生成物的量随反应时间变化的曲线,平衡时反应物转化率最大,故D错误。
4.C
试题分析:根据反应物的总能量小于生成物的总能量,可知反应吸热。A、因正反应为吸热反应,故A错误;B、催化剂与反应热无关,故B错误;C、正反应为吸热反应,反应物总能量低于生成物总能量,故C正确;D、催化剂可增大正反应速率,也增大逆反应速率,故D错误;故选C。
5.C
试题分析:①:水解反应是吸热反应,故错;④:氢气是二级能源,故错。故选C。
6.C
燃烧热是指在一定条件下1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,即乙醇的燃烧错误也是液体水,A不正确。中和反应是放热反应,所以△H小于0,B不正确。因为反应热与物质的状态有关系,所以在热化学方程式中必须注明各种物质的状态,D不正确。答案是C。
7.C
试题分析:强酸与强碱的中和热为△H=-57.3KJ·mol-1 浓硫酸稀释时会放热,醋酸是弱酸电离时吸热,答案选C
8.D
试题分析:A、电解饱和食盐水是吸热反应,因此生成物总能量比反应物总能量高,A正确;B、只要△G=△H-T·△S<0反应就是自发进行的,因此能自发进行的化学反应,不一定是△H<0,△S>0,B正确;C、冰融化吸热,说明相同质量的水和冰,水的能量高,C正确;D、食盐是氯化钠,属于电解质,用食盐作融雪剂会对环境、植物生长产生危害,D不正确,答案选D。
9.B
10.D
试题分析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,碳完全燃烧的生成物是CO2,A错误;反应①是放热反应,则反应热应该是-221 kJ/mol,B错误;中和热是在一定条件下的稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,D正确、C中醋酸是弱酸,溶于水存在电离平衡,电离是吸热的,则稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ,C错误。
11.B
试题分析:燃烧热为在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,A项中产物CO不是稳定的氧化物,故A项错误;热化学方程式书写需注明各物质状态,故C项错误;中和热是指在一定条件下稀的强酸强碱反应生成1mol水的反应热,故D项错误;B项书写正确。
12.C
分解反应大多需提供热量破坏化学键,因而多数是吸热反应,A项正确;酸碱中和反应是典型的放热反应,B项正确;物质燃烧的条件是温度达到着火点,和氧气接触,只和空气接触不能充分燃烧,C项错误;因化学反应的过程是“储存”在物质内部的能量(化学能)转化为热能、电能或光能等释放出来的过程,或者是热能、电能或光能转化为物质内部的能量(化学能)被储存起来的过程,D项正确。
13.D
根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应,绝大多数化合反应和铝热反应;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),以及Ba(OH)2.8H2O与NH4Cl之间的反应.
盐酸与氢氧化钠溶液是中和反应,是常见放热反应,在反应中放出热量,故A错误;
B、新化学键的形成过程需要放出热量,故B错误;
C、Al和Fe2O3的铝热反应属于放热过程,故C错误;
D、Ba(OH)2.8H2O与NH4Cl之间的反应是吸热反应,故都正确.
故选D.
14.A
试题分析:根据盖斯定律可得:ΔH=【(①-②)×3+ ③】×2=-1641.0kJ/mol,A、正确。
15.C
试题分析:A.燃烧热是指生成液体水,不是水蒸气,A错误;B.根据能量越低越稳定,石墨生成金刚石是吸热反应,说明石墨的能量低,即石墨比金刚石稳定,B错误;C.中和热是指强酸、强碱的稀溶液反应生成1mol水时放出的热量,所以该反应的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol,C正确;D.C的燃烧是放热反应,等物质的量的碳完全燃烧生成CO2 时放出的热量多,焓变小,D错误;答案选C。
16.B
试题分析:A.由于该反应是放热反应,反应过程中有电子转移,因此该反应原理可用于设计氢氧燃料电池,正确;B. 破坏1mol H-O键需要的能量是(2×436+498+483.6)÷4=463.4kJ,错误;C.当反应物变为生成物时,反应热的符号相反,物质的量越多,反应转化的热量变化也越多,所以1mol水蒸气变为氢气和氧气吸收的热量是241.8kJ,热化学方程式是H2O(g)=H2(g)+O2(g)△H=+241.8kJ/mol,正确;D.根据题意可知H2(g)中的H-H键键能是436kJ/mol,而H2O(g)中的H-O键能是463.4kJ/mol,因此前者小于后者,正确。
17.(1)①S(s)+O2(g)═SO2(g)△H=-32akJ/mol;② C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1 ;(2)①0.079mol/(L?s);②X(g)+Y(g)2Z(g)。
18.(1)减小热量散失 (2)偏小
(3)不相等 相等 因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关
(4)偏小
19.(1)???????保温、隔热、减少实验过程中的热量损失(1分);???环形玻璃搅拌棒(1分)??????????
(2)??-56.8kJ?mol-1?(2分)??? ,???H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1?(2分)??
(3)?不相等?(1分)?? ?,????相等???(1分)? ?,????偏小??(1分)???????????
试题分析:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
(2)Q= 3.4°C×4.18J/(g?℃)×100g=1421.2J=1.42KJ,
△H =;热化学方程式为:
?H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;又醋酸是弱酸,电离过程吸热,所以用50mL0.50mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会减小。
20.(1)环形玻璃搅拌棒
(2)确保硫酸被完全中和
(3)B
(4)用环形玻璃棒轻轻上下搅动
(5)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);ΔH=-56.8kJ·mol-1
(6)abc
(7)不断读取温度数据,并记录,直到出现下降,取最大值。
21.(1)或14C (1分) 1s22s22p63s23p63d54s1或[Ar]3d54s1(2分)
(2)Cl (1分) B、D(2分)
(3)1:1(或答1)(1分) 分子晶体(1分) Y的氢化物(氨)分子间存在氢键作用(1分)
(4)①CaCO3(s)+2HCl(aq)=CaCl2(aq)+CO2(g)+H2O(l) ΔH=-10aKJ/mol(2分)
②Ca2++ CO32-=CaCO3↓(2分)
CO32-+H2O HCO3-+OH- (2分)
第I卷 选择题
一、选择题(每小题4分,共48分)。
1.下列能量转化过程中化学能转化为热能的是
A.铝热反应 B.酸碱的中和反应
C.冰雪融化 D.绿色植物的光合作用
2.下列有关能源与能量的说法正确的是 ( )
A.煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B.蒸汽属于一次能源
C.凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D.反应物和生成物的总能量决定反应是放热还是吸热
3.下列图示与对应的叙述相符的是( )
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C.图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
4.参照反应Br+H2HBr+H的能量对反应历程的示意图,下列叙述正确的是
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
5.据新浪网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
A.①② B.③④ C.②③ D.①②③④
6.下列热化学方程式表达正确的是(的绝对值均正确)
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D.2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
7.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是 ( )
A.△H1>△H2>△H3
B.△H1>△H2=△H3
C.△H1<△H2<△H3
D.△H1=△H2<△H3
8.下列说法中错误的是
A.电解饱和食盐水,生成物总能量比反应物总能量高
B.能自发进行的化学反应,不一定是△H<0,△S>0
C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高
D.食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害
9.下列变化中生成物的总能量大于反应物的总能量的是
A.H + H = H—H
B.H—Cl = H + Cl
C.Mg + 2HCl = MgCl2 + H2 ↑
D.H2SO4 + 2NaOH = Na2SO4 + 2H2O
10.已知反应: ①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀醋酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀盐酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
11.下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C(s)+1/2O2(g)=CO(g);ΔH=-110.5kJ·mol-1(燃烧热)
B.2H2O(g)=2H2(g)+O2(g);ΔH=+483.6 kJ·mol-1(反应热)
C.C2H5OH+3O2=2CO2+3H2O;ΔH=-1368.8 kJ·mol-1(反应热)
D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l);ΔH=-114.6 kJ·mol-1(中和热)
12.下列说法中不正确的是( )
A.分解反应大多数是吸热反应
B.氢氧化钾与硝酸的反应是放热反应
C.燃料有足够的空气就能充分燃烧
D.放热反应的过程,都可以看成是“储存”在物质内部的能量转化为热能、光能、电能等被释放出来的过程
13.下列反应或过程属于吸热的是
A.盐酸与NaOH溶液的反应 B.H + H= H2
C.Al和Fe2O3的铝热反应 D.Ba(OH)2.8H2O与NH4Cl反应
14.已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)== CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s) △H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为( )
A.-1641.0kJ/mol B.+3081kJ/mol
C.+663.5kJ/mol D.-2507.0kJ/mol
15.下列有关热化学方程式的叙述正确的是
A.2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
B.已知C(石墨,s)= C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)==2CO2(g);△H1 ;2C(s)+O2(g)=2CO(g) △H2。则△H1>△H2
16.已知:2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ/mol,下列说法错误的是( )
A.该反应原理可用于设计氢氧燃料电池
B.破坏1mol H-O键需要的能量是926.8kJ
C.H2O(g)=H2(g)+O2(g)△H=+241.8kJ/mol
D.H2(g)中的H-H键比H2O(g)中的H-O键能小
第II卷 非选择题
二、非选择题(共52分)
17.(1)①1 g 硫粉在O2中充分燃烧放出 a kJ热量,写出硫燃烧的热化学方程式 。
②已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示:
(2)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线图如下图示,则①在10S内Z的平均速率为 ②该反应的化学方程式 。
18.(12分)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是____________________________________________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”),简述理由_____________________________________________________________________
___________________________________________________________________________________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”“无影响”)。
19.(9分)用右图所示装置进行中和热测定实验,请回答下列问题:
(1)大小烧杯之间填满碎泡沫塑料的作用是????????????????????????????????????????????? ,从实验装置上看,图中缺少的一种玻璃仪器是???????????????????????????????? 。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的?比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=??????????????????????????????? ,
H2SO4与NaOH反应的热化学方程式为????????????????????????????? ?????????????。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量???????????????????? ?(填“相等”.“不相等”),所求中和热????????????????? ?(填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会???????????????????? ?(填“偏大”、“偏小”、“不受影响”)。
20.利用下图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)如右图所示,仪器A的名称是_________ ______;
(2)NaOH溶液稍过量的原因 ____________________________。
(3)加入NaOH溶液的正确操作是_______(填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是 ________ __________________。
(5)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________________
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?_______ ____________________
21.X、Y、Z、T、W五种元素的性质或原子结构如下表:
元素
元素性质或原子结构
X
原子的最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物的水溶液呈碱性
Z
基态原子最外层电子排布式为(n+1)sn(n+1)pn+2
T
与Z同周期,元素最高价是+7价
W
原子序数为Y、T元素之和,不锈钢中含有该元素
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化 曲线如下图所示:
请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。
参考答案
1.AB
试题分析:A.铝热反应为放热反应,故将化学能转化成热能。
B.酸碱中和为放热反应,故将化学能转化成热能。
C.冰雪融化为物理变化,且是吸热变化。
D.光合作用是将光能转化为化学能。
2.D
试题分析:煤和石油属不可再生能源,故A错误;蒸汽属于二次能源,故B错误;反应放热、吸热与反应条件无关,故C错误;反应物和生成物的总能量决定反应是放热还是吸热,故D正确。
3.C
试题分析:图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化,故A错误;等量锌粉与足量的等浓度的盐酸反应,滴加CuSO4溶液生成氢气速率加快,但生成氢气量减少,故B错误;图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液,故C正确;图4表示某可逆反应生成物的量随反应时间变化的曲线,平衡时反应物转化率最大,故D错误。
4.C
试题分析:根据反应物的总能量小于生成物的总能量,可知反应吸热。A、因正反应为吸热反应,故A错误;B、催化剂与反应热无关,故B错误;C、正反应为吸热反应,反应物总能量低于生成物总能量,故C正确;D、催化剂可增大正反应速率,也增大逆反应速率,故D错误;故选C。
5.C
试题分析:①:水解反应是吸热反应,故错;④:氢气是二级能源,故错。故选C。
6.C
燃烧热是指在一定条件下1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,即乙醇的燃烧错误也是液体水,A不正确。中和反应是放热反应,所以△H小于0,B不正确。因为反应热与物质的状态有关系,所以在热化学方程式中必须注明各种物质的状态,D不正确。答案是C。
7.C
试题分析:强酸与强碱的中和热为△H=-57.3KJ·mol-1 浓硫酸稀释时会放热,醋酸是弱酸电离时吸热,答案选C
8.D
试题分析:A、电解饱和食盐水是吸热反应,因此生成物总能量比反应物总能量高,A正确;B、只要△G=△H-T·△S<0反应就是自发进行的,因此能自发进行的化学反应,不一定是△H<0,△S>0,B正确;C、冰融化吸热,说明相同质量的水和冰,水的能量高,C正确;D、食盐是氯化钠,属于电解质,用食盐作融雪剂会对环境、植物生长产生危害,D不正确,答案选D。
9.B
10.D
试题分析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,碳完全燃烧的生成物是CO2,A错误;反应①是放热反应,则反应热应该是-221 kJ/mol,B错误;中和热是在一定条件下的稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,D正确、C中醋酸是弱酸,溶于水存在电离平衡,电离是吸热的,则稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ,C错误。
11.B
试题分析:燃烧热为在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,A项中产物CO不是稳定的氧化物,故A项错误;热化学方程式书写需注明各物质状态,故C项错误;中和热是指在一定条件下稀的强酸强碱反应生成1mol水的反应热,故D项错误;B项书写正确。
12.C
分解反应大多需提供热量破坏化学键,因而多数是吸热反应,A项正确;酸碱中和反应是典型的放热反应,B项正确;物质燃烧的条件是温度达到着火点,和氧气接触,只和空气接触不能充分燃烧,C项错误;因化学反应的过程是“储存”在物质内部的能量(化学能)转化为热能、电能或光能等释放出来的过程,或者是热能、电能或光能转化为物质内部的能量(化学能)被储存起来的过程,D项正确。
13.D
根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应,绝大多数化合反应和铝热反应;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),以及Ba(OH)2.8H2O与NH4Cl之间的反应.
盐酸与氢氧化钠溶液是中和反应,是常见放热反应,在反应中放出热量,故A错误;
B、新化学键的形成过程需要放出热量,故B错误;
C、Al和Fe2O3的铝热反应属于放热过程,故C错误;
D、Ba(OH)2.8H2O与NH4Cl之间的反应是吸热反应,故都正确.
故选D.
14.A
试题分析:根据盖斯定律可得:ΔH=【(①-②)×3+ ③】×2=-1641.0kJ/mol,A、正确。
15.C
试题分析:A.燃烧热是指生成液体水,不是水蒸气,A错误;B.根据能量越低越稳定,石墨生成金刚石是吸热反应,说明石墨的能量低,即石墨比金刚石稳定,B错误;C.中和热是指强酸、强碱的稀溶液反应生成1mol水时放出的热量,所以该反应的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol,C正确;D.C的燃烧是放热反应,等物质的量的碳完全燃烧生成CO2 时放出的热量多,焓变小,D错误;答案选C。
16.B
试题分析:A.由于该反应是放热反应,反应过程中有电子转移,因此该反应原理可用于设计氢氧燃料电池,正确;B. 破坏1mol H-O键需要的能量是(2×436+498+483.6)÷4=463.4kJ,错误;C.当反应物变为生成物时,反应热的符号相反,物质的量越多,反应转化的热量变化也越多,所以1mol水蒸气变为氢气和氧气吸收的热量是241.8kJ,热化学方程式是H2O(g)=H2(g)+O2(g)△H=+241.8kJ/mol,正确;D.根据题意可知H2(g)中的H-H键键能是436kJ/mol,而H2O(g)中的H-O键能是463.4kJ/mol,因此前者小于后者,正确。
17.(1)①S(s)+O2(g)═SO2(g)△H=-32akJ/mol;② C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1 ;(2)①0.079mol/(L?s);②X(g)+Y(g)2Z(g)。
18.(1)减小热量散失 (2)偏小
(3)不相等 相等 因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关
(4)偏小
19.(1)???????保温、隔热、减少实验过程中的热量损失(1分);???环形玻璃搅拌棒(1分)??????????
(2)??-56.8kJ?mol-1?(2分)??? ,???H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1?(2分)??
(3)?不相等?(1分)?? ?,????相等???(1分)? ?,????偏小??(1分)???????????
试题分析:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
(2)Q= 3.4°C×4.18J/(g?℃)×100g=1421.2J=1.42KJ,
△H =;热化学方程式为:
?H2SO4(aq)+2NaOH(aq)= Na2SO4(aq)+2H2O(l);ΔH=-113.6kJ?mol-1
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;又醋酸是弱酸,电离过程吸热,所以用50mL0.50mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会减小。
20.(1)环形玻璃搅拌棒
(2)确保硫酸被完全中和
(3)B
(4)用环形玻璃棒轻轻上下搅动
(5)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);ΔH=-56.8kJ·mol-1
(6)abc
(7)不断读取温度数据,并记录,直到出现下降,取最大值。
21.(1)或14C (1分) 1s22s22p63s23p63d54s1或[Ar]3d54s1(2分)
(2)Cl (1分) B、D(2分)
(3)1:1(或答1)(1分) 分子晶体(1分) Y的氢化物(氨)分子间存在氢键作用(1分)
(4)①CaCO3(s)+2HCl(aq)=CaCl2(aq)+CO2(g)+H2O(l) ΔH=-10aKJ/mol(2分)
②Ca2++ CO32-=CaCO3↓(2分)
CO32-+H2O HCO3-+OH- (2分)
