江苏省2016年高中化学优质评比(苏教版)高二化学选修四-专题2 第三单元 化学平衡的移动(溧阳市光华高级中学) (共18张PPT)
文档属性
| 名称 | 江苏省2016年高中化学优质评比(苏教版)高二化学选修四-专题2 第三单元 化学平衡的移动(溧阳市光华高级中学) (共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-23 00:00:00 | ||
图片预览



文档简介
课件18张PPT。化学平衡的移动溧阳市光华高级中学
2016年9月15日22:04分
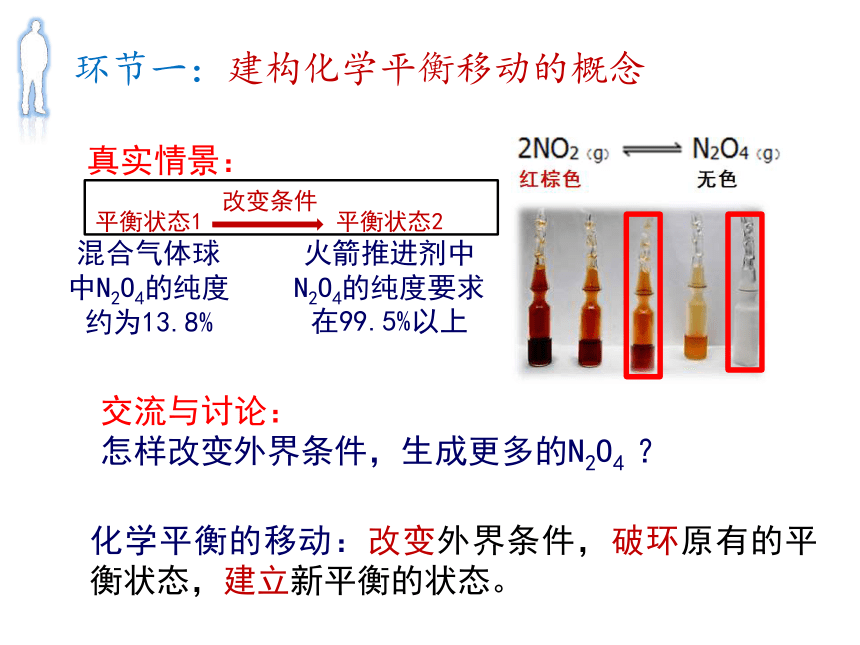
长征二号F T2火箭托举着天空二号空间实验室腾空而起,奔向太空环节一:建构化学平衡移动的概念Br2? NO2? 红棕色? C2H8N2(l)+ 2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g)△H<0
偏二甲肼(无色) (无色) (无色) (无色) (无色)
NO2请写出由二氧化氮反应生成四氧化二氮的反应方程式。
可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化。观察与思考:
小球颜色不变什么是化学平衡状态?环节一:建构化学平衡移动的概念v(正)=v(逆) c(NO2)不变交流与讨论:
怎样改变外界条件,生成更多的N2O4 ?
真实情景:化学平衡的移动:改变外界条件,破环原有的平衡状态,建立新平衡的状态。环节一:建构化学平衡移动的概念平衡状态1
混合气体球中N2O4的纯度约为13.8%平衡状态2
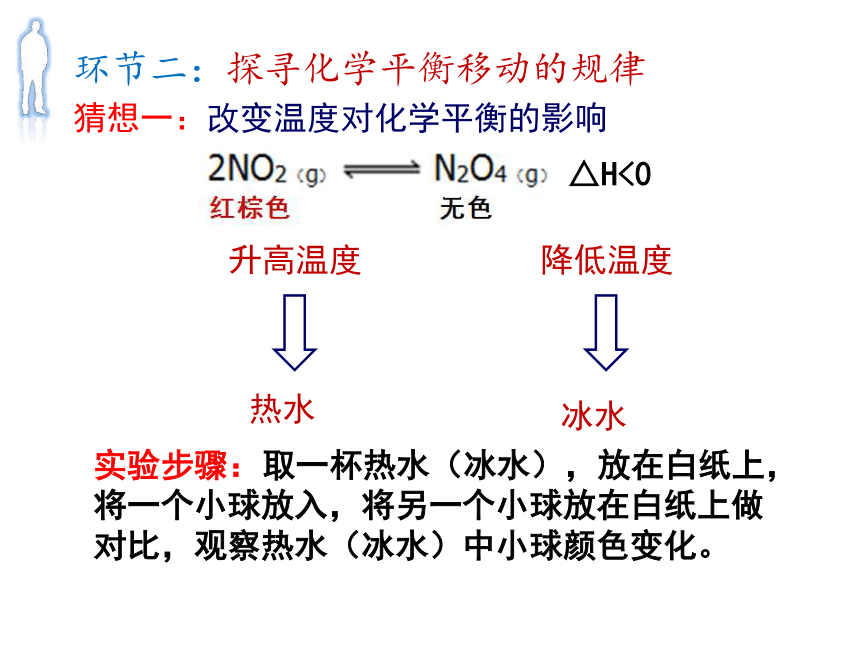
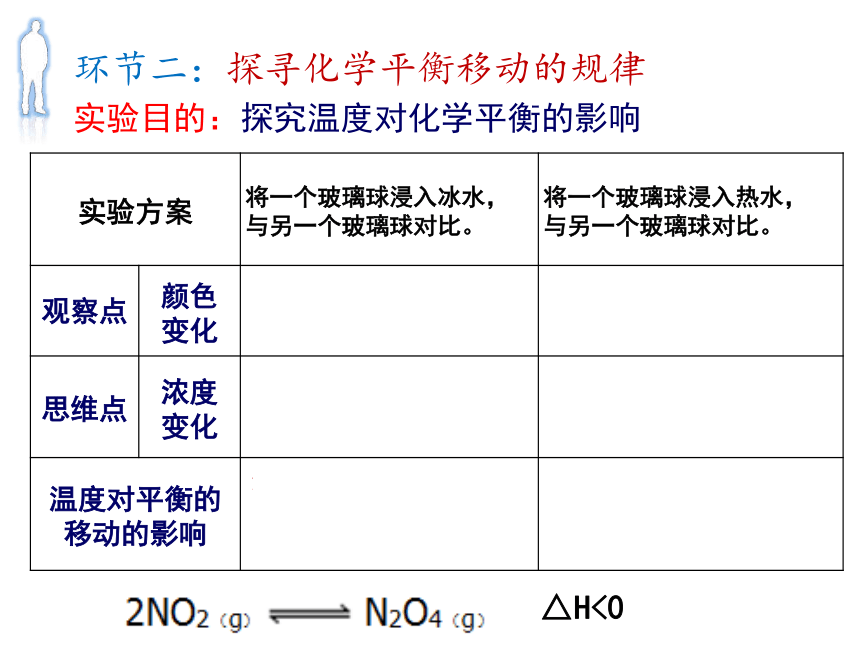
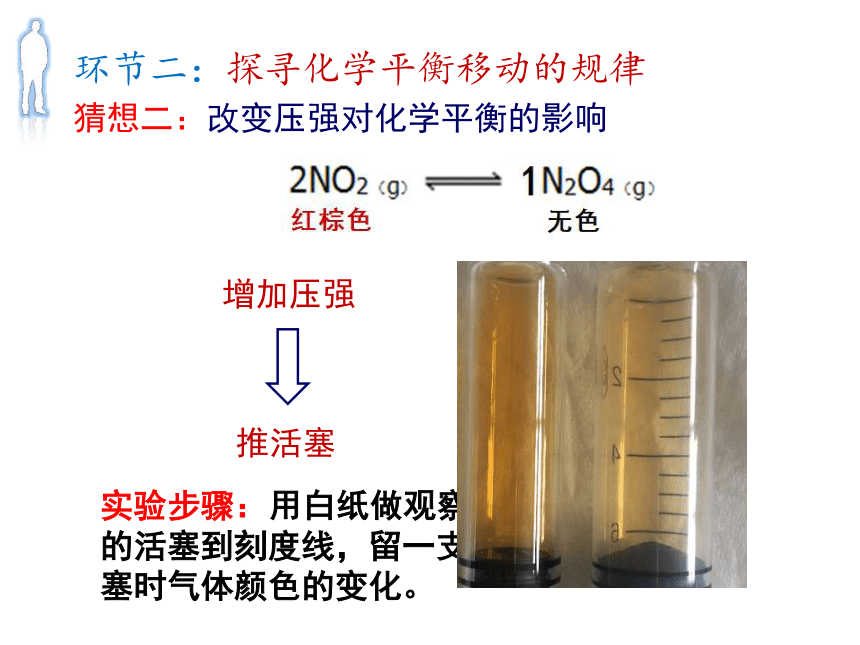
火箭推进剂中N2O4的纯度要求在99.5%以上 猜想一:改变温度对化学平衡的影响△H<0降低温度升高温度环节二:探寻化学平衡移动的规律实验步骤: 取一杯热水(冰水),放在白纸上,将一个小球放入,将另一个小球放在白纸上做对比,观察热水(冰水)中小球颜色变化。实验目的:探究温度对化学平衡的影响环节二:探寻化学平衡移动的规律△H<0猜想二:改变压强对化学平衡的影响减少压强增加压强环节二:探寻化学平衡移动的规律实验步骤: 用白纸做观察背景,推一支针筒的活塞到刻度线,留一支做对比,观察推活塞时气体颜色的变化。实验目的:探究压强对化学平衡的影响环节二:探寻化学平衡移动的规律环节二:探寻化学平衡移动的规律NO2减少,N2O4增加,实验目的:探究压强对化学平衡的影响体积减少,c(NO2)变大, c(N2O4)变大;
平衡移动,c(NO2)略减小,c(N2O4)略变大环节二:探寻化学平衡移动的规律实验目的:探究压强对化学平衡的影响N2O4变少,化学平衡向分子数增加的方向移动。观察与思考:高压使混合气体中N2O4的量变多。
增加压强,平衡向分子数目减少的方向移动。v‘(正)>ν’(逆)ν(正)=ν(逆)v’’(正)=ν’’(逆)
平衡态2平衡的移动增加
压强v’(正)ν’(逆)环节二:探寻化学平衡移动的规律 推针筒活塞使混合气体体积从V被压缩为 ,此时的Q与K有何关系? 在Q趋向于K的过程中,两种气体的浓度怎么变化?深度思维:
环节二:探寻化学平衡移动的规律Q = K c(NO2)变小,c(N2O4)变大化学平衡的移动过程就是Q趋向于K的过程。
增加压强,平衡向分子数目减少的方向移动。该反应的浓度的商为
达到平衡状态后的浓度商即为化学平衡常数K,未达平衡时的浓度商用Q表示,平衡常数随反应温度的变化而变化。归纳与总结: 改变影响化学平衡的一个因素,平衡向着
能减弱这种改变 的方向进行。环节三:理解化学平衡移动的原理升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动;
增加压强,平衡向分子数减少的方向移动;
减少压强,平衡向分子数增多的方向移动;交流与讨论: 改变影响化学平衡的一个因素,平衡向着
能减弱这种改变 的方向进行。环节三:理解化学平衡移动的原理 若要使平衡正向移动,理论上可以对两种气体的浓度进行怎样的改变?增加(减少)反应物(生成物)浓度,平衡向正反应方向移动;减少(增加)反应物(生成物)浓度,平衡向逆反应方向移动。加催化剂,不影响平衡移动;化学史话:勒·夏特列/勒夏特利埃
(Le Chatelier,Henri Louis)(1850~1936),法国化学家。他对科学和工业之间的关系特别感兴趣,以及怎样从化学反应中得到最高的产率。 1888年发现“化学平衡移动原理” 。是一个定性预测化学平衡点的原理,又名“勒夏特列原理”。环节三:理解化学平衡移动的原理联系生产:
工业生产N2O4时,采用“控制温度-8 ℃到-10 ℃,将N2O4气体液化后移出”的方法。
对比理论条件和实际生产,分析差异。根据资料卡,简述原因。
环节三:理解化学平衡移动的原理资料卡:
1、工业生产中,采用较高的温度会造成较大的能耗;采用较低的温度会影响反应速率;加压所需的设备成本较高,工业上对于常压下转化率较高的反应,一般不采用加压的方式。
2、四氧化二氮的沸点为21.2℃,熔点为-11.2℃,易液化。
化学平衡移动原理(勒夏特列原理) 只提供生产研究的方向,实际生产中 条件的选择要结合多种考虑因素。
什么是可逆反应?
什么是化学平衡状态?
什么是化学平衡的移动?升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动;
增加压强,平衡向分子数减少的方向移动;
减少压强,平衡向分子数增多的方向移动;
增加(减少)反应物(生成物)浓度,平衡向正反应方向移动;
减少(增加)反应物(生成物)浓度,平衡向逆反应方向移动;利用“改变影响化学平衡的一个因素,平衡向着减弱这种改变的方向进行”解决实际问题。我们眼中化学平衡的移动课外作业(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) △H<0
偏二甲肼(无色) (无色) (无色) (无色) (无色)
利用化学反应原理分析合成氨理论生产的条件,查阅资料获得合成氨实际生产条件,比较两者的差异,分析原因。tmhg181@sohu.com
2016年9月15日22:04分
长征二号F T2火箭托举着天空二号空间实验室腾空而起,奔向太空环节一:建构化学平衡移动的概念Br2? NO2? 红棕色? C2H8N2(l)+ 2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g)△H<0
偏二甲肼(无色) (无色) (无色) (无色) (无色)
NO2请写出由二氧化氮反应生成四氧化二氮的反应方程式。
可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化。观察与思考:
小球颜色不变什么是化学平衡状态?环节一:建构化学平衡移动的概念v(正)=v(逆) c(NO2)不变交流与讨论:
怎样改变外界条件,生成更多的N2O4 ?
真实情景:化学平衡的移动:改变外界条件,破环原有的平衡状态,建立新平衡的状态。环节一:建构化学平衡移动的概念平衡状态1
混合气体球中N2O4的纯度约为13.8%平衡状态2
火箭推进剂中N2O4的纯度要求在99.5%以上 猜想一:改变温度对化学平衡的影响△H<0降低温度升高温度环节二:探寻化学平衡移动的规律实验步骤: 取一杯热水(冰水),放在白纸上,将一个小球放入,将另一个小球放在白纸上做对比,观察热水(冰水)中小球颜色变化。实验目的:探究温度对化学平衡的影响环节二:探寻化学平衡移动的规律△H<0猜想二:改变压强对化学平衡的影响减少压强增加压强环节二:探寻化学平衡移动的规律实验步骤: 用白纸做观察背景,推一支针筒的活塞到刻度线,留一支做对比,观察推活塞时气体颜色的变化。实验目的:探究压强对化学平衡的影响环节二:探寻化学平衡移动的规律环节二:探寻化学平衡移动的规律NO2减少,N2O4增加,实验目的:探究压强对化学平衡的影响体积减少,c(NO2)变大, c(N2O4)变大;
平衡移动,c(NO2)略减小,c(N2O4)略变大环节二:探寻化学平衡移动的规律实验目的:探究压强对化学平衡的影响N2O4变少,化学平衡向分子数增加的方向移动。观察与思考:高压使混合气体中N2O4的量变多。
增加压强,平衡向分子数目减少的方向移动。v‘(正)>ν’(逆)ν(正)=ν(逆)v’’(正)=ν’’(逆)
平衡态2平衡的移动增加
压强v’(正)ν’(逆)环节二:探寻化学平衡移动的规律 推针筒活塞使混合气体体积从V被压缩为 ,此时的Q与K有何关系? 在Q趋向于K的过程中,两种气体的浓度怎么变化?深度思维:
环节二:探寻化学平衡移动的规律Q = K c(NO2)变小,c(N2O4)变大化学平衡的移动过程就是Q趋向于K的过程。
增加压强,平衡向分子数目减少的方向移动。该反应的浓度的商为
达到平衡状态后的浓度商即为化学平衡常数K,未达平衡时的浓度商用Q表示,平衡常数随反应温度的变化而变化。归纳与总结: 改变影响化学平衡的一个因素,平衡向着
能减弱这种改变 的方向进行。环节三:理解化学平衡移动的原理升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动;
增加压强,平衡向分子数减少的方向移动;
减少压强,平衡向分子数增多的方向移动;交流与讨论: 改变影响化学平衡的一个因素,平衡向着
能减弱这种改变 的方向进行。环节三:理解化学平衡移动的原理 若要使平衡正向移动,理论上可以对两种气体的浓度进行怎样的改变?增加(减少)反应物(生成物)浓度,平衡向正反应方向移动;减少(增加)反应物(生成物)浓度,平衡向逆反应方向移动。加催化剂,不影响平衡移动;化学史话:勒·夏特列/勒夏特利埃
(Le Chatelier,Henri Louis)(1850~1936),法国化学家。他对科学和工业之间的关系特别感兴趣,以及怎样从化学反应中得到最高的产率。 1888年发现“化学平衡移动原理” 。是一个定性预测化学平衡点的原理,又名“勒夏特列原理”。环节三:理解化学平衡移动的原理联系生产:
工业生产N2O4时,采用“控制温度-8 ℃到-10 ℃,将N2O4气体液化后移出”的方法。
对比理论条件和实际生产,分析差异。根据资料卡,简述原因。
环节三:理解化学平衡移动的原理资料卡:
1、工业生产中,采用较高的温度会造成较大的能耗;采用较低的温度会影响反应速率;加压所需的设备成本较高,工业上对于常压下转化率较高的反应,一般不采用加压的方式。
2、四氧化二氮的沸点为21.2℃,熔点为-11.2℃,易液化。
化学平衡移动原理(勒夏特列原理) 只提供生产研究的方向,实际生产中 条件的选择要结合多种考虑因素。
什么是可逆反应?
什么是化学平衡状态?
什么是化学平衡的移动?升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动;
增加压强,平衡向分子数减少的方向移动;
减少压强,平衡向分子数增多的方向移动;
增加(减少)反应物(生成物)浓度,平衡向正反应方向移动;
减少(增加)反应物(生成物)浓度,平衡向逆反应方向移动;利用“改变影响化学平衡的一个因素,平衡向着减弱这种改变的方向进行”解决实际问题。我们眼中化学平衡的移动课外作业(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) △H<0
偏二甲肼(无色) (无色) (无色) (无色) (无色)
利用化学反应原理分析合成氨理论生产的条件,查阅资料获得合成氨实际生产条件,比较两者的差异,分析原因。tmhg181@sohu.com
