江苏省2016年高中化学优质评比(苏教版)高二化学选修四-专题2 第三单元 化学平衡的移动(徐州市第三中学) (共31张PPT)
文档属性
| 名称 | 江苏省2016年高中化学优质评比(苏教版)高二化学选修四-专题2 第三单元 化学平衡的移动(徐州市第三中学) (共31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 11.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-23 09:27:36 | ||
图片预览









文档简介
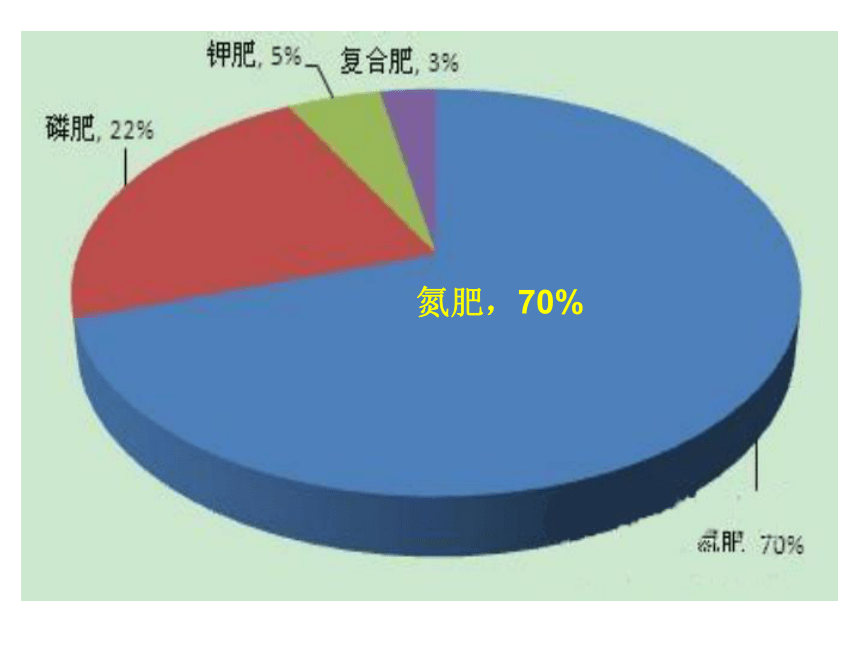
课件31张PPT。化学平衡的移动徐州市第三中学 苏教版选修四专题2氮肥,70% 十九世纪末,法国化学家勒夏特列在高压下进行合成氨,但是因为混入了少量的O2发生了爆炸,而不得不终止了实验。 十九世纪初,有人试图在常压下和50个大气压下进行合成氨试验,结果都失败了。勒夏特列 德国化学家哈伯以锲而不舍的精神,经过不断的试验和计算,终于在1909年取得鼓舞人心的成果!这就是在200个大气压、600℃高温以及在锇的催化作用下,得到产率8%的合成氨!弗雷兹·哈伯弗雷兹·哈伯 1918年,哈伯据此获得诺贝尔化学奖。 1918年,哈伯据此获得诺贝尔化学奖。弗雷兹·哈伯 1931年,波施改进了合成氨的催化剂和耐高压设备,从而获得诺贝尔化学奖。 2007年,埃特尔发现了哈伯-波施法合成氨的催化剂机理而获得了诺贝尔化学奖 。 百年合成氨卡尔·波施 格哈德·埃特尔 化学平衡移动1.化学平衡状态的特征:①各物质浓度 ;
②正反应速率 逆反应速率。 化学平衡状态只有在 下才能保持。
2.化学平衡的移动,就是 外部条件, 原有
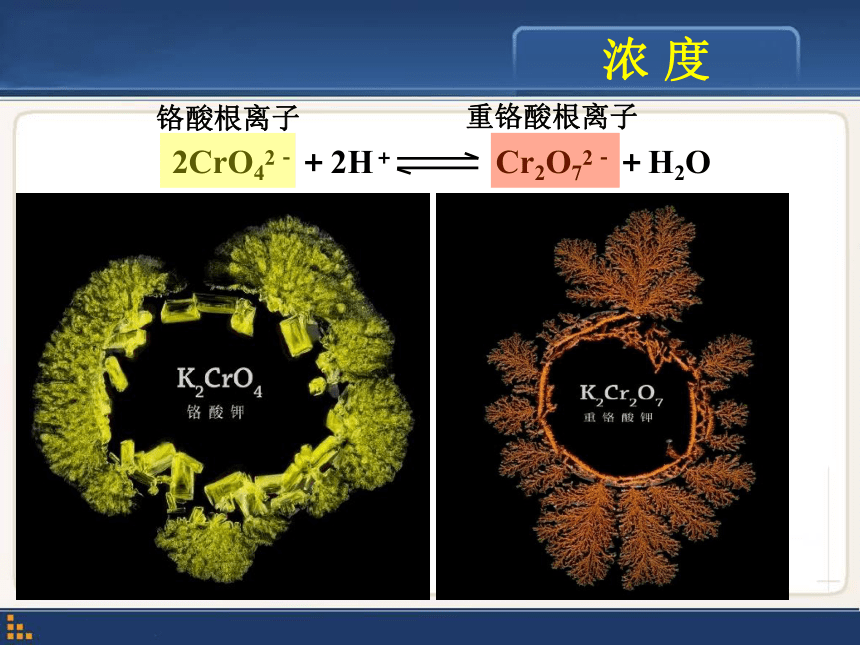
的平衡状态,建立起新的平衡状态的过程。不变 = 一定条件 改变 破坏 温故知新化学平衡状态是有条件的 条件改变 化学平衡移动 正反应方向 逆反应方向 化学平衡移动v(正) ≠v(逆) 化学平衡移动 ?浓 度 2CrO42-+2H+ Cr2O72-+H2O铬酸根离子重铬酸根离子交流与讨论2CrO42-+2H+ Cr2O72-+H2O浓 度 请设计实验方案,研究改变一种离子的浓度对该平衡的影响浓 度实验探究①各加6滴试液2CrO42-+2H+ Cr2O72-+H2O浓 度2CrO42-+2H+ Cr2O72-+H2O向正反应方向移动向逆反应方向移动思考:增大H+浓度时,平衡向着H+浓度( )的方向移动。减小 浓 度 在其他条件不变时,增大或减小某物质浓度,平衡向着减小或增大该物质浓度的方向移动。气体分子数减少的方向气体分子数增多的方向压强减小的方向压强增大的方向实验探究压 强催化剂催化剂测试条件:压力8.2MPa,空速1×104h-1,温度425℃。摘自《DNCA型低温低压氨合成催化剂研制及工业应用》
——杨万成 孙汝君 使用催化剂,对化学平衡无影响催化剂能缩短平衡到达的时间催化剂小 结该物质浓度减小的方向移动 该物质浓度增大的方向移动 向压强减小的方向移动向压强增大的方向移动一句话归纳勒夏特列原理 改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动。(化学平衡移动原理)温 度实验探究 请用勒夏特列原理推测,如果改变温度,平衡如何移动? 温 度实验探究①边做实验边填写实验报告。
②每支试管各取1滴管试液;
③小组要明确分工(实验操作、现象记录、仪器药品处理)。温 度实验探究向正反应方向移动向逆反应方向移动吸热方向 放热方向 温 度向吸热反应方向移动向放热反应方向移动 请结合本节课所学和工业生产实际,分析工业合成氨采取这些措施的原因。工业合成氨N2(g)+3H2(g) 2NH3(g) △H<0将空气变为面包 如何高效、经济地合成SO3? 课后思考 本节课我们有哪些收获呢?总结成果宏观现象 百年合成氨勒夏特列能斯特哈伯波施 埃特尔 百年合成氨投身科学研究 我们都有一颗热爱科学的心!为人类福祉作出贡献
②正反应速率 逆反应速率。 化学平衡状态只有在 下才能保持。
2.化学平衡的移动,就是 外部条件, 原有
的平衡状态,建立起新的平衡状态的过程。不变 = 一定条件 改变 破坏 温故知新化学平衡状态是有条件的 条件改变 化学平衡移动 正反应方向 逆反应方向 化学平衡移动v(正) ≠v(逆) 化学平衡移动 ?浓 度 2CrO42-+2H+ Cr2O72-+H2O铬酸根离子重铬酸根离子交流与讨论2CrO42-+2H+ Cr2O72-+H2O浓 度 请设计实验方案,研究改变一种离子的浓度对该平衡的影响浓 度实验探究①各加6滴试液2CrO42-+2H+ Cr2O72-+H2O浓 度2CrO42-+2H+ Cr2O72-+H2O向正反应方向移动向逆反应方向移动思考:增大H+浓度时,平衡向着H+浓度( )的方向移动。减小 浓 度 在其他条件不变时,增大或减小某物质浓度,平衡向着减小或增大该物质浓度的方向移动。气体分子数减少的方向气体分子数增多的方向压强减小的方向压强增大的方向实验探究压 强催化剂催化剂测试条件:压力8.2MPa,空速1×104h-1,温度425℃。摘自《DNCA型低温低压氨合成催化剂研制及工业应用》
——杨万成 孙汝君 使用催化剂,对化学平衡无影响催化剂能缩短平衡到达的时间催化剂小 结该物质浓度减小的方向移动 该物质浓度增大的方向移动 向压强减小的方向移动向压强增大的方向移动一句话归纳勒夏特列原理 改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动。(化学平衡移动原理)温 度实验探究 请用勒夏特列原理推测,如果改变温度,平衡如何移动? 温 度实验探究①边做实验边填写实验报告。
②每支试管各取1滴管试液;
③小组要明确分工(实验操作、现象记录、仪器药品处理)。温 度实验探究向正反应方向移动向逆反应方向移动吸热方向 放热方向 温 度向吸热反应方向移动向放热反应方向移动 请结合本节课所学和工业生产实际,分析工业合成氨采取这些措施的原因。工业合成氨N2(g)+3H2(g) 2NH3(g) △H<0将空气变为面包 如何高效、经济地合成SO3? 课后思考 本节课我们有哪些收获呢?总结成果宏观现象 百年合成氨勒夏特列能斯特哈伯波施 埃特尔 百年合成氨投身科学研究 我们都有一颗热爱科学的心!为人类福祉作出贡献
