人教版高一化学必修1课件:第二章第三节氧化还原反应(共26张PPT)
文档属性
| 名称 | 人教版高一化学必修1课件:第二章第三节氧化还原反应(共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 60.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-24 00:00:00 | ||
图片预览







文档简介
课件26张PPT。第二章 化学物质及其变化 第三节 氧化还原反应
思考与交流1.请举几个氧化反应和还原反应的实例,指出这类化学反应的分类标准是什么?CuO + H2 = Cu + H2O 中CuO失氧,发生还原反应;H2得氧,发生氧化反应。2CuO + C = 2Cu + CO2中CuO失氧,发生还原反应;C得氧,发生氧化反应。分类标准:得氧失氧2.氧化反应和还原反应是分别独立进行的吗?氧化反应和还原反应总是同时进行的。思考与交流+200+1化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 === Cu + H2O二、从化合价升降角度分析:[问题]下列反应是否属于氧化还原反应?
2Na+Cl2 === 2NaCl
2H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
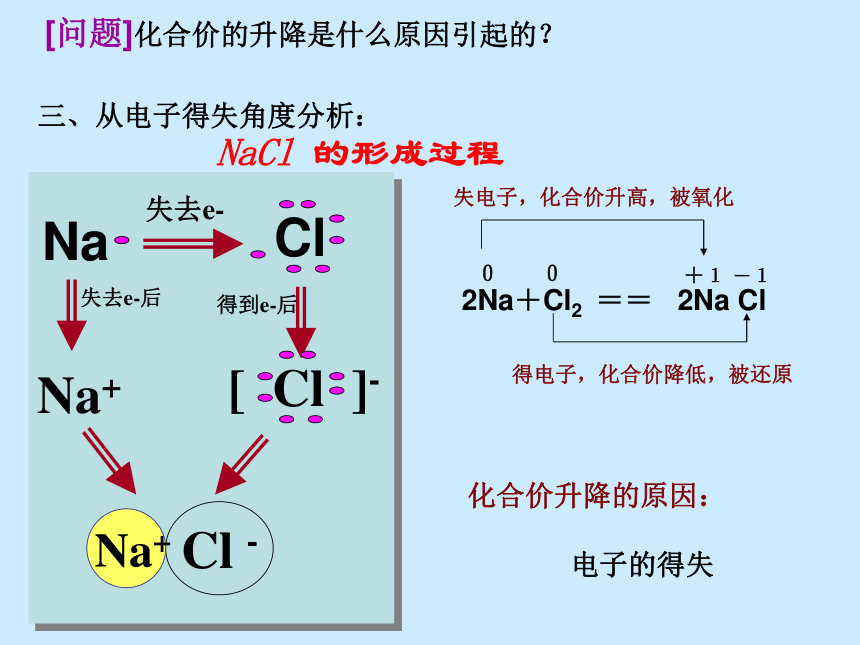
[结论]因为有化合价升降,所以是氧化还原反应。[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+三、从电子得失角度分析:1.氧化还原反应的概念:
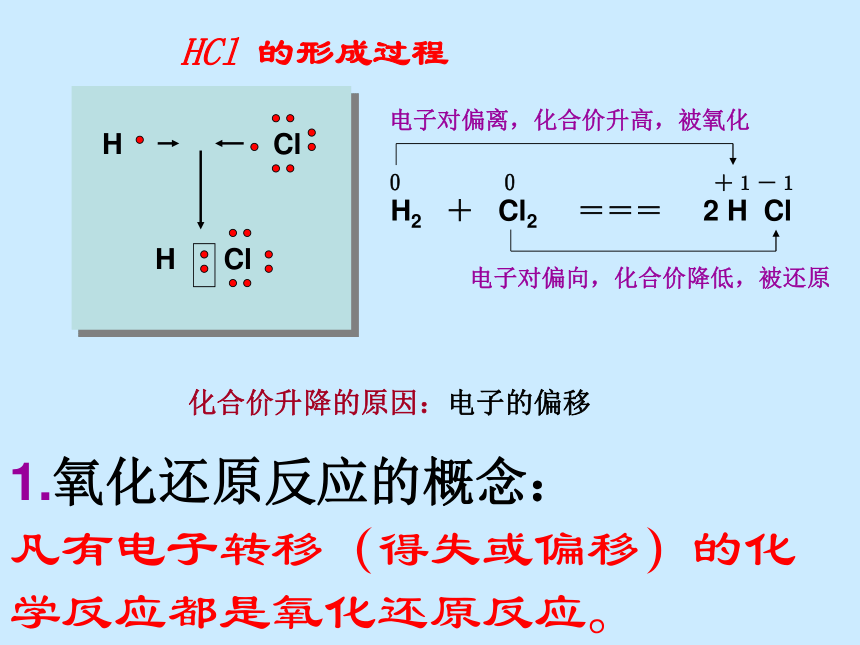
凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。HCl 的形成过程化合价升降的原因:电子的偏移H Cl小结 氧化还原反应◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧
被还原的化学反应是氧化还原反应。
说明:仅局限于得氧失氧的反应。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的
化学反应是氧化还原反应。
说明:氧化还原反应的本质是电子转移。
下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O
B. Na2O + H2O == 2NaOH
C. 2KMnO4 == K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 == Fe3O4
CuSO4·5H2O == CuSO4 + 5H2O
CDE10 下列反应中,既是离子反应,又是氧化还原反应的是( )
A、 CaCO3 +HCl
B、 AgNO3 + NaCl
C、 Fe+CuSO4
D、 NaOH+ H2SO4C2.氧化剂和还原剂 氧化剂:得到电子(或电子对偏向)的物质【所含元素化合价降低的物质】
还原剂:失去电子(或电子对偏离)的物质 【所含元素化合价升高的物质】3.氧化产物和还原产物 氧化产物:还原剂失去电子被氧化后的生成物还原产物:氧化剂得电子被还原后的生成物例.指出下列反应中的氧化剂和还原剂,氧化产物和还原产物.
MnO2+4HCl=MnCl2+Cl2 +2H2O136、HNO2在反应中既可作还原剂又可作氧化剂 的,当它作还原剂时,其氧化产物可能是( )
①NH3 ②N2 ③NO2 ④HNO3
A、只有① B、 ①或②
C、只有 ④ D、 ③或④D+3-30+4+54.氧化性和还原性氧化性:氧化剂夺电子的性质(或称氧 化能力)
还原性:还原剂失电子的性质(或还原能力) 氧化剂具有氧化性
还原剂具有还原性152、在下列变化中,必须加入氧化剂才能实现的是( )
A 、CaCO3 CO2
B、Fe Fe 2+
C、Na Na+
D、 Cu 2+ CuB、 C16物质所含元素的化合价是最高价,物质所含元素的化合价是最低价,物质所含元素的化合价处于中间价态时,物质的氧化性、还原性如何?思考:(3)物质所含元素的化合价处于中间价态,该
物质既具有氧化性又具有还原性(1)物质所含元素的化合价是最高价,该物
质只有氧化性(2)物质所含元素的化合价是最低价,该物
质只有还原性173、在Fe、Cl-、H+、F2中,能得电子的微粒有
,是 剂,表现出 性
;具有还原性的微粒是 ,它们在反应中 电子,发生 反应,其化合价 。
在Fe2+、Fe3+、Al3+、H+、S、C、S2-、Cl-等
离子或原子中,只有还原性是: ,
只有的氧化性是 ,既有氧化性又有还原性是 。H+、F2 氧化 氧化
Fe、Cl-
失去 氧化
升高 S2-、Cl-
Fe3+、Al3+、H+
Fe2+、S、C规律:高价氧化、低价还原、中间价态两边转185、能说明亚硫酸盐具有氧化性的是( )
A、SO2+2NaOH==Na2SO3+H2O
B、SO32-+2S2- +6H+ ==3S↓+3H2O
C、 SO32- +2H+ ==SO2↑+H2O
D、SO32- +H2O+Cl2=SO42 - +2H+ +2Cl-B+4 +4+4 -2 0+4 +4+4 0 +6 -119氧化性、还原性的比较氧化剂+还原剂=氧化产物+还原产物氧化性:氧化剂>氧化产物
还原性: 还原剂>还原产物常见的氧化剂、还原剂:20根据反应
2H2S+O2==2S↓+2H2O,
4NaI+O2+2H2O==2I2+4NaOH,
Na2S+I2==2NaI+S↓,
判断氧化性强弱顺序是( )
A.O2>S>I2 B.S>I2>O2
C.I2>S>O2 D.O2>I2>SD214、下列物质不能作为还原剂的是( )
A H2S B Fe2+ C Fe3+ D SO25、亚硝酸(HNO2)参加反应时,既可作氧化剂,又可作还原剂,当它作氧化剂时,可能生成的产物是( )
A NH3 B HNO3 C N2O5 D N2O3CA 常见的氧化剂有:
①活泼的非金属单质如:卤素单质 (X2)、 O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、酸化KMnO4。
常见的还原剂有:
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S等。 3.分析表格,找出四种基本反应类型与氧化还原反应的关系。[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。√×√×√√××氧化还原反应与四种基本反应的关系如下图:非氧化还原反应交叉分类图(2)几个概念间的关系:
思考与交流1.请举几个氧化反应和还原反应的实例,指出这类化学反应的分类标准是什么?CuO + H2 = Cu + H2O 中CuO失氧,发生还原反应;H2得氧,发生氧化反应。2CuO + C = 2Cu + CO2中CuO失氧,发生还原反应;C得氧,发生氧化反应。分类标准:得氧失氧2.氧化反应和还原反应是分别独立进行的吗?氧化反应和还原反应总是同时进行的。思考与交流+200+1化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 === Cu + H2O二、从化合价升降角度分析:[问题]下列反应是否属于氧化还原反应?
2Na+Cl2 === 2NaCl
2H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+三、从电子得失角度分析:1.氧化还原反应的概念:
凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。HCl 的形成过程化合价升降的原因:电子的偏移H Cl小结 氧化还原反应◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧
被还原的化学反应是氧化还原反应。
说明:仅局限于得氧失氧的反应。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
说明:元素化合价升降是氧化还原反应的表观特征,
可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的
化学反应是氧化还原反应。
说明:氧化还原反应的本质是电子转移。
下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O
B. Na2O + H2O == 2NaOH
C. 2KMnO4 == K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 == Fe3O4
CuSO4·5H2O == CuSO4 + 5H2O
CDE10 下列反应中,既是离子反应,又是氧化还原反应的是( )
A、 CaCO3 +HCl
B、 AgNO3 + NaCl
C、 Fe+CuSO4
D、 NaOH+ H2SO4C2.氧化剂和还原剂 氧化剂:得到电子(或电子对偏向)的物质【所含元素化合价降低的物质】
还原剂:失去电子(或电子对偏离)的物质 【所含元素化合价升高的物质】3.氧化产物和还原产物 氧化产物:还原剂失去电子被氧化后的生成物还原产物:氧化剂得电子被还原后的生成物例.指出下列反应中的氧化剂和还原剂,氧化产物和还原产物.
MnO2+4HCl=MnCl2+Cl2 +2H2O136、HNO2在反应中既可作还原剂又可作氧化剂 的,当它作还原剂时,其氧化产物可能是( )
①NH3 ②N2 ③NO2 ④HNO3
A、只有① B、 ①或②
C、只有 ④ D、 ③或④D+3-30+4+54.氧化性和还原性氧化性:氧化剂夺电子的性质(或称氧 化能力)
还原性:还原剂失电子的性质(或还原能力) 氧化剂具有氧化性
还原剂具有还原性152、在下列变化中,必须加入氧化剂才能实现的是( )
A 、CaCO3 CO2
B、Fe Fe 2+
C、Na Na+
D、 Cu 2+ CuB、 C16物质所含元素的化合价是最高价,物质所含元素的化合价是最低价,物质所含元素的化合价处于中间价态时,物质的氧化性、还原性如何?思考:(3)物质所含元素的化合价处于中间价态,该
物质既具有氧化性又具有还原性(1)物质所含元素的化合价是最高价,该物
质只有氧化性(2)物质所含元素的化合价是最低价,该物
质只有还原性173、在Fe、Cl-、H+、F2中,能得电子的微粒有
,是 剂,表现出 性
;具有还原性的微粒是 ,它们在反应中 电子,发生 反应,其化合价 。
在Fe2+、Fe3+、Al3+、H+、S、C、S2-、Cl-等
离子或原子中,只有还原性是: ,
只有的氧化性是 ,既有氧化性又有还原性是 。H+、F2 氧化 氧化
Fe、Cl-
失去 氧化
升高 S2-、Cl-
Fe3+、Al3+、H+
Fe2+、S、C规律:高价氧化、低价还原、中间价态两边转185、能说明亚硫酸盐具有氧化性的是( )
A、SO2+2NaOH==Na2SO3+H2O
B、SO32-+2S2- +6H+ ==3S↓+3H2O
C、 SO32- +2H+ ==SO2↑+H2O
D、SO32- +H2O+Cl2=SO42 - +2H+ +2Cl-B+4 +4+4 -2 0+4 +4+4 0 +6 -119氧化性、还原性的比较氧化剂+还原剂=氧化产物+还原产物氧化性:氧化剂>氧化产物
还原性: 还原剂>还原产物常见的氧化剂、还原剂:20根据反应
2H2S+O2==2S↓+2H2O,
4NaI+O2+2H2O==2I2+4NaOH,
Na2S+I2==2NaI+S↓,
判断氧化性强弱顺序是( )
A.O2>S>I2 B.S>I2>O2
C.I2>S>O2 D.O2>I2>SD214、下列物质不能作为还原剂的是( )
A H2S B Fe2+ C Fe3+ D SO25、亚硝酸(HNO2)参加反应时,既可作氧化剂,又可作还原剂,当它作氧化剂时,可能生成的产物是( )
A NH3 B HNO3 C N2O5 D N2O3CA 常见的氧化剂有:
①活泼的非金属单质如:卤素单质 (X2)、 O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、酸化KMnO4。
常见的还原剂有:
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S等。 3.分析表格,找出四种基本反应类型与氧化还原反应的关系。[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。√×√×√√××氧化还原反应与四种基本反应的关系如下图:非氧化还原反应交叉分类图(2)几个概念间的关系:
