人教版化学必修2课件:1.1元素周期表(共69张PPT)
文档属性
| 名称 | 人教版化学必修2课件:1.1元素周期表(共69张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-24 07:02:20 | ||
图片预览








文档简介
课件69张PPT。第一章 物质结构 元素周期表第一节 元素周期表
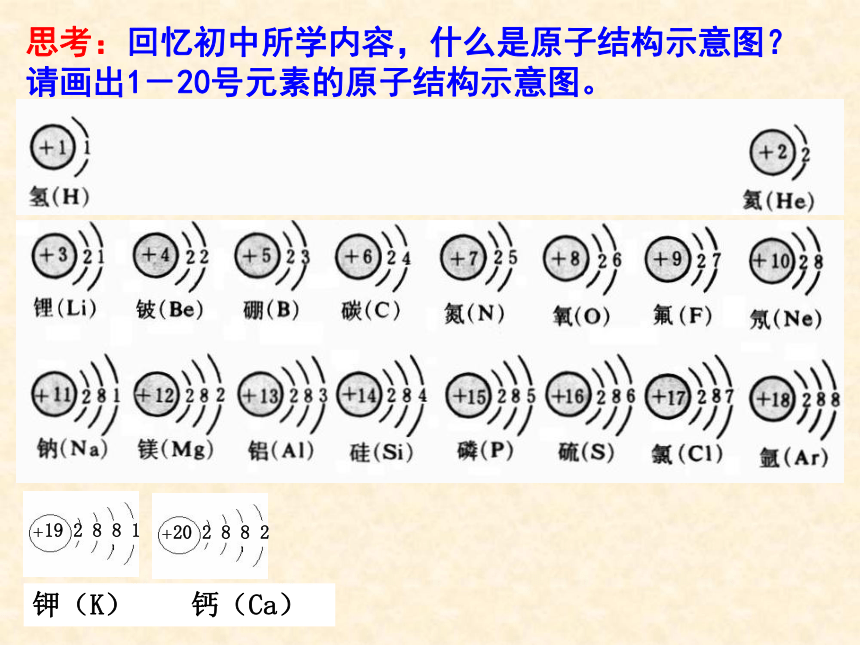
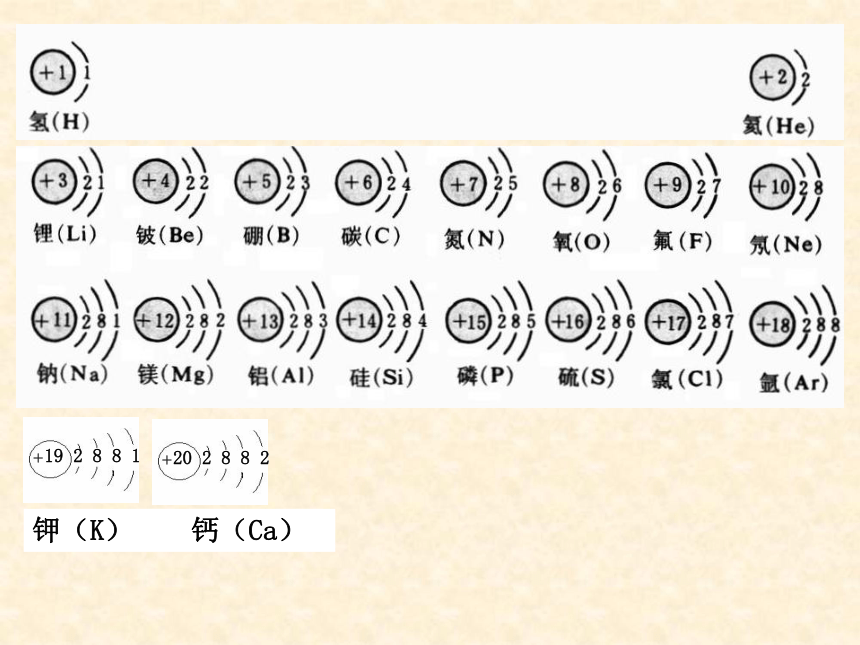
(第一课时)化学Ⅱ 思考:回忆初中所学内容,什么是原子结构示意图? 请画出1-20号元素的原子结构示意图。(阳离子的)核电荷数 = 质子数 > 核外电子数
(阴离子的)核电荷数 = 质子数 < 核外电子数(原子的)核电荷数 = 质子数 = 核外电子数 规律:观察比较1-20号元素的原子结构示意图,你能发现这些元素之间存在哪些规律吗?元素周期表的由来从18世纪中叶到19世纪中叶一百年间,一系列的新元素接连不断地被发现,关于这些元素的理化性质也积累的非常丰富,但是一个更大的黑洞吸引着科学家,这些元素之间有怎样的内在联系呢? 1869年,俄国化学家
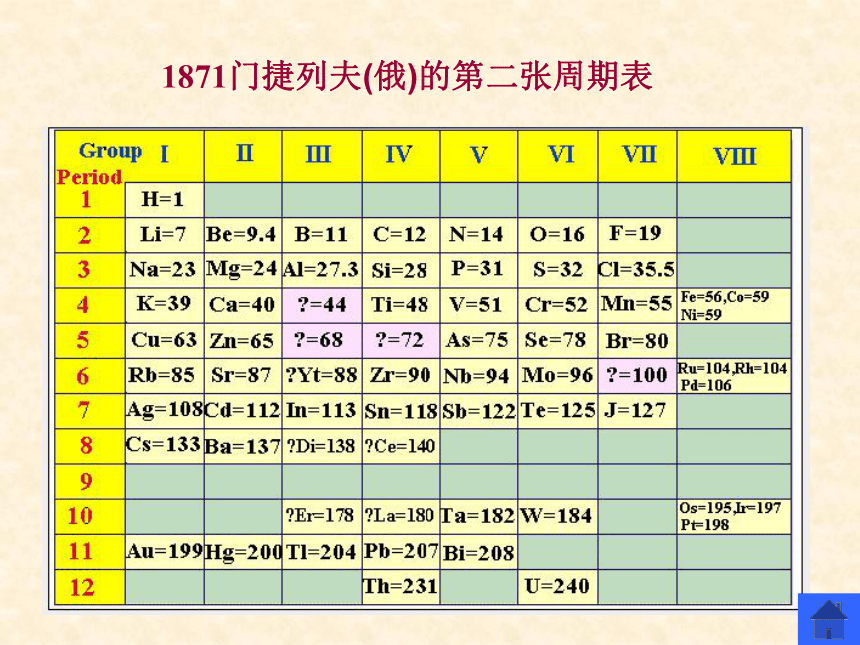
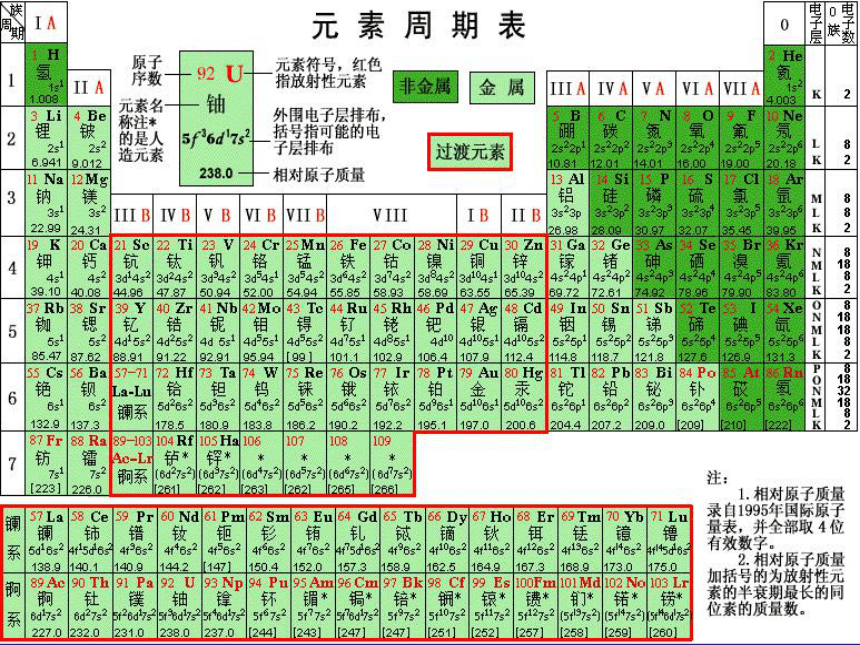
门捷列夫将元素按照相对原子质量由小到大依次排列,通过分类归纳,制出了第一张元素周期表,揭示了化学元素间的内在联系,使其构成了一个完整的体系,成为化学发展史上重要的里程碑之一。 门捷列夫的最大贡献是发现了化学元素周期律。他在前人的基础上,总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着原子量(相对原子质量)的递增而呈周期性的变化,这就是元素周期律。他根据元素周期律于1869年编制了第一个元素周期表,把已经发现的63种元素全部列入表里,从而初步完成了使元素系统化的任务。元素周期律的发现激起了人们发现新元素和研究无机化学理论的热潮,元素周期律的发现在化学发展史上是一个重要的里程碑,人们为了纪念他的功绩,就把元素周期律和周期表称为门捷列夫元素周期律和门捷列夫元素周期表。1955年科学家们为了纪念元素周期律的发现者门捷列夫,将101号元素命名为钔。 1869年2月 门捷列夫(俄)的第一张周期表?1871门捷列夫(俄)的第二张周期表?[思考与交流] (观察元素周期表)原子序数=核电荷数=质子数=核外电子数我们按照元素在周期表中的顺序给元素编号,得到原子序数。可见原子序数与原子结构间存在什么关系?(结合1-20号元素原子结构)一、元素周期表
1、原子结构原子序数=核电荷数=质子数=核外电子数原子序数:按照元素在周期表中的顺序给元素编的号2、元素周期表
(1)元素周期表编排原则A、把电子层数相同的元素按原子序数递增的顺序由左到右排成一个横排。 B、把不同横行中最外层电子数相同的元素按电子层数递增的顺序由上到下排成纵行。 (2)元素周期表的结构:
具有相同电子层数而又按照原子序数递增顺序由左往右排列的一系列元素(每一横排称为一周期)。周期序数 = 电子层数1、周期:它们分别位于第几周期?为什么? 第二周期
两个电子层第四周期
四个电子层【课堂练习】第三周期
三个电子层周期短周期长周期第一周期:2 种元素 第二周期:8 种元素第三周期:8 种元素第四周期:18 种元素第五周期:18 种元素第六周期:32 种元素第七周期:26种元素(镧系元素)(锕系元素)周期序数 = 电子层数 (横行)三长三短一不全2、族: 主族序数=最外层电子数不同横行中最外层电子数相同的元素按电子层数递增的顺序由上到下排成纵行(除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行为一族)。 族
纵行主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第Ⅷ族:稀有气体元素 0族:共七个主族ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间 主族序数=最外层电子数七主七副零八族IAIIAIIIAIVAV
AVIAVIIA0主族副族八族零族族的结构族的别称第ⅠA族称为 元素 , 第ⅥA族称为 元素
第ⅡA族称为 元素, 第ⅦA族称为 元素
第ⅣA族称为 元素,
第ⅤA族称为 元素, 零族称为 元素碱金属 碱土金属 碳族氮族氧族 卤族稀有气体思考:1 、 Cl的位置的描述:第七主族VII族VIIA族第III周期第三周期第3周期第三周期第VIIA族2、哪周期元素种类最多?族呢?1、主族元素在周期表中所处的位置,取决于该元素的
(A)最外层电子数和相对原子质量
(B)相对原子质量和核外电子数
(C)次外层电子数和电子层数
(D)电子层数和最外层电子数D【课堂练习】 2、下列各图若为元素周期表中的一部分(表中数字为原子序数),其中X为35的是AD课堂练习1.已知某主族元素的原子结构示意图如 下,判断其位于第几周期?第几族?Y+532818187第三周期第IA族第五周期第VIIA族2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数BX3.下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D在短周期元素中,原子最外电子层只有1个
或2个电子的元素是 ( )
A.金属元素
B.稀有气体元素
C.非金属元素
D.无法确定为哪一类元素D练习与思考: 下列叙述错误的是
(A)把最外层电子数相同的元素按
电子层数递增排成8行
(B)主族元素在周期表中的位置决定
于该元素原子的电子层数和最外
层电子数
(C)元素周期表是元素周期律的具体
表现形式
(D)把电子层数相同的各元素按原子
序数递增排成七个横行A国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。如碱金属元素为第1列,稀有气体元素为第18列。下列说法错误的是( )
A、第9列元素中没有非金属元素
B、只有第2列元素原子最外层有2个电子
C、第15列元素的最高价氧化物的化学式为R2O5
D、在整个18列元素中,第3列的元素种类最多B练习 推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。 第6号元素: 6-2=4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34-18=16 第四周期第ⅥA 族。 第53号元素: 53-36=17 第五周期第ⅦA 族。 第88号元素: 88-86 =2 第七周期第ⅡA 族。 第82号元素: 82-54 =28 第六周期第ⅣA 族。28-14=14推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA练习与思考: A、B、C是周期表中相邻的三种元素,
其中A、B是同周期,B、C是同主族。此三
种元素原子最外层电子数之和为17,质子数
之和为31,则A、B、C分别为什么元素?观察,可得 A是氮元素
B是氧元素
C是硫元素练习与思考:第三周期第IVA族的元素原子序数是: 。
Na元素的原子序数为11,相邻的同族元素的原子序数是: 。
短周期元素中,族序数=周期序数的元素有:
。
族序数等于周期序数2倍的元素有: 。
周期序数=族序数2倍的有: 。 14 3、19 H、Be 、 Al C S Li、Ca 练习与思考: 2、推算原子序数为6,13,34,53的元素在周期表中的位置。 第6号元素: 6-2=4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34-18=16 第四周期第ⅥA 族。 第53号元素: 53-36=17 第五周期第ⅦA 族。扇形元素周期表立式周期表螺旋式环式放射式层式透视式棱台型元素周期表展示电子排布的周期表门捷列夫(1834-1907)俄国化学家。 1834年2月7日生于西伯利亚托博尔斯克,1907年2月2日卒于彼得堡(今列宁格勒)。1850年入 彼得堡师范学院学习化学,1855年毕业后任敖德萨中学教师。1857年任彼得堡大学副教授。1859年他到德国海德堡大学深造。1860年参加了在卡尔斯鲁厄召开的国际化学家代表大会。1861年回彼得堡从事科学著述工作。1863年任工艺学院教授,1865年获化学博士学位。1866年任彼得堡大学普通化学教授,1867年任化学教研室主任。1893年起,任度量衡局局长。1890年当选为英国皇家学会外国会员。门捷列夫简介门捷列夫的最大贡献是发现了化学元素周期律。他在前人的基础上,总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着原子量(相对原子质量)的递增而呈周期性的变化,这就是元素周期律。他根据元素周期律于1869年编制了第一个元素周期表,把已经发现的63种元素全部列入表里,从而初步完成了使元素系统化的任务。元素周期律的发现激起了人们发现新元素和研究无机化学理论的热潮,元素周期律的发现在化学发展史上是一个重要的里程碑,人们为了纪念他的功绩,就把元素周期律和周期表称为门捷列夫元素周期律和门捷列夫元素周期表。1955年科学家们为了纪念元素周期律的发现者门捷列夫,将101号元素命名为钔。 氦原子结构示意图三、核素:(一)原子的结构: 1、原子原子核核外电子 质子 中子{{1.007 1.008 1/1836 构成原子的粒子及其性质【思考与交流】 从表格得出原子的质量主要取决于哪种微粒?
1.原子的质量主要集中在 ,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有
叫做质量数。
2、质量数与质子数和中子数间的关系。
质量数(A)= + )原子核质子和中子的相对质量取近似整数相加质子数 Z中子数 N 我们为了方便地表示某一原子。在元素符号的左下角表出其质子数Z,左上角标出质量数A。
Z A c d各代表什么?Z——代表质子数;
A——代表质量数;
c——代表离子的价态;
d——原子个数课堂练习101340171835123复习元素的定义:想一想:原子的质子数相同,中子数是不是相同呢? 元素是具有相同核电荷数(质子数)
一类原子的总称。1、核素: 具有一定数目的质子和一定数目
的中子的一种原子。 氢元素的三种原子111012★2、同位素:质子数相同而中子数不同的同一元素
的不同原子,互称同位素。O : 8O 8O 8O
C : 6C 6C 6C
U : 92U 92U 92U
Cl : 17Cl 17Cl1617181213142342352363537核素同位素4、元素、核素、同位素三者之间的关系: 1.同一种元素,可以有若干种不同的核素; 2.同位素是同一元素的不同核素之间的互称; 课堂练习4、在(1)Li、(2) N (3) Na、(4) Mg、(5) Li、(6) C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。(1)(5)(2)(6)(3)(4)1.下列叙述正确的是( )A. 氢有三种核素,即有三种氢原子.
B. 所有元素的原子核均由质子和中子构成.
C. 具有相同的核外电子数的粒子,总称为元素.
D. 1H是一种同位素3A练习1:A、氢的5种同位素 B、5种氢元素
C、氢的五种同素异形体
D、氢元素的5种不同微粒 H+、H2是( )同素异形体是指同一种元素形成的多种不同单质 D★3、同位素的性质:(2)同一元素的各种同位素虽然质量数
不同,但它们的化学性质几乎完全相同。(3)天然存在的某种元素里,各种同位素
所占的原子个数百分比一般是不变的。(1)同位素在周期表里占据同一位置 5、同位素举例及应用(1)H的三种同位素:
(2)U的三种同位素:
是造原子弹及核反应堆的材料。(3)C的三种同位素:
是原子量的标准 是制造氢弹的材料。92U2346C126C12二、元素的(平均)相对原子质量: 同位素的相对原子质量:是各同位素原子的真实质量分别与 C的真实质量1/12的比值。二、元素的(平均)相对原子质量: =A1×a1%+A2×a2%+… 其中A1、A2…为同位素的相对原子质量 a1%、a2%…为同位素原子的个数分数或摩尔分数(不代表质量分数)元素的(平均)相对原子质量: 按各种天然同位素原子所占的一定的百分比算出的平均值
原子 相对原子质量 比率
35Cl 34.969 75.77% 37Cl 36.966 24.23% 34.969×0.7577+36.966×0.2423
=35.453,
即:氯的相对原子质量为35.453。练习3:已知某元素X的一种同位素的质量数为A,中子数为N,则下列判断不正确的是( ) A.这种同位素的符号可表示为 X B.A可代表这种同位素的近似相对原
子质量(质量数)
C.A小于X的元素的相对原子质量
D.A不能代表X元素的相对原子质量 AA-NC小结:2、(1)同一元素的各种同位素虽然质量数
不同,但它们的化学性质几乎完全相同。1、质子数相同而中子数不同的同一元素的不同原子,互称同位素。(2)天然存在的某种元素里,各种同位素
所占的原子个数百分比一般是不变的。
(第一课时)化学Ⅱ 思考:回忆初中所学内容,什么是原子结构示意图? 请画出1-20号元素的原子结构示意图。(阳离子的)核电荷数 = 质子数 > 核外电子数
(阴离子的)核电荷数 = 质子数 < 核外电子数(原子的)核电荷数 = 质子数 = 核外电子数 规律:观察比较1-20号元素的原子结构示意图,你能发现这些元素之间存在哪些规律吗?元素周期表的由来从18世纪中叶到19世纪中叶一百年间,一系列的新元素接连不断地被发现,关于这些元素的理化性质也积累的非常丰富,但是一个更大的黑洞吸引着科学家,这些元素之间有怎样的内在联系呢? 1869年,俄国化学家
门捷列夫将元素按照相对原子质量由小到大依次排列,通过分类归纳,制出了第一张元素周期表,揭示了化学元素间的内在联系,使其构成了一个完整的体系,成为化学发展史上重要的里程碑之一。 门捷列夫的最大贡献是发现了化学元素周期律。他在前人的基础上,总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着原子量(相对原子质量)的递增而呈周期性的变化,这就是元素周期律。他根据元素周期律于1869年编制了第一个元素周期表,把已经发现的63种元素全部列入表里,从而初步完成了使元素系统化的任务。元素周期律的发现激起了人们发现新元素和研究无机化学理论的热潮,元素周期律的发现在化学发展史上是一个重要的里程碑,人们为了纪念他的功绩,就把元素周期律和周期表称为门捷列夫元素周期律和门捷列夫元素周期表。1955年科学家们为了纪念元素周期律的发现者门捷列夫,将101号元素命名为钔。 1869年2月 门捷列夫(俄)的第一张周期表?1871门捷列夫(俄)的第二张周期表?[思考与交流] (观察元素周期表)原子序数=核电荷数=质子数=核外电子数我们按照元素在周期表中的顺序给元素编号,得到原子序数。可见原子序数与原子结构间存在什么关系?(结合1-20号元素原子结构)一、元素周期表
1、原子结构原子序数=核电荷数=质子数=核外电子数原子序数:按照元素在周期表中的顺序给元素编的号2、元素周期表
(1)元素周期表编排原则A、把电子层数相同的元素按原子序数递增的顺序由左到右排成一个横排。 B、把不同横行中最外层电子数相同的元素按电子层数递增的顺序由上到下排成纵行。 (2)元素周期表的结构:
具有相同电子层数而又按照原子序数递增顺序由左往右排列的一系列元素(每一横排称为一周期)。周期序数 = 电子层数1、周期:它们分别位于第几周期?为什么? 第二周期
两个电子层第四周期
四个电子层【课堂练习】第三周期
三个电子层周期短周期长周期第一周期:2 种元素 第二周期:8 种元素第三周期:8 种元素第四周期:18 种元素第五周期:18 种元素第六周期:32 种元素第七周期:26种元素(镧系元素)(锕系元素)周期序数 = 电子层数 (横行)三长三短一不全2、族: 主族序数=最外层电子数不同横行中最外层电子数相同的元素按电子层数递增的顺序由上到下排成纵行(除第8、9、10三个纵行叫做第Ⅷ族外,其余每个纵行为一族)。 族
纵行主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第Ⅷ族:稀有气体元素 0族:共七个主族ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间 主族序数=最外层电子数七主七副零八族IAIIAIIIAIVAV
AVIAVIIA0主族副族八族零族族的结构族的别称第ⅠA族称为 元素 , 第ⅥA族称为 元素
第ⅡA族称为 元素, 第ⅦA族称为 元素
第ⅣA族称为 元素,
第ⅤA族称为 元素, 零族称为 元素碱金属 碱土金属 碳族氮族氧族 卤族稀有气体思考:1 、 Cl的位置的描述:第七主族VII族VIIA族第III周期第三周期第3周期第三周期第VIIA族2、哪周期元素种类最多?族呢?1、主族元素在周期表中所处的位置,取决于该元素的
(A)最外层电子数和相对原子质量
(B)相对原子质量和核外电子数
(C)次外层电子数和电子层数
(D)电子层数和最外层电子数D【课堂练习】 2、下列各图若为元素周期表中的一部分(表中数字为原子序数),其中X为35的是AD课堂练习1.已知某主族元素的原子结构示意图如 下,判断其位于第几周期?第几族?Y+532818187第三周期第IA族第五周期第VIIA族2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数BX3.下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D在短周期元素中,原子最外电子层只有1个
或2个电子的元素是 ( )
A.金属元素
B.稀有气体元素
C.非金属元素
D.无法确定为哪一类元素D练习与思考: 下列叙述错误的是
(A)把最外层电子数相同的元素按
电子层数递增排成8行
(B)主族元素在周期表中的位置决定
于该元素原子的电子层数和最外
层电子数
(C)元素周期表是元素周期律的具体
表现形式
(D)把电子层数相同的各元素按原子
序数递增排成七个横行A国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。如碱金属元素为第1列,稀有气体元素为第18列。下列说法错误的是( )
A、第9列元素中没有非金属元素
B、只有第2列元素原子最外层有2个电子
C、第15列元素的最高价氧化物的化学式为R2O5
D、在整个18列元素中,第3列的元素种类最多B练习 推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。 第6号元素: 6-2=4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34-18=16 第四周期第ⅥA 族。 第53号元素: 53-36=17 第五周期第ⅦA 族。 第88号元素: 88-86 =2 第七周期第ⅡA 族。 第82号元素: 82-54 =28 第六周期第ⅣA 族。28-14=14推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA练习与思考: A、B、C是周期表中相邻的三种元素,
其中A、B是同周期,B、C是同主族。此三
种元素原子最外层电子数之和为17,质子数
之和为31,则A、B、C分别为什么元素?观察,可得 A是氮元素
B是氧元素
C是硫元素练习与思考:第三周期第IVA族的元素原子序数是: 。
Na元素的原子序数为11,相邻的同族元素的原子序数是: 。
短周期元素中,族序数=周期序数的元素有:
。
族序数等于周期序数2倍的元素有: 。
周期序数=族序数2倍的有: 。 14 3、19 H、Be 、 Al C S Li、Ca 练习与思考: 2、推算原子序数为6,13,34,53的元素在周期表中的位置。 第6号元素: 6-2=4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34-18=16 第四周期第ⅥA 族。 第53号元素: 53-36=17 第五周期第ⅦA 族。扇形元素周期表立式周期表螺旋式环式放射式层式透视式棱台型元素周期表展示电子排布的周期表门捷列夫(1834-1907)俄国化学家。 1834年2月7日生于西伯利亚托博尔斯克,1907年2月2日卒于彼得堡(今列宁格勒)。1850年入 彼得堡师范学院学习化学,1855年毕业后任敖德萨中学教师。1857年任彼得堡大学副教授。1859年他到德国海德堡大学深造。1860年参加了在卡尔斯鲁厄召开的国际化学家代表大会。1861年回彼得堡从事科学著述工作。1863年任工艺学院教授,1865年获化学博士学位。1866年任彼得堡大学普通化学教授,1867年任化学教研室主任。1893年起,任度量衡局局长。1890年当选为英国皇家学会外国会员。门捷列夫简介门捷列夫的最大贡献是发现了化学元素周期律。他在前人的基础上,总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着原子量(相对原子质量)的递增而呈周期性的变化,这就是元素周期律。他根据元素周期律于1869年编制了第一个元素周期表,把已经发现的63种元素全部列入表里,从而初步完成了使元素系统化的任务。元素周期律的发现激起了人们发现新元素和研究无机化学理论的热潮,元素周期律的发现在化学发展史上是一个重要的里程碑,人们为了纪念他的功绩,就把元素周期律和周期表称为门捷列夫元素周期律和门捷列夫元素周期表。1955年科学家们为了纪念元素周期律的发现者门捷列夫,将101号元素命名为钔。 氦原子结构示意图三、核素:(一)原子的结构: 1、原子原子核核外电子 质子 中子{{1.007 1.008 1/1836 构成原子的粒子及其性质【思考与交流】 从表格得出原子的质量主要取决于哪种微粒?
1.原子的质量主要集中在 ,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有
叫做质量数。
2、质量数与质子数和中子数间的关系。
质量数(A)= + )原子核质子和中子的相对质量取近似整数相加质子数 Z中子数 N 我们为了方便地表示某一原子。在元素符号的左下角表出其质子数Z,左上角标出质量数A。
Z A c d各代表什么?Z——代表质子数;
A——代表质量数;
c——代表离子的价态;
d——原子个数课堂练习101340171835123复习元素的定义:想一想:原子的质子数相同,中子数是不是相同呢? 元素是具有相同核电荷数(质子数)
一类原子的总称。1、核素: 具有一定数目的质子和一定数目
的中子的一种原子。 氢元素的三种原子111012★2、同位素:质子数相同而中子数不同的同一元素
的不同原子,互称同位素。O : 8O 8O 8O
C : 6C 6C 6C
U : 92U 92U 92U
Cl : 17Cl 17Cl1617181213142342352363537核素同位素4、元素、核素、同位素三者之间的关系: 1.同一种元素,可以有若干种不同的核素; 2.同位素是同一元素的不同核素之间的互称; 课堂练习4、在(1)Li、(2) N (3) Na、(4) Mg、(5) Li、(6) C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。(1)(5)(2)(6)(3)(4)1.下列叙述正确的是( )A. 氢有三种核素,即有三种氢原子.
B. 所有元素的原子核均由质子和中子构成.
C. 具有相同的核外电子数的粒子,总称为元素.
D. 1H是一种同位素3A练习1:A、氢的5种同位素 B、5种氢元素
C、氢的五种同素异形体
D、氢元素的5种不同微粒 H+、H2是( )同素异形体是指同一种元素形成的多种不同单质 D★3、同位素的性质:(2)同一元素的各种同位素虽然质量数
不同,但它们的化学性质几乎完全相同。(3)天然存在的某种元素里,各种同位素
所占的原子个数百分比一般是不变的。(1)同位素在周期表里占据同一位置 5、同位素举例及应用(1)H的三种同位素:
(2)U的三种同位素:
是造原子弹及核反应堆的材料。(3)C的三种同位素:
是原子量的标准 是制造氢弹的材料。92U2346C126C12二、元素的(平均)相对原子质量: 同位素的相对原子质量:是各同位素原子的真实质量分别与 C的真实质量1/12的比值。二、元素的(平均)相对原子质量: =A1×a1%+A2×a2%+… 其中A1、A2…为同位素的相对原子质量 a1%、a2%…为同位素原子的个数分数或摩尔分数(不代表质量分数)元素的(平均)相对原子质量: 按各种天然同位素原子所占的一定的百分比算出的平均值
原子 相对原子质量 比率
35Cl 34.969 75.77% 37Cl 36.966 24.23% 34.969×0.7577+36.966×0.2423
=35.453,
即:氯的相对原子质量为35.453。练习3:已知某元素X的一种同位素的质量数为A,中子数为N,则下列判断不正确的是( ) A.这种同位素的符号可表示为 X B.A可代表这种同位素的近似相对原
子质量(质量数)
C.A小于X的元素的相对原子质量
D.A不能代表X元素的相对原子质量 AA-NC小结:2、(1)同一元素的各种同位素虽然质量数
不同,但它们的化学性质几乎完全相同。1、质子数相同而中子数不同的同一元素的不同原子,互称同位素。(2)天然存在的某种元素里,各种同位素
所占的原子个数百分比一般是不变的。
