人教版化学必修一课件:3.1金属的化学性质(共20张PPT)
文档属性
| 名称 | 人教版化学必修一课件:3.1金属的化学性质(共20张PPT) | 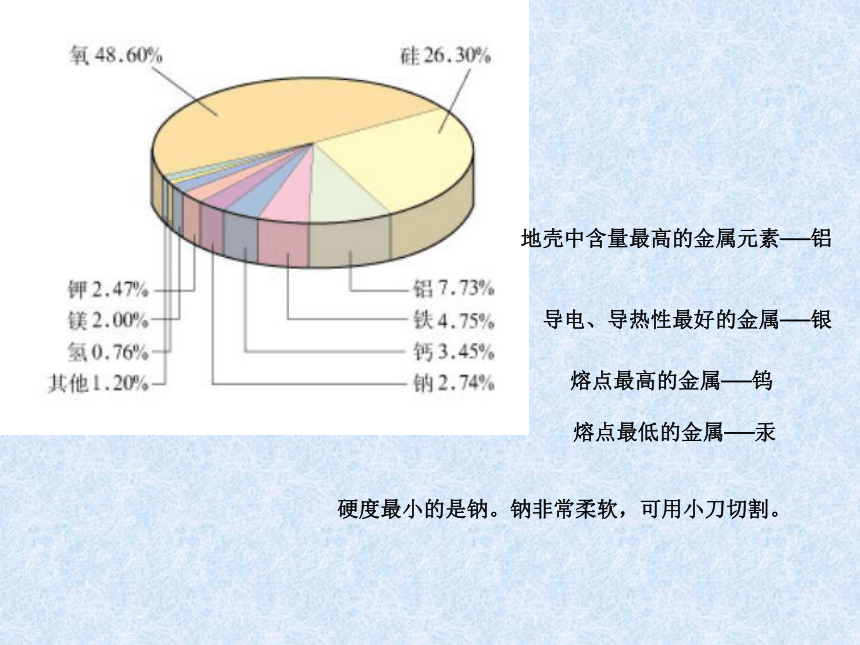 | |
| 格式 | zip | ||
| 文件大小 | 349.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-24 07:09:52 | ||
图片预览






文档简介
课件20张PPT。地壳中含量最高的金属元素──铝 导电、导热性最好的金属──银 熔点最高的金属──钨
?熔点最低的金属──汞硬度最小的是钠。钠非常柔软,可用小刀切割。 ⑴?熔点最低的金属——汞。熔点-39.3℃,常温呈液态,可填充在温度计中。 ?⑵?熔点最高的金属——钨。熔点3410℃,常用作灯丝。 ?⑶?地壳中含量最多的金属元素——铝。日常生活中,用于保护钢铁制品所使用的
“银粉”实际上是金属铝的粉末。 ?⑷?导电性最强的金属——银。家用热水瓶内壁上的金属是银。 ?⑸?制造新型高速飞机最重要的金属——钛。被科学家称为“二十一世纪的金属”或“
未来的钢铁”。 ?⑹?海水中储量最大的放射性元素——铀。 ?⑺?展性最强的金属——金。最薄的金厚度只有1/10000mm。 ?⑻?延性最好的金属——铂。最细的铂丝直径只有1/5000mm。常说的“白金”首饰是
用铂加工而成的。 第一节 金属的化学性质有金属光泽 导电 导热性
良好的 延展性和机械加工性.易失电子,具有还原性.金 属 的 通 性物理:化学:一、钠的原子结构1.原子结构示意图一 、金属与氧气的反应1.钠的物理性质具有金属光泽的银白色金属;
质软;
密度比水小,比煤油大;
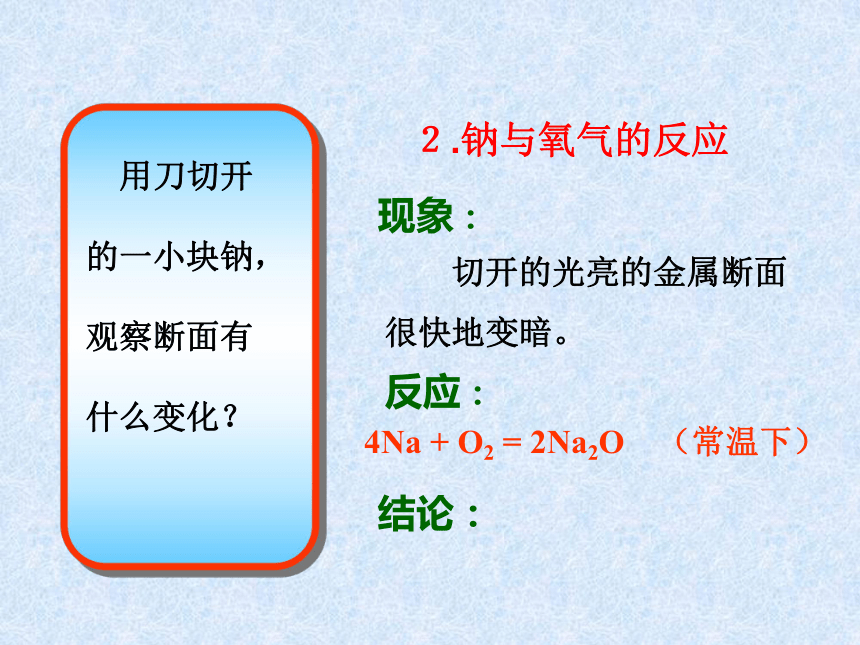
是电和热的良导体.现象: 切开的光亮的金属断面
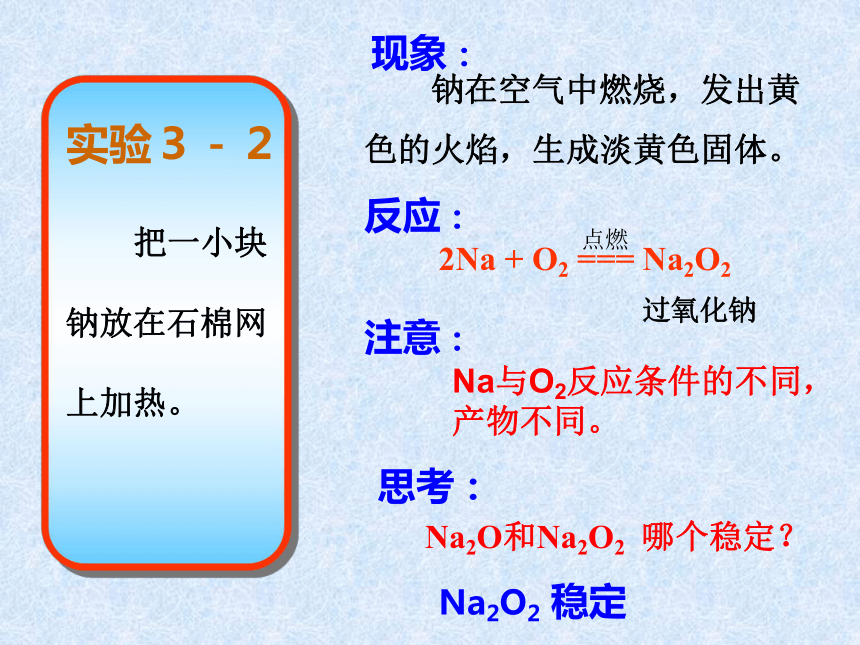
很快地变暗。反应:4Na + O2 = 2Na2O (常温下) 结论:2.钠与氧气的反应现象: 钠在空气中燃烧,发出黄
色的火焰,生成淡黄色固体。反应:2Na + O2 === Na2O2 思考:Na2O2 稳定Na2O和Na2O2 哪个稳定?过氧化钠 点燃注意:Na与O2反应条件的不同,产物不同。3.铝与氧气的反应4Al+3O2=2Al2O3Al在纯氧中也能燃烧小结:
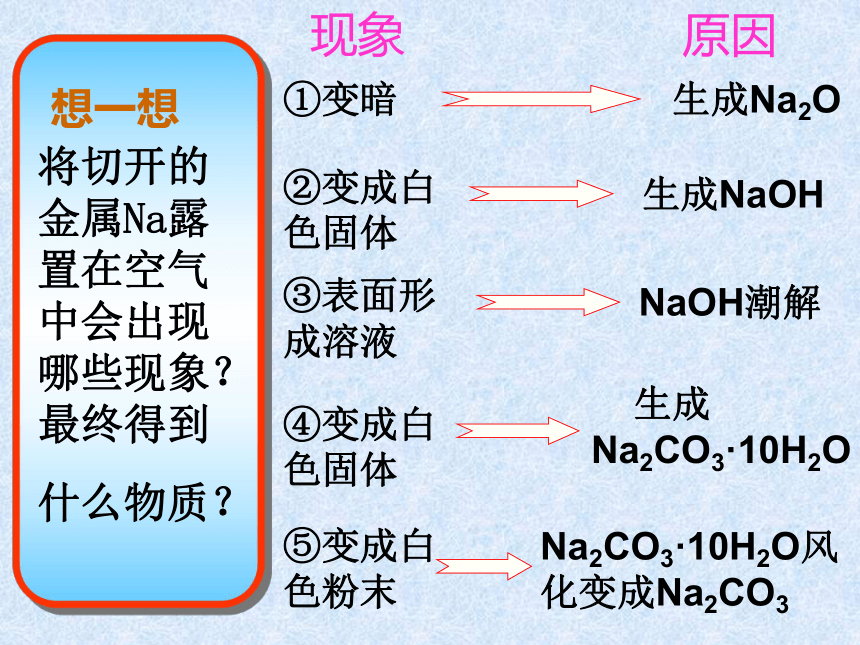
绝大部分金属都能与氧气反应,反应中金属作还原剂,金属越活泼越易发生反应,Al虽较活泼,但表面有致密的氧化膜保护了内部金属不被进一步氧化.①变暗生成Na2O生成NaOH③表面形成溶液NaOH潮解④变成白 色固体 生成Na2CO3·10H2O⑤变成白色粉末Na2CO3·10H2O风化变成Na2CO3②变成白色固体现象原因钠的保存 保存在煤油或石蜡油里 易与空气中的氧气、水 、CO2 等反应钠着火的处理:性质:用砂子扑灭第二课时现象:反应:2Na + 2H2O = 2NaOH + H2 (密度比水小) (反应放热,钠 熔点低)(剧烈反应,有气体生成)(产物溶液呈碱性)解释:(钠与水完全反应)二 金属与水的反应 1.钠与水的反应3. 钠与盐溶液的反应
1.钠投入NaCl溶液中有气体产生;
2Na+2H2O==2NaOH+H2
2.钠投入CuSO4溶液中有气体产生并且有沉淀。 2Na+2H2O==2NaOH+H2
CuSO4+2NaOH==Na2SO4 +Cu(OH)2Na+2H2O+CuSO4==Na2SO4+Cu(OH)2 +H2总反应*钠与盐溶液反应时,会置换出金属吗?先与水反应,
不能置换盐中的金属。
铁与水的反应 请用三支试管、水槽、蒸发皿、胶塞、导管、酒精喷灯及其他必要的仪器和物品,设计一个还原铁粉与水蒸气反应的实验装置,画出装置简图。
应考虑:①水蒸气的发生 ②水蒸气与铁粉的反应 ③气体产物的检验3Fe+4H2O(g) Fe3O4+4H2↑反应方程式金属与某些化合物的溶液反应铝丝上有红色物质生成,溶液颜色逐渐变淡2Al+3CuSO4==3Cu+Al2(SO4)3铜丝上有银白色物质生成,溶液由无色逐渐变为淡蓝色Cu+2AgNO3==2Ag+Cu(NO3)2没有明显变化Fe+Cu2+=Cu+Fe2+四、金属间的置换反应Cu+2Ag+=Cu2++2AgCu+AlCl3 不反应 金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来。结论:① 金属与水反应的难易。 与水反应越容易,反应越剧烈,金属越活泼。比较金属活动性强弱的实验方法②金属与酸反应的难易。 与酸反应产生H2越容易,反应越剧烈,金属越活泼。③金属之间的置换反应。铝的特殊性:既能跟酸反应产生H2,又能跟强碱溶液反应产生H2。五、铝与氢氧化钠溶液的反应现象:Al片放入盐酸、NaOH溶液中都有气泡产生,点燃气体观察到蓝色火焰。化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 铝和氧化铝能跟酸、碱反应,因而铝的保护膜和铝制品会直接被酸、碱、盐侵蚀,所以,铝制餐具不宜用来蒸煮或长期存放酸性、碱性或咸的食物。6e-AlH2O
?熔点最低的金属──汞硬度最小的是钠。钠非常柔软,可用小刀切割。 ⑴?熔点最低的金属——汞。熔点-39.3℃,常温呈液态,可填充在温度计中。 ?⑵?熔点最高的金属——钨。熔点3410℃,常用作灯丝。 ?⑶?地壳中含量最多的金属元素——铝。日常生活中,用于保护钢铁制品所使用的
“银粉”实际上是金属铝的粉末。 ?⑷?导电性最强的金属——银。家用热水瓶内壁上的金属是银。 ?⑸?制造新型高速飞机最重要的金属——钛。被科学家称为“二十一世纪的金属”或“
未来的钢铁”。 ?⑹?海水中储量最大的放射性元素——铀。 ?⑺?展性最强的金属——金。最薄的金厚度只有1/10000mm。 ?⑻?延性最好的金属——铂。最细的铂丝直径只有1/5000mm。常说的“白金”首饰是
用铂加工而成的。 第一节 金属的化学性质有金属光泽 导电 导热性
良好的 延展性和机械加工性.易失电子,具有还原性.金 属 的 通 性物理:化学:一、钠的原子结构1.原子结构示意图一 、金属与氧气的反应1.钠的物理性质具有金属光泽的银白色金属;
质软;
密度比水小,比煤油大;
是电和热的良导体.现象: 切开的光亮的金属断面
很快地变暗。反应:4Na + O2 = 2Na2O (常温下) 结论:2.钠与氧气的反应现象: 钠在空气中燃烧,发出黄
色的火焰,生成淡黄色固体。反应:2Na + O2 === Na2O2 思考:Na2O2 稳定Na2O和Na2O2 哪个稳定?过氧化钠 点燃注意:Na与O2反应条件的不同,产物不同。3.铝与氧气的反应4Al+3O2=2Al2O3Al在纯氧中也能燃烧小结:
绝大部分金属都能与氧气反应,反应中金属作还原剂,金属越活泼越易发生反应,Al虽较活泼,但表面有致密的氧化膜保护了内部金属不被进一步氧化.①变暗生成Na2O生成NaOH③表面形成溶液NaOH潮解④变成白 色固体 生成Na2CO3·10H2O⑤变成白色粉末Na2CO3·10H2O风化变成Na2CO3②变成白色固体现象原因钠的保存 保存在煤油或石蜡油里 易与空气中的氧气、水 、CO2 等反应钠着火的处理:性质:用砂子扑灭第二课时现象:反应:2Na + 2H2O = 2NaOH + H2 (密度比水小) (反应放热,钠 熔点低)(剧烈反应,有气体生成)(产物溶液呈碱性)解释:(钠与水完全反应)二 金属与水的反应 1.钠与水的反应3. 钠与盐溶液的反应
1.钠投入NaCl溶液中有气体产生;
2Na+2H2O==2NaOH+H2
2.钠投入CuSO4溶液中有气体产生并且有沉淀。 2Na+2H2O==2NaOH+H2
CuSO4+2NaOH==Na2SO4 +Cu(OH)2Na+2H2O+CuSO4==Na2SO4+Cu(OH)2 +H2总反应*钠与盐溶液反应时,会置换出金属吗?先与水反应,
不能置换盐中的金属。
铁与水的反应 请用三支试管、水槽、蒸发皿、胶塞、导管、酒精喷灯及其他必要的仪器和物品,设计一个还原铁粉与水蒸气反应的实验装置,画出装置简图。
应考虑:①水蒸气的发生 ②水蒸气与铁粉的反应 ③气体产物的检验3Fe+4H2O(g) Fe3O4+4H2↑反应方程式金属与某些化合物的溶液反应铝丝上有红色物质生成,溶液颜色逐渐变淡2Al+3CuSO4==3Cu+Al2(SO4)3铜丝上有银白色物质生成,溶液由无色逐渐变为淡蓝色Cu+2AgNO3==2Ag+Cu(NO3)2没有明显变化Fe+Cu2+=Cu+Fe2+四、金属间的置换反应Cu+2Ag+=Cu2++2AgCu+AlCl3 不反应 金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来。结论:① 金属与水反应的难易。 与水反应越容易,反应越剧烈,金属越活泼。比较金属活动性强弱的实验方法②金属与酸反应的难易。 与酸反应产生H2越容易,反应越剧烈,金属越活泼。③金属之间的置换反应。铝的特殊性:既能跟酸反应产生H2,又能跟强碱溶液反应产生H2。五、铝与氢氧化钠溶液的反应现象:Al片放入盐酸、NaOH溶液中都有气泡产生,点燃气体观察到蓝色火焰。化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 铝和氧化铝能跟酸、碱反应,因而铝的保护膜和铝制品会直接被酸、碱、盐侵蚀,所以,铝制餐具不宜用来蒸煮或长期存放酸性、碱性或咸的食物。6e-AlH2O
