人教版化学必修一课件:4.1无机非金属材料的主角--碳、硅(共36张PPT) (1)
文档属性
| 名称 | 人教版化学必修一课件:4.1无机非金属材料的主角--碳、硅(共36张PPT) (1) |

|
|
| 格式 | zip | ||
| 文件大小 | 886.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-24 00:00:00 | ||
图片预览



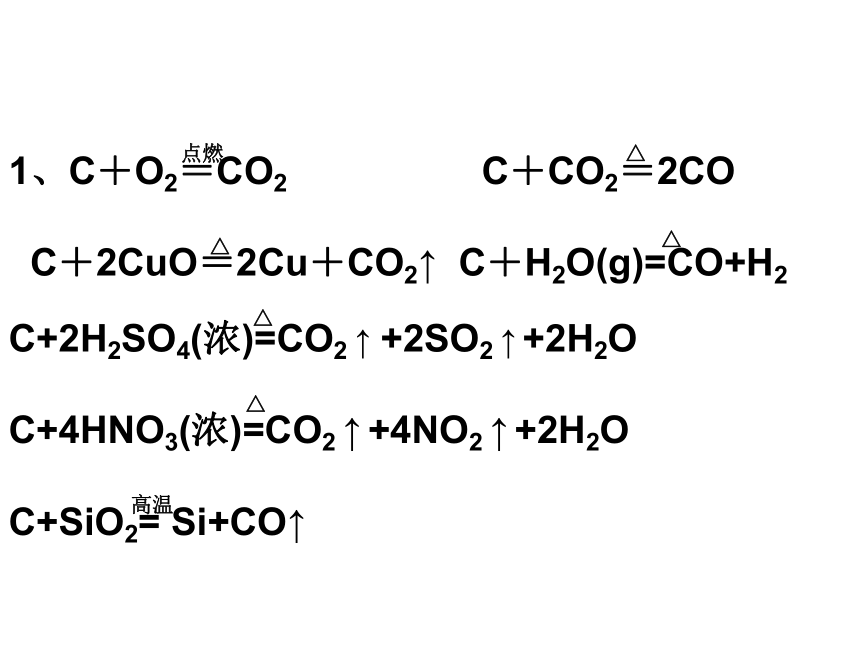
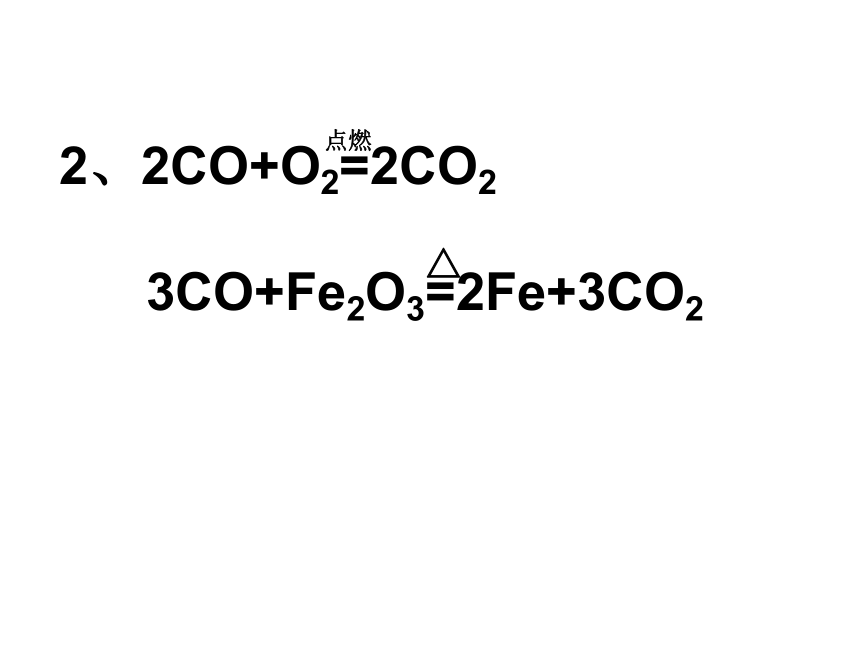
文档简介
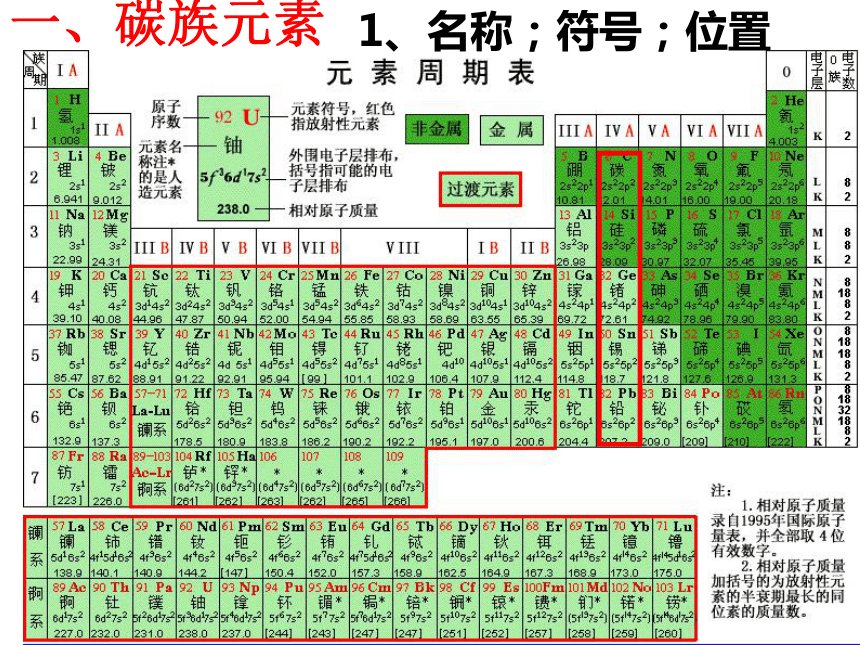
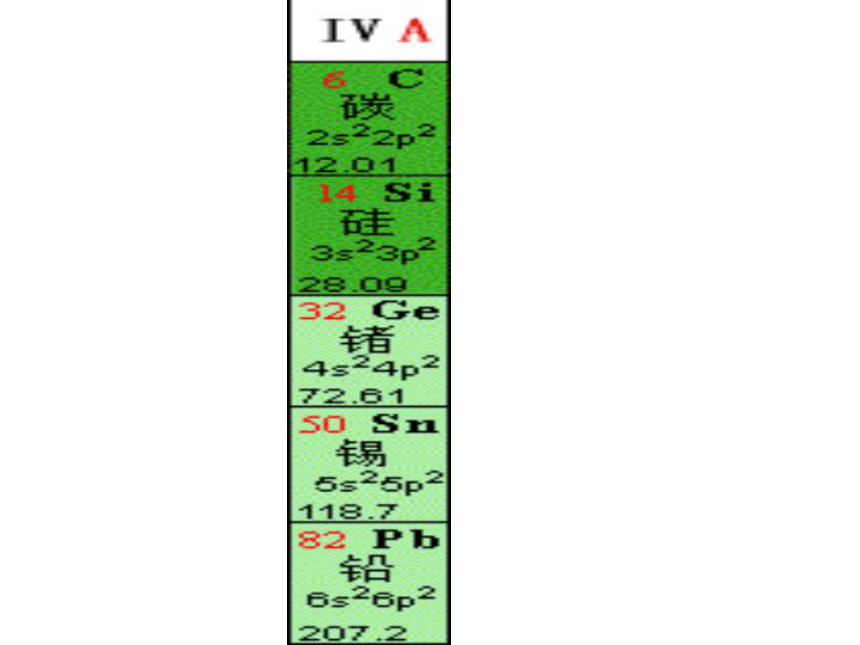
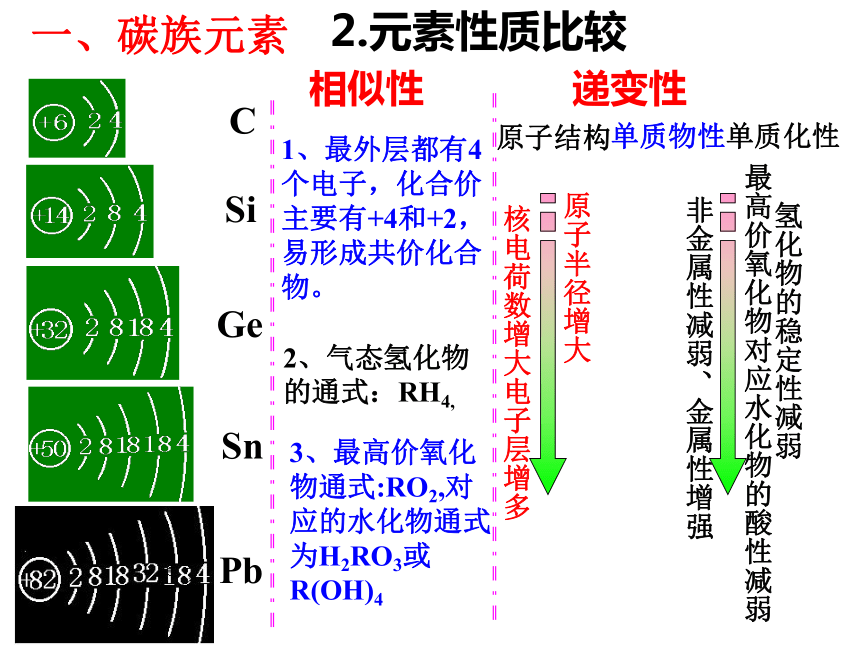
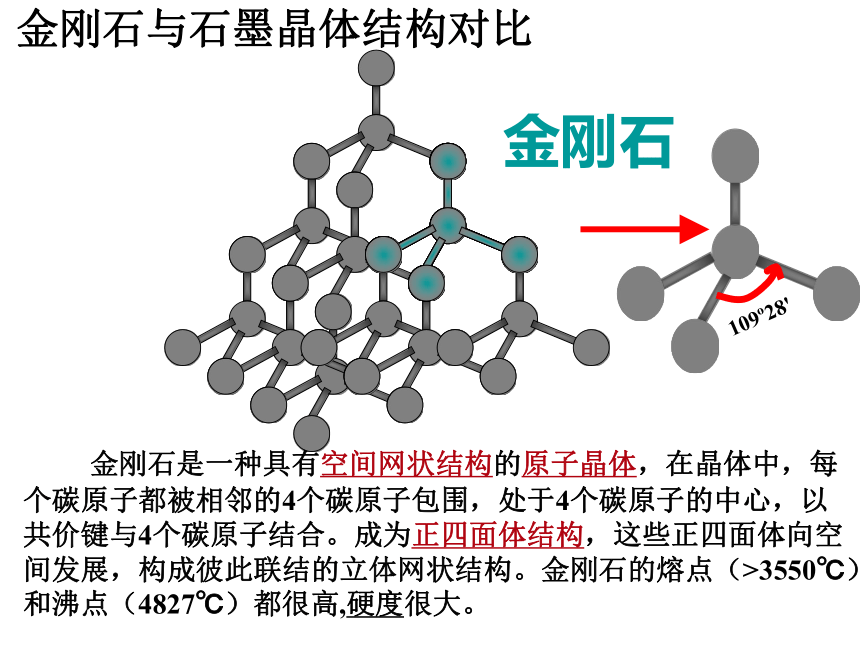
课件36张PPT。无机非金属材料的主角--碳、硅一、碳族元素1、名称;符号;位置 一、碳族元素2.元素性质比较C SiGe Sn Pb相似性 递变性1、最外层都有4个电子,化合价主要有+4和+2,易形成共价化合物。2、气态氢化物的通式:RH4,3、最高价氧化物通式:RO2,对应的水化物通式为H2RO3或R(OH)4原子结构单质物性单质化性核电荷数增大电子层增多原子半径增大非金属性减弱、金属性增强最高价氧化物对应水化物的酸性减弱氢化物的稳定性减弱金刚石
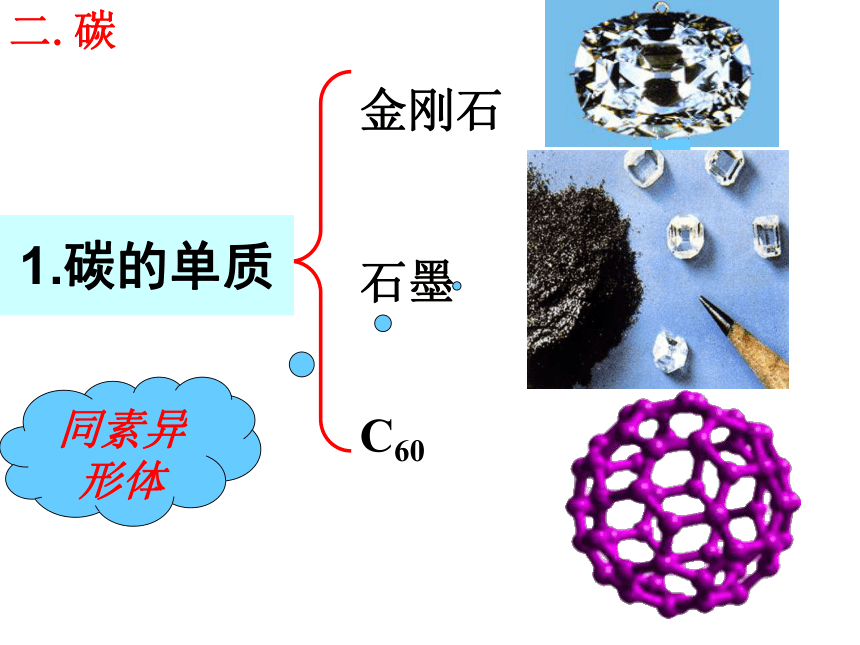
石墨
C60同素异形体二.碳1.碳的单质109o28' 金刚石是一种具有空间网状结构的原子晶体,在晶体中,每
个碳原子都被相邻的4个碳原子包围,处于4个碳原子的中心,以
共价键与4个碳原子结合。成为正四面体结构,这些正四面体向空
间发展,构成彼此联结的立体网状结构。金刚石的熔点(>3550℃)
和沸点(4827℃)都很高,硬度很大。
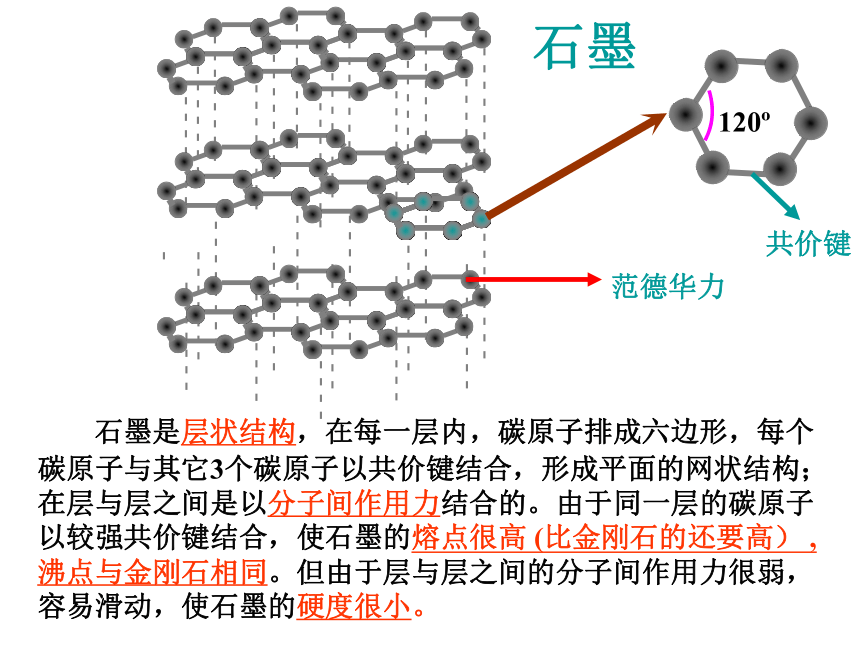
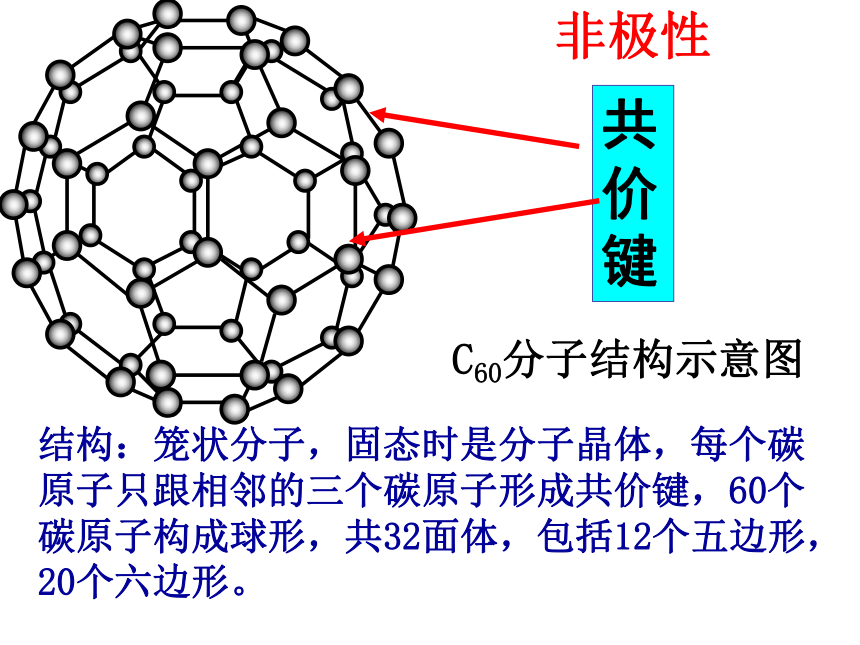
金刚石金刚石与石墨晶体结构对比120o共价键范德华力 石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它3个碳原子以共价键结合,形成平面的网状结构;在层与层之间是以分子间作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高 (比金刚石的还要高) ,沸点与金刚石相同。但由于层与层之间的分子间作用力很弱,容易滑动,使石墨的硬度很小。石墨C60C60分子结构示意图共价键非极性结构:笼状分子,固态时是分子晶体,每个碳原子只跟相邻的三个碳原子形成共价键,60个碳原子构成球形,共32面体,包括12个五边形,20个六边形。碳及其化合物的化学性质记忆大搜索:
写出有1、C 2、CO 3、CO2
参与的化学方程式1、C+O2=CO2 C+CO2=2CO
C+2CuO=2Cu+CO2↑ C+H2O(g)=CO+H2
C+2H2SO4(浓)=CO2 ↑ +2SO2 ↑ +2H2O
C+4HNO3(浓)=CO2 ↑ +4NO2 ↑ +2H2O
C+SiO2= Si+CO↑点燃△△△△△高温2、2CO+O2=2CO2
3CO+Fe2O3=2Fe+3CO2
点燃△
CO2+H2O=H2CO3
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Na2O=Na2CO3
CO2+C=2CO
CO2+2Mg=C+2MgO
{酸性氧化物的通性3、△点燃{氧化性CO2电子式CO2的实验室制法CaCO3+2HCl=CaCl2+CO2↑+ H2O原理:装置:除杂: 块状固体与液体的混合物在常温下反应制备气体可用启普发生器制备,当制取气体的量不多时,也可采用简易装置。用饱和NaHCO3溶液除HCl,用浓硫酸等干燥.验满:用燃着的木条,熄灭.或用湿润的蓝色石蕊试纸,使之变红.检验:使澄清石灰水变浑浊三、硅1、硅的存在和分布:存在: 分布:没有游离态,只有化合态自然界中分布广泛,在地壳中居第二位,仅次于氧。是构成矿物和岩石的基本元素。2、硅的结构:硅的原子结构示意图:第三周期第IVA族 硅单质有晶体和无定形两种,晶体硅的结构跟金刚石相似,都是具有正四面体结构的立体网状结构的晶体。Si109o28' 晶体硅的晶体结构与金刚石相似,也是
由一个硅原子与4个硅原子结合形成
正四面体,许多这样的正四面体向
周围空间延伸形成空间网状
的结构。但由于硅原子半
径比碳原子半径大,所以,
其熔沸点要比金刚石低,
硬度要比金刚石小。2、晶体结构 硅有晶体硅和无定形硅两种同素异形体,
晶体硅的结构类似于金刚石。属于原子晶体。 晶体硅是灰黑色、有金属光泽、硬而脆、熔沸点高的固体。单质硅是良好的半导体材料。3、硅的物理性质:4、硅的化学性质 不活泼,除常温下与 反应外,
加热时也可与 反应。F2、HF 、强碱O2、Cl2、 H2练习1:请写出硅分别与氧气、氢气、氢氧化钠溶液、氢氟酸反应的方程式。(1) 2C+ SiO2 Si(粗) +2CO↑ (2) Si(粗)+2 Cl2 SiCl4(3) SiCl4+2H2 Si + 4HCl 5、硅的工业制法6、硅的用途(1)制集成电路、晶体管、硅整流器等半导体材料;
(2)含硅4%的钢可制变压器铁芯;
(3)含硅15%的钢具有耐酸性,制耐酸设备;
(4)制造“光电池”将太阳能转换为电能。硅的用途集成电路、晶体管、硅整流器等半导体材料,还可以制成太阳能电池、硅的合金可用来制造变压器铁芯等。集成电路 晶体管硅橡胶硅太阳能电池电脑的中央处理器(CPU)含硅物质的用途----电子产品四、二氧化硅1、物理性质 SiO2也叫硅石,石英砂、玻璃、沙子的主要
成分也为SiO2, SiO2为坚硬的固体,纯SiO2是
无色透明晶体,称之为水晶,熔点高,硬度大,
不溶于水(为原子晶体)。2、组成与结构 在SiO2的晶体中,每个硅原子
与___个氧原子结合,每个氧原子
与_____个硅原子结合,即SiO2晶
体是由Si和O按_______的比例所
组成的_________________结构
的晶体。1mol SiO2晶体中含有
____molSi—O键。421:2立体空间网状4(1)酸性氧化物的通性:①与碱性氧化物反应:
②与强碱反应:
③与盐反应:
④不与水反应 :3、化学性质:(3)特性:与氢氟酸反应(2)弱氧化性SiO2+4HF=SiF4↑+2H2O 思考: 实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗? 防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3,使瓶塞和瓶口粘在一起二氧化硅与CO2的化学性质比较:状态固体气体晶体类型原子晶体分子晶体熔沸点高低二氧化硅与CO2的化学性质比较:CO2+2OH- = CO32- +2H2OCO2+OH- = HCO3- CO2+CaO = CaCO3 CO2+H2O+Na2SiO3
== Na2CO3 + H2SiO3↓SiO2+4HF == SiF4↑+2H2OSiO2+2OH- == SiO32- +H2O不反应(故不能直接与水反应制硅酸)光导纤维、化学仪器、
光学仪器、钟表、
电子部件二氧化硅与CO2的化学性质比较:1、关于硅的化学性质的叙述中,正确的是 ( )
A.常温时不和任何酸反应
B.常温时硅与卤素单质均不反应
C.单质硅比金刚石熔点低
D.单质硅比碳的非金属性强C2、玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的物质是( )
A.烧碱 B.纯碱 C.氢氟酸 D.盐酸C二氧化硅的及用途制光导纤维水 晶 制 品通信用光缆1、硅酸(1)制取:可溶性的硅酸盐与酸的反应Na2SiO3+2HCl=2NaCl+H2SiO3↓白色胶状① 白色胶状,难溶 脱水形成“硅胶”② 弱酸性(酸性 H2SiO3 < H2CO3)Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(用作干燥剂)三、硅酸和硅酸盐2、硅酸盐 硅酸钠俗称泡花碱,其水溶液又叫水玻璃。可用作肥皂填料、木材防腐剂、防火剂及黏胶剂。(1)可溶性硅酸盐(2)硅酸盐表示方法 硅酸盐的种类很多,结构也很复杂,通常可用二氧化硅和金属氧化物的形式来表示其组成。
表示方法:金属元素氧化物写在前面,再写SiO2,最后写H2O;氧化物之间用“·”隔开。硅酸钠Na2SiO3—
高岭土Al2(Si2O5)(OH)4—
正长石KAlSi3O8—硅酸盐工业石灰石、黏土纯碱、石灰石、
石英黏土复杂的物理
化学变化3CaO·SiO2
2CaO· SiO2
3CaO·Al2O3Na2SiO3
CaSiO3
SiO2水硬性
(加石膏调节
硬化速度)玻璃态物质
(在一定温度
范围内软化)
非晶体 抗氧化、抗酸碱
腐蚀、耐高温、
绝缘、易成型、
艺术珍品新型无机非金属材料的种类和用途练习: 下列表述正确的是
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤ D
石墨
C60同素异形体二.碳1.碳的单质109o28' 金刚石是一种具有空间网状结构的原子晶体,在晶体中,每
个碳原子都被相邻的4个碳原子包围,处于4个碳原子的中心,以
共价键与4个碳原子结合。成为正四面体结构,这些正四面体向空
间发展,构成彼此联结的立体网状结构。金刚石的熔点(>3550℃)
和沸点(4827℃)都很高,硬度很大。
金刚石金刚石与石墨晶体结构对比120o共价键范德华力 石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它3个碳原子以共价键结合,形成平面的网状结构;在层与层之间是以分子间作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高 (比金刚石的还要高) ,沸点与金刚石相同。但由于层与层之间的分子间作用力很弱,容易滑动,使石墨的硬度很小。石墨C60C60分子结构示意图共价键非极性结构:笼状分子,固态时是分子晶体,每个碳原子只跟相邻的三个碳原子形成共价键,60个碳原子构成球形,共32面体,包括12个五边形,20个六边形。碳及其化合物的化学性质记忆大搜索:
写出有1、C 2、CO 3、CO2
参与的化学方程式1、C+O2=CO2 C+CO2=2CO
C+2CuO=2Cu+CO2↑ C+H2O(g)=CO+H2
C+2H2SO4(浓)=CO2 ↑ +2SO2 ↑ +2H2O
C+4HNO3(浓)=CO2 ↑ +4NO2 ↑ +2H2O
C+SiO2= Si+CO↑点燃△△△△△高温2、2CO+O2=2CO2
3CO+Fe2O3=2Fe+3CO2
点燃△
CO2+H2O=H2CO3
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Na2O=Na2CO3
CO2+C=2CO
CO2+2Mg=C+2MgO
{酸性氧化物的通性3、△点燃{氧化性CO2电子式CO2的实验室制法CaCO3+2HCl=CaCl2+CO2↑+ H2O原理:装置:除杂: 块状固体与液体的混合物在常温下反应制备气体可用启普发生器制备,当制取气体的量不多时,也可采用简易装置。用饱和NaHCO3溶液除HCl,用浓硫酸等干燥.验满:用燃着的木条,熄灭.或用湿润的蓝色石蕊试纸,使之变红.检验:使澄清石灰水变浑浊三、硅1、硅的存在和分布:存在: 分布:没有游离态,只有化合态自然界中分布广泛,在地壳中居第二位,仅次于氧。是构成矿物和岩石的基本元素。2、硅的结构:硅的原子结构示意图:第三周期第IVA族 硅单质有晶体和无定形两种,晶体硅的结构跟金刚石相似,都是具有正四面体结构的立体网状结构的晶体。Si109o28' 晶体硅的晶体结构与金刚石相似,也是
由一个硅原子与4个硅原子结合形成
正四面体,许多这样的正四面体向
周围空间延伸形成空间网状
的结构。但由于硅原子半
径比碳原子半径大,所以,
其熔沸点要比金刚石低,
硬度要比金刚石小。2、晶体结构 硅有晶体硅和无定形硅两种同素异形体,
晶体硅的结构类似于金刚石。属于原子晶体。 晶体硅是灰黑色、有金属光泽、硬而脆、熔沸点高的固体。单质硅是良好的半导体材料。3、硅的物理性质:4、硅的化学性质 不活泼,除常温下与 反应外,
加热时也可与 反应。F2、HF 、强碱O2、Cl2、 H2练习1:请写出硅分别与氧气、氢气、氢氧化钠溶液、氢氟酸反应的方程式。(1) 2C+ SiO2 Si(粗) +2CO↑ (2) Si(粗)+2 Cl2 SiCl4(3) SiCl4+2H2 Si + 4HCl 5、硅的工业制法6、硅的用途(1)制集成电路、晶体管、硅整流器等半导体材料;
(2)含硅4%的钢可制变压器铁芯;
(3)含硅15%的钢具有耐酸性,制耐酸设备;
(4)制造“光电池”将太阳能转换为电能。硅的用途集成电路、晶体管、硅整流器等半导体材料,还可以制成太阳能电池、硅的合金可用来制造变压器铁芯等。集成电路 晶体管硅橡胶硅太阳能电池电脑的中央处理器(CPU)含硅物质的用途----电子产品四、二氧化硅1、物理性质 SiO2也叫硅石,石英砂、玻璃、沙子的主要
成分也为SiO2, SiO2为坚硬的固体,纯SiO2是
无色透明晶体,称之为水晶,熔点高,硬度大,
不溶于水(为原子晶体)。2、组成与结构 在SiO2的晶体中,每个硅原子
与___个氧原子结合,每个氧原子
与_____个硅原子结合,即SiO2晶
体是由Si和O按_______的比例所
组成的_________________结构
的晶体。1mol SiO2晶体中含有
____molSi—O键。421:2立体空间网状4(1)酸性氧化物的通性:①与碱性氧化物反应:
②与强碱反应:
③与盐反应:
④不与水反应 :3、化学性质:(3)特性:与氢氟酸反应(2)弱氧化性SiO2+4HF=SiF4↑+2H2O 思考: 实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗? 防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3,使瓶塞和瓶口粘在一起二氧化硅与CO2的化学性质比较:状态固体气体晶体类型原子晶体分子晶体熔沸点高低二氧化硅与CO2的化学性质比较:CO2+2OH- = CO32- +2H2OCO2+OH- = HCO3- CO2+CaO = CaCO3 CO2+H2O+Na2SiO3
== Na2CO3 + H2SiO3↓SiO2+4HF == SiF4↑+2H2OSiO2+2OH- == SiO32- +H2O不反应(故不能直接与水反应制硅酸)光导纤维、化学仪器、
光学仪器、钟表、
电子部件二氧化硅与CO2的化学性质比较:1、关于硅的化学性质的叙述中,正确的是 ( )
A.常温时不和任何酸反应
B.常温时硅与卤素单质均不反应
C.单质硅比金刚石熔点低
D.单质硅比碳的非金属性强C2、玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的物质是( )
A.烧碱 B.纯碱 C.氢氟酸 D.盐酸C二氧化硅的及用途制光导纤维水 晶 制 品通信用光缆1、硅酸(1)制取:可溶性的硅酸盐与酸的反应Na2SiO3+2HCl=2NaCl+H2SiO3↓白色胶状① 白色胶状,难溶 脱水形成“硅胶”② 弱酸性(酸性 H2SiO3 < H2CO3)Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(用作干燥剂)三、硅酸和硅酸盐2、硅酸盐 硅酸钠俗称泡花碱,其水溶液又叫水玻璃。可用作肥皂填料、木材防腐剂、防火剂及黏胶剂。(1)可溶性硅酸盐(2)硅酸盐表示方法 硅酸盐的种类很多,结构也很复杂,通常可用二氧化硅和金属氧化物的形式来表示其组成。
表示方法:金属元素氧化物写在前面,再写SiO2,最后写H2O;氧化物之间用“·”隔开。硅酸钠Na2SiO3—
高岭土Al2(Si2O5)(OH)4—
正长石KAlSi3O8—硅酸盐工业石灰石、黏土纯碱、石灰石、
石英黏土复杂的物理
化学变化3CaO·SiO2
2CaO· SiO2
3CaO·Al2O3Na2SiO3
CaSiO3
SiO2水硬性
(加石膏调节
硬化速度)玻璃态物质
(在一定温度
范围内软化)
非晶体 抗氧化、抗酸碱
腐蚀、耐高温、
绝缘、易成型、
艺术珍品新型无机非金属材料的种类和用途练习: 下列表述正确的是
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤ D
