2015-2016学年山东省德州市跃华学校高一(下)月考化学试卷【解析版】(3月份)
文档属性
| 名称 | 2015-2016学年山东省德州市跃华学校高一(下)月考化学试卷【解析版】(3月份) |

|
|
| 格式 | zip | ||
| 文件大小 | 252.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-25 00:00:00 | ||
图片预览




文档简介
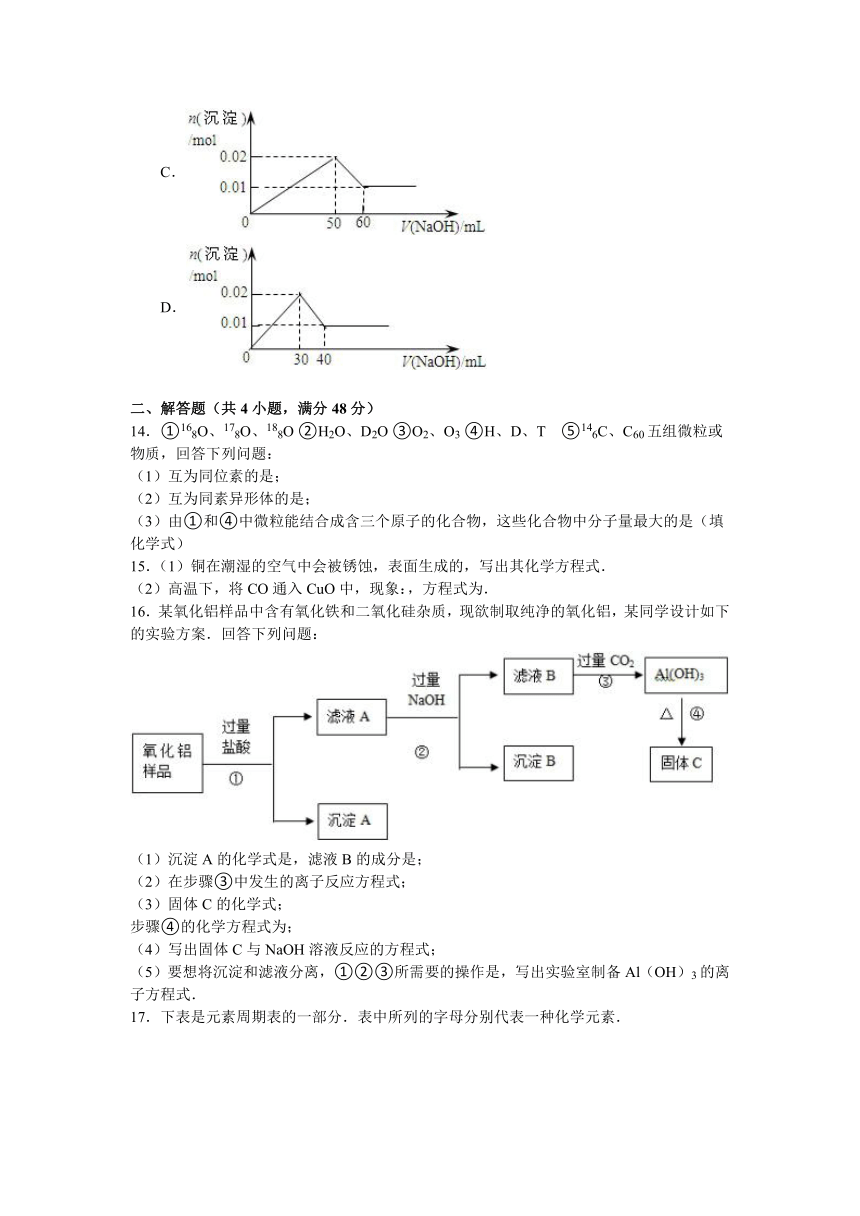
2015-2016学年山东省德州市跃华学校高一(下)月考化学试卷(3月份)
一、选择题(单选题每题3分,共52分).
1.生产、生活中离不开化学知识.下列说法正确的是(
)
A.汽车尾气、工业废气的排放是形成“雾霾”的主要原因
B.用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应
C.不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬
D.“辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料
2.下列有关铜元素的说法中,正确的是(
)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应,生成黑色的Cu2O
D.CuSO4 5H2O是一种混合物,加热后变为白色粉末
3.在强酸性溶液中,可以大量共存的离子组是(
)
A.Na+、K+、AlO2﹣、Cl﹣
B.Ba2+、Na+、CO32﹣、NO3﹣
C.Na+、Ag+、SO42﹣、Cl﹣
D.Al3+、Fe3+、NO3﹣、SO42﹣
4.我国科学家首次合成了三种新核素,其中一种的名称是铪﹣185
(18572Hf).关于铪﹣185的说法正确的是(
)
A.铪﹣185的原子核内有72个电子
B.其中子数比电子数多41
C.是铪﹣180的一种新的同素异形体
D.铪﹣185的原子核内有185个质子
5.下面是某同学所画的各原子的原子结构示意图,你认为正确的是(
)
A.
B.
C.
D.
6.已知R2+核外有a个电子,b个中子,表示R原子符号正确的是(
)
A.R
B.R
C.R
D.R
7.下列说法中,正确的是(
)
A.在元素周期表里,主族元素所在的族序数等于原子核外电子数
B.在元素周期表里,元素所在的周期序数等于原子核外电子层数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
8.两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为(
)
A.1:1
B.1:2
C.1:3
D.1:4
9.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是(
)
X
Y
Z
W
A.原子半径:Z>X>Y
B.Y的最高正价与最低负价的和是4
C.W的单质是工业制取盐酸的原料之一
D.X、W的氢化物相遇会产生白烟
10.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B元素
(
)
A.一定是第2周期元素
B.一定是同一主族元素
C.可能是第2、3周期元素
D.可以相互化合形成化合物
11.科学家根据元素周期律和原子结构理论预测出原子序数为114的元素的存在,下面关于它的原子结构和性质预测不正确的是(
)
A.该元素原子的最外层电子数为4
B.其常见价态为+2、+4
C.它的金属性比铅强
D.它的原子半径比第115号元素的原子半径小
12.An+、Bn﹣、C
3种短周期元素的粒子具有相同的电子层结构,则关于它们的叙述正确的是(
)
A.原子序数:C>B>A
B.离子半径:Bn﹣<An+
C.C是稀有气体元素的原子
D.原子半径:A<B
13.某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,下列关系图正确的是(
)
A.
B.
C.
D.
二、解答题(共4小题,满分48分)
14.①168O、178O、188O
②H2O、D2O
③O2、O3
④H、D、T
⑤146C、C60五组微粒或物质,回答下列问题:
(1)互为同位素的是;
(2)互为同素异形体的是;
(3)由①和④中微粒能结合成含三个原子的化合物,这些化合物中分子量最大的是(填化学式)
15.(1)铜在潮湿的空气中会被锈蚀,表面生成的,写出其化学方程式.
(2)高温下,将CO通入CuO中,现象:,方程式为.
16.某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案.回答下列问题:
(1)沉淀A的化学式是,滤液B的成分是;
(2)在步骤③中发生的离子反应方程式;
(3)固体C的化学式;
步骤④的化学方程式为;
(4)写出固体C与NaOH溶液反应的方程式;
(5)要想将沉淀和滤液分离,①②③所需要的操作是,写出实验室制备Al(OH)3的离子方程式.
17.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
请根据要求用元素符号或化学式回答下列问题:
(1)写出d元素和l元素的名称.d:
l:
(2)表中所列元素中,原子最外层有2个电子的元素为.
(3)画出i元素原子的结构示意图,画出k元素的离子结构示意图
(4)l元素的最高正价是,最低负价是.
(5)比较元素e、f、g、h的离子半径.(写出离子符号)
(6)表中p元素是元素(填“金属”或“非金属”),p元素在元素周期表中的位置是.
2015-2016学年山东省德州市跃华学校高一(下)月考化学试卷(3月份)
一、选择题(单选题每题3分,共52分).
1.生产、生活中离不开化学知识.下列说法正确的是(
)
A.汽车尾气、工业废气的排放是形成“雾霾”的主要原因
B.用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应
C.不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬
D.“辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料
【分析】A.从工业废气、汽车尾气中含有大量的烟尘和污染空气的气体去分析解答;
B.常温下能用铝制容器盛放浓硫酸,是因为反应生成了致密的氧化膜阻止进一步反应;
C.在铁中添加金属铬制得不锈钢;
D.特种钢缆为金属材料.
【解答】解:A.工业废气、汽车尾气中含有大量的烟尘和污染空气的气体,故A正确;
B.常温下能用铝制容器盛放浓硫酸,是因为反应生成了致密的氧化膜阻止进一步反应,故B错误;
C.在铁中添加至少10.5%的金属铬即可制得不锈钢,金属铬在表面形成一层氧化物薄膜,有效的保护内层金属,使更耐腐蚀,故C错误;
D.特种钢缆为金属材料,不是非金属材料,故D错误;
故选:A.
【点评】本题考查物质的组成、结构与性质,为高频考点,把握物质的性质、应用及化学与生活的关系为解答的关键,注意钝化属于化学变化,题目难度不大.
2.下列有关铜元素的说法中,正确的是(
)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应,生成黑色的Cu2O
D.CuSO4 5H2O是一种混合物,加热后变为白色粉末
【分析】A.青铜为Cu的合金,不锈钢为Fe的合金,硬铝为Al的合金;
B.铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜;
C.铜与O2反应,生成黑色的CuO;
D.CuSO4 5H2O是纯净物.
【解答】解:A.青铜为Cu的合金,不锈钢为Fe的合金,硬铝为Al的合金,则青铜、不锈钢和硬铝都是合金,故A正确;
B.铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜,不属氧化物,故B错误;
C.铜与O2反应,生成黑色的CuO,Cu2O是红色的,故C错误;
D.CuSO4 5H2O是纯净物,加热后由蓝色晶体变为白色粉末,故D错误.
故选A.
【点评】本题考查金属的性质,为高频考点,把握金属及化合物的性质、发生的反应、性质与用途的关系等为解答的关键,侧重分析与应用能力的考查,题目难度不大.
3.在强酸性溶液中,可以大量共存的离子组是(
)
A.Na+、K+、AlO2﹣、Cl﹣
B.Ba2+、Na+、CO32﹣、NO3﹣
C.Na+、Ag+、SO42﹣、Cl﹣
D.Al3+、Fe3+、NO3﹣、SO42﹣
【分析】强酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能结合生成络离子等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
【解答】解:A.酸性条件下AlO2﹣不能大量共存,故A错误;
B..酸性条件下CO32﹣不能大量共存,故B错误;
C.Ag+、Cl﹣反应生成沉淀而不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选D.
【点评】本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、络合反应的离子共存考查,题目难度不大.
4.我国科学家首次合成了三种新核素,其中一种的名称是铪﹣185
(18572Hf).关于铪﹣185的说法正确的是(
)
A.铪﹣185的原子核内有72个电子
B.其中子数比电子数多41
C.是铪﹣180的一种新的同素异形体
D.铪﹣185的原子核内有185个质子
【分析】根据原子符号的含义、质量数=质子数+中子数,质子数相同、中子数不同的原子互为同位素.
【解答】解:A.原子核是由质子和中子构成的,无电子,故A错误;
B.72185Hf中子数=185﹣72=113,113﹣72=41,故B正确;
C.因两者的质子数都是72,中子数不同,则互为同位素,同素异形体必须是单质,故C错误;
D.72185Hf是的质量数为185,质子数为72,故D错误.
故选B.
【点评】本题主要考查核素、元素、同位素的概念,难度不大,需要掌握原子中的数字的意义及原子中量的关系.
5.下面是某同学所画的各原子的原子结构示意图,你认为正确的是(
)
A.
B.
C.
D.
【分析】根据核外电子排布理论:即能量最低原理、泡利原理、洪特规则判断.
【解答】解:A、违反了泡利原理,每个原子轨道最多容纳两个电子,应表示为:故A错误;
B、违反了能量最低原理,先排布4s轨道后排3d轨道,应表示为:故B错误;
C、违反了能量最低原理,先排满3p后排4s,20号元素为钙,不可能失去6个电子,应表示为:故C错误;
D、均符合核外电子排布规律,故D正确;
故选:D.
【点评】本题考察核外电子排布规律的应用,充分理解能量最低原理、泡利原理和红特规则及其特例是解题关键.
6.已知R2+核外有a个电子,b个中子,表示R原子符号正确的是(
)
A.R
B.R
C.R
D.R
【分析】阳离子中,质子数=核外电子数+电荷数,质量数=质子数+中子数,根据质子数和质量数书写原子符号.
【解答】解:R2+离子核外有a个电子,质子数=核外电子数+电荷数=a+2,质量数=质子数+中子数=a+2+b,所以R原子符号为a+2a+b+2R,
故选C.
【点评】本题考查质子数、中子数和质量数之间的关系,难度不大.要注意原子符号的意义.
7.下列说法中,正确的是(
)
A.在元素周期表里,主族元素所在的族序数等于原子核外电子数
B.在元素周期表里,元素所在的周期序数等于原子核外电子层数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
【分析】A.主族元素所在的族序数等于原子核外最外层电子数;
B.电子层数等于周期序数;
C.最外层电子数为8的粒子可能是离子;
D.电子层数相同,核电荷数越多半径越小.
【解答】解:A.主族元素所在的族序数等于最外层电子数,由原子核外电子数可确定最外层电子数,故A错误;
B.周期表里,元素所在的周期序数等于原子核外电子层数,故B正确;
C.最外层电子数为8的粒子不一定是稀有气体的原子,还可能是离子例如钠离子,故C错误;
D.电子层数相同,核电荷数越多半径越小,故D错误;
故选B.
【点评】本题考查元素周期表的结构与应用,为高频考点,把握原子结构与元素的位置关系、元素周期表的结构等为解答的关键,注重基础知识的考查,题目难度不大.
8.两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为(
)
A.1:1
B.1:2
C.1:3
D.1:4
【分析】铝与盐酸发生反应:2Al+6HCl=2AlCl3+3H2↑,铝与NaOH溶液发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,令铝与盐酸、NaOH溶液反应生成的氢气物质的量分别为1mol、2mol,根据反应的方程式计算参加反应的铝的物质的量,进而计算质量之比.
【解答】解:设铝与盐酸、NaOH溶液反应生成的氢气的物质的量分别为1mol、2mol,则:
则2Al+6HCl=2AlCl3+3H2↑
2
3
mol
1mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2
3
mol
2mol
则第一份与第二份铝屑的质量比为(mol×27g/mol):(mol×27g/mol)=1:2,
故选B.
【点评】本题考查铝的性质、化学方程式的计算,题目难度不大,解答本题的关键是要正确书写反应的有关方程式,也可利用电子守恒来计算解答.
9.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是(
)
X
Y
Z
W
A.原子半径:Z>X>Y
B.Y的最高正价与最低负价的和是4
C.W的单质是工业制取盐酸的原料之一
D.X、W的氢化物相遇会产生白烟
【分析】X原子的最外层电子数比其次外层电子数多3个,X为第二周期的N元素,最外层电子数为5,结合在短周期的位置可知,Y为O,Z为P,W为Cl,然后结合元素周期律及元素化合物知识来解答.
【解答】解:X原子的最外层电子数比其次外层电子数多3个,X为第二周期的N元素,最外层电子数为5,结合在短周期的位置可知,Y为O,Z为P,W为Cl,
A.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径:Z>X>Y,故A正确;
B.Y为O,不存在最高正价,故B错误;
C.氯气与氢气发生反应生成HCl,HCl溶于水得到盐酸,则W的单质是工业制取盐酸的原料之一,故C正确;
D.X、W的氢化物分别为氨气、HCl,二者反应生成氯化铵,相遇会产生白烟,故D正确;
故选B.
【点评】本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、性质、元素化合物为解答的关键,侧重分析与应用能力的考查,注意O不存在正价,题目难度不大.
10.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B元素
(
)
A.一定是第2周期元素
B.一定是同一主族元素
C.可能是第2、3周期元素
D.可以相互化合形成化合物
【分析】A元素的原子最外层电子数是次外层电子数的3倍,应为O元素,B元素的原子次外层电子数是最外层电子数的2倍,核外电子数可为2、1,或2、8、4,可能为Li、Si,以此解答该题.
【解答】解:A元素的原子最外层电子数是次外层电子数的3倍,应为O元素,B元素的原子次外层电子数是最外层电子数的2倍,核外电子数可为2、1,或2、8、4,可能为Li、Si,
A.如B为Si,则为第三周期元素,故A错误;
B.A为O,B可能为Li或Si,则一定不在同一主族,故B错误;
C.A为O,B可能为Li或Si,可能是第二、三周期元素,故C正确;
D.如B为Li,则形成的化合物为B2A,如B为Si,则形成的化合物化学式为BA2,可以相互化合形成化合物,故D正确.
故选CD.
【点评】本题考查原子结构与元素的性质,侧重于学生的分析能力的考查,注意把握原子结构特点,为解答该题的关键,难度不大.
11.科学家根据元素周期律和原子结构理论预测出原子序数为114的元素的存在,下面关于它的原子结构和性质预测不正确的是(
)
A.该元素原子的最外层电子数为4
B.其常见价态为+2、+4
C.它的金属性比铅强
D.它的原子半径比第115号元素的原子半径小
【分析】原子序数为114的元素属于第七周期第ⅣA族,称为类铅元素,利用第ⅣA族元素的性质的相似性和递变性来解答.
【解答】解:A.位于第ⅣA族,族序数等于最外层电子数,则类铅元素原子的最外层电子数为4,故A正确;
B.位于第ⅣA族,常见的价态为+2、+4,故B正确;
C.同主族从上到下金属性在增强,则它的金属性比铅强,故C正确;
D.同周期从左向右原子半径在减小,则它的原子半径比第115号元素的原子半径大,故D错误;
故选D.
【点评】本题考查元素的位置及性质,为高频考点,把握第ⅣA族元素的性质是解答本题的关键,注意元素周期表和周期律的应用,题目难度不大.
12.An+、Bn﹣、C
3种短周期元素的粒子具有相同的电子层结构,则关于它们的叙述正确的是(
)
A.原子序数:C>B>A
B.离子半径:Bn﹣<An+
C.C是稀有气体元素的原子
D.原子半径:A<B
【分析】An+、Bn﹣、C
3种短周期元素的粒子具有相同的电子层结构,可知A位于B、C的下一周期,B、C位于相同周期,C的最外层达到稳定结构,以此解答该题.
【解答】解:A.设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数则为Z﹣n,则原子序数为A>C>B,故A错误;
B.因An+、Bn﹣具有相同的电子层结构,核电荷数越大半径越小,阴离子半径大于阳离子半径,即Bn﹣>An+,故B错误;
C.An+、Bn﹣都应具有稀有气体的电子层结构,C的电子层结构相同于An+、Bn﹣,所以C必为稀有气体元素的原子,故C正确;
D.A处于B、C的下一周期,故A的原子半径应大于B.故D错误.
故选C.
【点评】本题考查原子结构与元素周期律的关系,侧重于学生的分析能力的考查,此类题目首先要根据题给信息,确定各元素在周期表中的相对位置,然后根据元素周期律加以对照.
13.某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,下列关系图正确的是(
)
A.
B.
C.
D.
【分析】AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,再继续滴加NaOH溶液时,氢氧化铝
会完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液.
【解答】解:含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,发生反应Al3++3OH﹣═Al(OH)3↓,得到沉淀0.01mol,消耗氢氧化钠0.03mol,即30mL,Mg2++2OH﹣═Mg(OH)2↓,得到次沉淀0.01mol,消耗氢氧化钠0.02mol,即20mL,随反应进行沉淀量增大,共消耗氢氧化钠50mL,0.01mol氢氧化铝会溶于过量的氢氧化钠中,Al(OH)3↓+OH﹣═[Al(OH)4]﹣,消耗氢氧化钠10mL,故沉淀达最大值后,再加氢氧化钠,沉淀量减小,直到最后剩余的是氢氧化镁沉淀0.01mol.故选C.
【点评】理清反应的整个过程,问题即可解决,即可利用方程式也可根据关系式,本题采取原子守恒计算.
二、解答题(共4小题,满分48分)
14.①168O、178O、188O
②H2O、D2O
③O2、O3
④H、D、T
⑤146C、C60五组微粒或物质,回答下列问题:
(1)互为同位素的是①④;
(2)互为同素异形体的是③;
(3)由①和④中微粒能结合成含三个原子的化合物,这些化合物中分子量最大的是T2188O(填化学式)
【分析】有相同质子数、不同中子数的原子或同一元素的不同核素互为同位素;
相同元素组成、不同形态的单质互为同素异形体.
【解答】解:(1)①168O、178O、188O
质子数相同,中子数不同,互为同位素;④H、D、T质子数相同,中子数不同,互为同位素;
(2)O2、O3是由氧元素形成的不同单质,互为同素异形体;
(3)由①和④中微粒能结合成含三个原子的化合物,其中分子量最大的是T2188O;
故答案为:①④;③;T2188O.
【点评】本题考查同位素、同素异形体的概念,难度不大,对于元素、核素、同位素、同素异形体、同分异构体、同种物质等概念的区别是考试的热点问题.
15.(1)铜在潮湿的空气中会被锈蚀,表面生成绿色的碱式碳酸铜,写出其化学方程式2Cu+O2+H2O+CO2═Cu2(OH)2CO3.
(2)高温下,将CO通入CuO中,现象:黑色粉末变为红色固体,方程式为CuO+COCu+CO2.
【分析】(1)铜在空气中与O2、CO2、H2O反应产生Cu2(OH)2CO3;
(2)高温下CO具有强还原性,CuO被还原成Cu单质.
【解答】解:(1)铜在潮湿的空气中会被锈蚀,生成绿色的碱式碳酸铜,是因为铜在空气中与O2、CO2、H2O反应产生Cu2(OH)2CO3;反应方程式为:2Cu+O2+H2O+CO2═Cu2(OH)2CO3,
故答案为:绿色;碱式碳酸铜;2Cu+O2+H2O+CO2═Cu2(OH)2CO3;
(2)高温下CO具有强还原性,黑色粉末CuO被还原成Cu单质,铜是红色固体,反应方程式为:CuO+COCu+CO2,
故答案为:黑色粉末变为红色固体;CuO+COCu+CO2.
【点评】本题考查铜及其化合物的性质,属于基础知识的考查,注意碱式碳酸铜化学式的书写,题目比较简单.
16.某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案.回答下列问题:
(1)沉淀A的化学式是SiO2,滤液B的成分是NaAlO2、NaCl、NaOH;
(2)在步骤③中发生的离子反应方程式CO2+2H2O+AlO2﹣═HCO3﹣+Al(OH)3↓;
(3)固体C的化学式Al2O3;
步骤④的化学方程式为2Al(OH)33H2O↑+Al2O3;
(4)写出固体C与NaOH溶液反应的方程式Al2O3+2NaOH=2NaAlO2+H2O;
(5)要想将沉淀和滤液分离,①②③所需要的操作是过滤,写出实验室制备Al(OH)3的离子方程式Al3++3NH3 H2O═Al(OH)3↓+3NH4+.
【分析】氧化铝样品中含有氧化铁和二氧化硅,加入过量盐酸氧化铝、氧化铁溶解生成氯化铝、氯化铁溶液,过滤得到沉淀A为二氧化硅,滤液A为氯化铁和氯化铝溶液,加入过量氢氧化钠溶液生成氢氧化铁沉淀和偏铝酸钠溶液,过滤得到沉淀B为Fe(OH)3,滤液为NaAlO2,通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝沉淀,加热分解生成C为氧化铝,以此解答该题.
【解答】解:氧化铝样品中含有氧化铁和二氧化硅,加入过量盐酸氧化铝、氧化铁溶解生成氯化铝、氯化铁溶液,过滤得到沉淀A为二氧化硅,滤液A为氯化铁和氯化铝溶液,加入过量氢氧化钠溶液生成氢氧化铁沉淀和偏铝酸钠溶液,过滤得到沉淀B为Fe(OH)3,滤液为NaAlO2,通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝沉淀,加热分解生成C为氧化铝,
(1)由以上分析可知沉淀A为SiO2,滤液B的成分为NaAlO2、NaCl、NaOH,故答案为:SiO2;NaAlO2、NaCl、NaOH;
(2)步骤③为偏铝酸钠溶液与二氧化碳反应生成氢氧化铝沉淀,其离子反应为CO2+2H2O+AlO2﹣═HCO3﹣+Al(OH)3↓,
故答案为:CO2+2H2O+AlO2﹣═HCO3﹣+Al(OH)3↓;
(3)C为Al2O3,步骤④的化学方程式为2Al(OH)33H2O↑+Al2O3,故答案为:Al2O3;2Al(OH)33H2O↑+Al2O3;
(4)氧化铝为两性氧化物,可与氢氧化钠溶液反应,反应的方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(5)分离液体和不溶性固体,可用过滤的方法,实验室制备Al(OH)3,利用可溶性铝盐和氨水反应,离子反应为Al3++3NH3 H2O═Al(OH)3↓+3NH4+,
故答案为:过滤;Al3++3NH3 H2O═Al(OH)3↓+3NH4+.
【点评】本题考查镁、铝、硅的化合物的性质,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,明确物质的性质及转化中发生的化学反应是解答本题的关键,题目难度不大.
17.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
请根据要求用元素符号或化学式回答下列问题:
(1)写出d元素和l元素的名称.d:氮
l:氯
(2)表中所列元素中,原子最外层有2个电子的元素为He、Mg.
(3)画出i元素原子的结构示意图,画出k元素的离子结构示意图
(4)l元素的最高正价是+7,最低负价是﹣1.
(5)比较元素e、f、g、h的离子半径O2﹣>F﹣>Na+>Mg2+.(写出离子符号)
(6)表中p元素是非金属元素(填“金属”或“非金属”),p元素在元素周期表中的位置是第四周期ⅤA族.
【分析】根据元素周期表中元素的位置和分布可以推知a是H,b是He,c是C,d是N,e是O,f是F,g是Na,h是Mg,i是Al,j是Si,k是S,l是Cl,m是Ar,n是K,o是Ge,p为As元素.
(1)由以上分析可知d为氮元素,l为氯元素;
(2)根据核外电子排布判断;
(3)根据核外电子排布特点书写结构示意图;
(4)l是Cl,最外层有7个电子,最高正价为+7价,最低负价为﹣1价;
(5)e是O,f是F,g是Na,h是Mg,对应离子具有相同的核外电子排布,核电荷数越大离子半径越小;
(6)p为As元素,为非金属元素,位于周期表第四周期ⅤA族.
【解答】解:根据元素周期表中元素的位置和分布可以推知a是H,b是He,c是C,d是N,e是O,f是F,g是Na,h是Mg,i是Al,j是Si,k是S,l是Cl,m是Ar,n是K,o是Ge,p为As元素.
(1)由以上分析可知d为氮元素,l为氯元素,故答案为:氮;氯;
(2)表中所列元素中,原子最外层有2个电子的元素为He、Mg,故答案为:He、Mg;
(3)i是Al,原子核外有3个电子层,最外层电子数为3,原子结构示意图为,k为S元素,离子核外有3个电子层,最外层电子数为8,离子结构示意图为,
故答案为:;;
(4)l是Cl,最外层有7个电子,最高正价为+7价,最低负价为﹣1价,故答案为:+7;﹣1;
(5)e是O,f是F,g是Na,h是Mg,对应离子具有相同的核外电子排布,核电荷数越大离子半径越小,应为O2﹣>F﹣>Na+>Mg2+,
故答案为:O2﹣>F﹣>Na+>Mg2+;
(6)p为As元素,为非金属元素,位于周期表第四周期ⅤA族,故答案为:非金属;第四周期ⅤA族.
【点评】本题考查了周期表的结构应用,原子结构的分析判断,元素性质的应用,为高考常见题型,侧重于学生的分析能力的考查,注意周期表中,元素的推断,规律的应用是解题关键,题目难度中等.
一、选择题(单选题每题3分,共52分).
1.生产、生活中离不开化学知识.下列说法正确的是(
)
A.汽车尾气、工业废气的排放是形成“雾霾”的主要原因
B.用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应
C.不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬
D.“辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料
2.下列有关铜元素的说法中,正确的是(
)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应,生成黑色的Cu2O
D.CuSO4 5H2O是一种混合物,加热后变为白色粉末
3.在强酸性溶液中,可以大量共存的离子组是(
)
A.Na+、K+、AlO2﹣、Cl﹣
B.Ba2+、Na+、CO32﹣、NO3﹣
C.Na+、Ag+、SO42﹣、Cl﹣
D.Al3+、Fe3+、NO3﹣、SO42﹣
4.我国科学家首次合成了三种新核素,其中一种的名称是铪﹣185
(18572Hf).关于铪﹣185的说法正确的是(
)
A.铪﹣185的原子核内有72个电子
B.其中子数比电子数多41
C.是铪﹣180的一种新的同素异形体
D.铪﹣185的原子核内有185个质子
5.下面是某同学所画的各原子的原子结构示意图,你认为正确的是(
)
A.
B.
C.
D.
6.已知R2+核外有a个电子,b个中子,表示R原子符号正确的是(
)
A.R
B.R
C.R
D.R
7.下列说法中,正确的是(
)
A.在元素周期表里,主族元素所在的族序数等于原子核外电子数
B.在元素周期表里,元素所在的周期序数等于原子核外电子层数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
8.两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为(
)
A.1:1
B.1:2
C.1:3
D.1:4
9.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是(
)
X
Y
Z
W
A.原子半径:Z>X>Y
B.Y的最高正价与最低负价的和是4
C.W的单质是工业制取盐酸的原料之一
D.X、W的氢化物相遇会产生白烟
10.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B元素
(
)
A.一定是第2周期元素
B.一定是同一主族元素
C.可能是第2、3周期元素
D.可以相互化合形成化合物
11.科学家根据元素周期律和原子结构理论预测出原子序数为114的元素的存在,下面关于它的原子结构和性质预测不正确的是(
)
A.该元素原子的最外层电子数为4
B.其常见价态为+2、+4
C.它的金属性比铅强
D.它的原子半径比第115号元素的原子半径小
12.An+、Bn﹣、C
3种短周期元素的粒子具有相同的电子层结构,则关于它们的叙述正确的是(
)
A.原子序数:C>B>A
B.离子半径:Bn﹣<An+
C.C是稀有气体元素的原子
D.原子半径:A<B
13.某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,下列关系图正确的是(
)
A.
B.
C.
D.
二、解答题(共4小题,满分48分)
14.①168O、178O、188O
②H2O、D2O
③O2、O3
④H、D、T
⑤146C、C60五组微粒或物质,回答下列问题:
(1)互为同位素的是;
(2)互为同素异形体的是;
(3)由①和④中微粒能结合成含三个原子的化合物,这些化合物中分子量最大的是(填化学式)
15.(1)铜在潮湿的空气中会被锈蚀,表面生成的,写出其化学方程式.
(2)高温下,将CO通入CuO中,现象:,方程式为.
16.某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案.回答下列问题:
(1)沉淀A的化学式是,滤液B的成分是;
(2)在步骤③中发生的离子反应方程式;
(3)固体C的化学式;
步骤④的化学方程式为;
(4)写出固体C与NaOH溶液反应的方程式;
(5)要想将沉淀和滤液分离,①②③所需要的操作是,写出实验室制备Al(OH)3的离子方程式.
17.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
请根据要求用元素符号或化学式回答下列问题:
(1)写出d元素和l元素的名称.d:
l:
(2)表中所列元素中,原子最外层有2个电子的元素为.
(3)画出i元素原子的结构示意图,画出k元素的离子结构示意图
(4)l元素的最高正价是,最低负价是.
(5)比较元素e、f、g、h的离子半径.(写出离子符号)
(6)表中p元素是元素(填“金属”或“非金属”),p元素在元素周期表中的位置是.
2015-2016学年山东省德州市跃华学校高一(下)月考化学试卷(3月份)
一、选择题(单选题每题3分,共52分).
1.生产、生活中离不开化学知识.下列说法正确的是(
)
A.汽车尾气、工业废气的排放是形成“雾霾”的主要原因
B.用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应
C.不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬
D.“辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料
【分析】A.从工业废气、汽车尾气中含有大量的烟尘和污染空气的气体去分析解答;
B.常温下能用铝制容器盛放浓硫酸,是因为反应生成了致密的氧化膜阻止进一步反应;
C.在铁中添加金属铬制得不锈钢;
D.特种钢缆为金属材料.
【解答】解:A.工业废气、汽车尾气中含有大量的烟尘和污染空气的气体,故A正确;
B.常温下能用铝制容器盛放浓硫酸,是因为反应生成了致密的氧化膜阻止进一步反应,故B错误;
C.在铁中添加至少10.5%的金属铬即可制得不锈钢,金属铬在表面形成一层氧化物薄膜,有效的保护内层金属,使更耐腐蚀,故C错误;
D.特种钢缆为金属材料,不是非金属材料,故D错误;
故选:A.
【点评】本题考查物质的组成、结构与性质,为高频考点,把握物质的性质、应用及化学与生活的关系为解答的关键,注意钝化属于化学变化,题目难度不大.
2.下列有关铜元素的说法中,正确的是(
)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应,生成黑色的Cu2O
D.CuSO4 5H2O是一种混合物,加热后变为白色粉末
【分析】A.青铜为Cu的合金,不锈钢为Fe的合金,硬铝为Al的合金;
B.铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜;
C.铜与O2反应,生成黑色的CuO;
D.CuSO4 5H2O是纯净物.
【解答】解:A.青铜为Cu的合金,不锈钢为Fe的合金,硬铝为Al的合金,则青铜、不锈钢和硬铝都是合金,故A正确;
B.铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜,不属氧化物,故B错误;
C.铜与O2反应,生成黑色的CuO,Cu2O是红色的,故C错误;
D.CuSO4 5H2O是纯净物,加热后由蓝色晶体变为白色粉末,故D错误.
故选A.
【点评】本题考查金属的性质,为高频考点,把握金属及化合物的性质、发生的反应、性质与用途的关系等为解答的关键,侧重分析与应用能力的考查,题目难度不大.
3.在强酸性溶液中,可以大量共存的离子组是(
)
A.Na+、K+、AlO2﹣、Cl﹣
B.Ba2+、Na+、CO32﹣、NO3﹣
C.Na+、Ag+、SO42﹣、Cl﹣
D.Al3+、Fe3+、NO3﹣、SO42﹣
【分析】强酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能结合生成络离子等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
【解答】解:A.酸性条件下AlO2﹣不能大量共存,故A错误;
B..酸性条件下CO32﹣不能大量共存,故B错误;
C.Ag+、Cl﹣反应生成沉淀而不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选D.
【点评】本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、络合反应的离子共存考查,题目难度不大.
4.我国科学家首次合成了三种新核素,其中一种的名称是铪﹣185
(18572Hf).关于铪﹣185的说法正确的是(
)
A.铪﹣185的原子核内有72个电子
B.其中子数比电子数多41
C.是铪﹣180的一种新的同素异形体
D.铪﹣185的原子核内有185个质子
【分析】根据原子符号的含义、质量数=质子数+中子数,质子数相同、中子数不同的原子互为同位素.
【解答】解:A.原子核是由质子和中子构成的,无电子,故A错误;
B.72185Hf中子数=185﹣72=113,113﹣72=41,故B正确;
C.因两者的质子数都是72,中子数不同,则互为同位素,同素异形体必须是单质,故C错误;
D.72185Hf是的质量数为185,质子数为72,故D错误.
故选B.
【点评】本题主要考查核素、元素、同位素的概念,难度不大,需要掌握原子中的数字的意义及原子中量的关系.
5.下面是某同学所画的各原子的原子结构示意图,你认为正确的是(
)
A.
B.
C.
D.
【分析】根据核外电子排布理论:即能量最低原理、泡利原理、洪特规则判断.
【解答】解:A、违反了泡利原理,每个原子轨道最多容纳两个电子,应表示为:故A错误;
B、违反了能量最低原理,先排布4s轨道后排3d轨道,应表示为:故B错误;
C、违反了能量最低原理,先排满3p后排4s,20号元素为钙,不可能失去6个电子,应表示为:故C错误;
D、均符合核外电子排布规律,故D正确;
故选:D.
【点评】本题考察核外电子排布规律的应用,充分理解能量最低原理、泡利原理和红特规则及其特例是解题关键.
6.已知R2+核外有a个电子,b个中子,表示R原子符号正确的是(
)
A.R
B.R
C.R
D.R
【分析】阳离子中,质子数=核外电子数+电荷数,质量数=质子数+中子数,根据质子数和质量数书写原子符号.
【解答】解:R2+离子核外有a个电子,质子数=核外电子数+电荷数=a+2,质量数=质子数+中子数=a+2+b,所以R原子符号为a+2a+b+2R,
故选C.
【点评】本题考查质子数、中子数和质量数之间的关系,难度不大.要注意原子符号的意义.
7.下列说法中,正确的是(
)
A.在元素周期表里,主族元素所在的族序数等于原子核外电子数
B.在元素周期表里,元素所在的周期序数等于原子核外电子层数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
【分析】A.主族元素所在的族序数等于原子核外最外层电子数;
B.电子层数等于周期序数;
C.最外层电子数为8的粒子可能是离子;
D.电子层数相同,核电荷数越多半径越小.
【解答】解:A.主族元素所在的族序数等于最外层电子数,由原子核外电子数可确定最外层电子数,故A错误;
B.周期表里,元素所在的周期序数等于原子核外电子层数,故B正确;
C.最外层电子数为8的粒子不一定是稀有气体的原子,还可能是离子例如钠离子,故C错误;
D.电子层数相同,核电荷数越多半径越小,故D错误;
故选B.
【点评】本题考查元素周期表的结构与应用,为高频考点,把握原子结构与元素的位置关系、元素周期表的结构等为解答的关键,注重基础知识的考查,题目难度不大.
8.两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为(
)
A.1:1
B.1:2
C.1:3
D.1:4
【分析】铝与盐酸发生反应:2Al+6HCl=2AlCl3+3H2↑,铝与NaOH溶液发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,令铝与盐酸、NaOH溶液反应生成的氢气物质的量分别为1mol、2mol,根据反应的方程式计算参加反应的铝的物质的量,进而计算质量之比.
【解答】解:设铝与盐酸、NaOH溶液反应生成的氢气的物质的量分别为1mol、2mol,则:
则2Al+6HCl=2AlCl3+3H2↑
2
3
mol
1mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2
3
mol
2mol
则第一份与第二份铝屑的质量比为(mol×27g/mol):(mol×27g/mol)=1:2,
故选B.
【点评】本题考查铝的性质、化学方程式的计算,题目难度不大,解答本题的关键是要正确书写反应的有关方程式,也可利用电子守恒来计算解答.
9.X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若X原子的最外层电子数比其次外层电子数多3个,下列说法不正确的是(
)
X
Y
Z
W
A.原子半径:Z>X>Y
B.Y的最高正价与最低负价的和是4
C.W的单质是工业制取盐酸的原料之一
D.X、W的氢化物相遇会产生白烟
【分析】X原子的最外层电子数比其次外层电子数多3个,X为第二周期的N元素,最外层电子数为5,结合在短周期的位置可知,Y为O,Z为P,W为Cl,然后结合元素周期律及元素化合物知识来解答.
【解答】解:X原子的最外层电子数比其次外层电子数多3个,X为第二周期的N元素,最外层电子数为5,结合在短周期的位置可知,Y为O,Z为P,W为Cl,
A.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径:Z>X>Y,故A正确;
B.Y为O,不存在最高正价,故B错误;
C.氯气与氢气发生反应生成HCl,HCl溶于水得到盐酸,则W的单质是工业制取盐酸的原料之一,故C正确;
D.X、W的氢化物分别为氨气、HCl,二者反应生成氯化铵,相遇会产生白烟,故D正确;
故选B.
【点评】本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、性质、元素化合物为解答的关键,侧重分析与应用能力的考查,注意O不存在正价,题目难度不大.
10.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍,则A、B元素
(
)
A.一定是第2周期元素
B.一定是同一主族元素
C.可能是第2、3周期元素
D.可以相互化合形成化合物
【分析】A元素的原子最外层电子数是次外层电子数的3倍,应为O元素,B元素的原子次外层电子数是最外层电子数的2倍,核外电子数可为2、1,或2、8、4,可能为Li、Si,以此解答该题.
【解答】解:A元素的原子最外层电子数是次外层电子数的3倍,应为O元素,B元素的原子次外层电子数是最外层电子数的2倍,核外电子数可为2、1,或2、8、4,可能为Li、Si,
A.如B为Si,则为第三周期元素,故A错误;
B.A为O,B可能为Li或Si,则一定不在同一主族,故B错误;
C.A为O,B可能为Li或Si,可能是第二、三周期元素,故C正确;
D.如B为Li,则形成的化合物为B2A,如B为Si,则形成的化合物化学式为BA2,可以相互化合形成化合物,故D正确.
故选CD.
【点评】本题考查原子结构与元素的性质,侧重于学生的分析能力的考查,注意把握原子结构特点,为解答该题的关键,难度不大.
11.科学家根据元素周期律和原子结构理论预测出原子序数为114的元素的存在,下面关于它的原子结构和性质预测不正确的是(
)
A.该元素原子的最外层电子数为4
B.其常见价态为+2、+4
C.它的金属性比铅强
D.它的原子半径比第115号元素的原子半径小
【分析】原子序数为114的元素属于第七周期第ⅣA族,称为类铅元素,利用第ⅣA族元素的性质的相似性和递变性来解答.
【解答】解:A.位于第ⅣA族,族序数等于最外层电子数,则类铅元素原子的最外层电子数为4,故A正确;
B.位于第ⅣA族,常见的价态为+2、+4,故B正确;
C.同主族从上到下金属性在增强,则它的金属性比铅强,故C正确;
D.同周期从左向右原子半径在减小,则它的原子半径比第115号元素的原子半径大,故D错误;
故选D.
【点评】本题考查元素的位置及性质,为高频考点,把握第ⅣA族元素的性质是解答本题的关键,注意元素周期表和周期律的应用,题目难度不大.
12.An+、Bn﹣、C
3种短周期元素的粒子具有相同的电子层结构,则关于它们的叙述正确的是(
)
A.原子序数:C>B>A
B.离子半径:Bn﹣<An+
C.C是稀有气体元素的原子
D.原子半径:A<B
【分析】An+、Bn﹣、C
3种短周期元素的粒子具有相同的电子层结构,可知A位于B、C的下一周期,B、C位于相同周期,C的最外层达到稳定结构,以此解答该题.
【解答】解:A.设C的原子序数为Z,则A的原子序数为Z+n,B的原子序数则为Z﹣n,则原子序数为A>C>B,故A错误;
B.因An+、Bn﹣具有相同的电子层结构,核电荷数越大半径越小,阴离子半径大于阳离子半径,即Bn﹣>An+,故B错误;
C.An+、Bn﹣都应具有稀有气体的电子层结构,C的电子层结构相同于An+、Bn﹣,所以C必为稀有气体元素的原子,故C正确;
D.A处于B、C的下一周期,故A的原子半径应大于B.故D错误.
故选C.
【点评】本题考查原子结构与元素周期律的关系,侧重于学生的分析能力的考查,此类题目首先要根据题给信息,确定各元素在周期表中的相对位置,然后根据元素周期律加以对照.
13.某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,下列关系图正确的是(
)
A.
B.
C.
D.
【分析】AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,再继续滴加NaOH溶液时,氢氧化铝
会完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液.
【解答】解:含MgCl2和AlCl3各0.01mol,向其中逐滴加入1mol/L的NaOH溶液至过量,发生反应Al3++3OH﹣═Al(OH)3↓,得到沉淀0.01mol,消耗氢氧化钠0.03mol,即30mL,Mg2++2OH﹣═Mg(OH)2↓,得到次沉淀0.01mol,消耗氢氧化钠0.02mol,即20mL,随反应进行沉淀量增大,共消耗氢氧化钠50mL,0.01mol氢氧化铝会溶于过量的氢氧化钠中,Al(OH)3↓+OH﹣═[Al(OH)4]﹣,消耗氢氧化钠10mL,故沉淀达最大值后,再加氢氧化钠,沉淀量减小,直到最后剩余的是氢氧化镁沉淀0.01mol.故选C.
【点评】理清反应的整个过程,问题即可解决,即可利用方程式也可根据关系式,本题采取原子守恒计算.
二、解答题(共4小题,满分48分)
14.①168O、178O、188O
②H2O、D2O
③O2、O3
④H、D、T
⑤146C、C60五组微粒或物质,回答下列问题:
(1)互为同位素的是①④;
(2)互为同素异形体的是③;
(3)由①和④中微粒能结合成含三个原子的化合物,这些化合物中分子量最大的是T2188O(填化学式)
【分析】有相同质子数、不同中子数的原子或同一元素的不同核素互为同位素;
相同元素组成、不同形态的单质互为同素异形体.
【解答】解:(1)①168O、178O、188O
质子数相同,中子数不同,互为同位素;④H、D、T质子数相同,中子数不同,互为同位素;
(2)O2、O3是由氧元素形成的不同单质,互为同素异形体;
(3)由①和④中微粒能结合成含三个原子的化合物,其中分子量最大的是T2188O;
故答案为:①④;③;T2188O.
【点评】本题考查同位素、同素异形体的概念,难度不大,对于元素、核素、同位素、同素异形体、同分异构体、同种物质等概念的区别是考试的热点问题.
15.(1)铜在潮湿的空气中会被锈蚀,表面生成绿色的碱式碳酸铜,写出其化学方程式2Cu+O2+H2O+CO2═Cu2(OH)2CO3.
(2)高温下,将CO通入CuO中,现象:黑色粉末变为红色固体,方程式为CuO+COCu+CO2.
【分析】(1)铜在空气中与O2、CO2、H2O反应产生Cu2(OH)2CO3;
(2)高温下CO具有强还原性,CuO被还原成Cu单质.
【解答】解:(1)铜在潮湿的空气中会被锈蚀,生成绿色的碱式碳酸铜,是因为铜在空气中与O2、CO2、H2O反应产生Cu2(OH)2CO3;反应方程式为:2Cu+O2+H2O+CO2═Cu2(OH)2CO3,
故答案为:绿色;碱式碳酸铜;2Cu+O2+H2O+CO2═Cu2(OH)2CO3;
(2)高温下CO具有强还原性,黑色粉末CuO被还原成Cu单质,铜是红色固体,反应方程式为:CuO+COCu+CO2,
故答案为:黑色粉末变为红色固体;CuO+COCu+CO2.
【点评】本题考查铜及其化合物的性质,属于基础知识的考查,注意碱式碳酸铜化学式的书写,题目比较简单.
16.某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案.回答下列问题:
(1)沉淀A的化学式是SiO2,滤液B的成分是NaAlO2、NaCl、NaOH;
(2)在步骤③中发生的离子反应方程式CO2+2H2O+AlO2﹣═HCO3﹣+Al(OH)3↓;
(3)固体C的化学式Al2O3;
步骤④的化学方程式为2Al(OH)33H2O↑+Al2O3;
(4)写出固体C与NaOH溶液反应的方程式Al2O3+2NaOH=2NaAlO2+H2O;
(5)要想将沉淀和滤液分离,①②③所需要的操作是过滤,写出实验室制备Al(OH)3的离子方程式Al3++3NH3 H2O═Al(OH)3↓+3NH4+.
【分析】氧化铝样品中含有氧化铁和二氧化硅,加入过量盐酸氧化铝、氧化铁溶解生成氯化铝、氯化铁溶液,过滤得到沉淀A为二氧化硅,滤液A为氯化铁和氯化铝溶液,加入过量氢氧化钠溶液生成氢氧化铁沉淀和偏铝酸钠溶液,过滤得到沉淀B为Fe(OH)3,滤液为NaAlO2,通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝沉淀,加热分解生成C为氧化铝,以此解答该题.
【解答】解:氧化铝样品中含有氧化铁和二氧化硅,加入过量盐酸氧化铝、氧化铁溶解生成氯化铝、氯化铁溶液,过滤得到沉淀A为二氧化硅,滤液A为氯化铁和氯化铝溶液,加入过量氢氧化钠溶液生成氢氧化铁沉淀和偏铝酸钠溶液,过滤得到沉淀B为Fe(OH)3,滤液为NaAlO2,通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝沉淀,加热分解生成C为氧化铝,
(1)由以上分析可知沉淀A为SiO2,滤液B的成分为NaAlO2、NaCl、NaOH,故答案为:SiO2;NaAlO2、NaCl、NaOH;
(2)步骤③为偏铝酸钠溶液与二氧化碳反应生成氢氧化铝沉淀,其离子反应为CO2+2H2O+AlO2﹣═HCO3﹣+Al(OH)3↓,
故答案为:CO2+2H2O+AlO2﹣═HCO3﹣+Al(OH)3↓;
(3)C为Al2O3,步骤④的化学方程式为2Al(OH)33H2O↑+Al2O3,故答案为:Al2O3;2Al(OH)33H2O↑+Al2O3;
(4)氧化铝为两性氧化物,可与氢氧化钠溶液反应,反应的方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(5)分离液体和不溶性固体,可用过滤的方法,实验室制备Al(OH)3,利用可溶性铝盐和氨水反应,离子反应为Al3++3NH3 H2O═Al(OH)3↓+3NH4+,
故答案为:过滤;Al3++3NH3 H2O═Al(OH)3↓+3NH4+.
【点评】本题考查镁、铝、硅的化合物的性质,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,明确物质的性质及转化中发生的化学反应是解答本题的关键,题目难度不大.
17.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
请根据要求用元素符号或化学式回答下列问题:
(1)写出d元素和l元素的名称.d:氮
l:氯
(2)表中所列元素中,原子最外层有2个电子的元素为He、Mg.
(3)画出i元素原子的结构示意图,画出k元素的离子结构示意图
(4)l元素的最高正价是+7,最低负价是﹣1.
(5)比较元素e、f、g、h的离子半径O2﹣>F﹣>Na+>Mg2+.(写出离子符号)
(6)表中p元素是非金属元素(填“金属”或“非金属”),p元素在元素周期表中的位置是第四周期ⅤA族.
【分析】根据元素周期表中元素的位置和分布可以推知a是H,b是He,c是C,d是N,e是O,f是F,g是Na,h是Mg,i是Al,j是Si,k是S,l是Cl,m是Ar,n是K,o是Ge,p为As元素.
(1)由以上分析可知d为氮元素,l为氯元素;
(2)根据核外电子排布判断;
(3)根据核外电子排布特点书写结构示意图;
(4)l是Cl,最外层有7个电子,最高正价为+7价,最低负价为﹣1价;
(5)e是O,f是F,g是Na,h是Mg,对应离子具有相同的核外电子排布,核电荷数越大离子半径越小;
(6)p为As元素,为非金属元素,位于周期表第四周期ⅤA族.
【解答】解:根据元素周期表中元素的位置和分布可以推知a是H,b是He,c是C,d是N,e是O,f是F,g是Na,h是Mg,i是Al,j是Si,k是S,l是Cl,m是Ar,n是K,o是Ge,p为As元素.
(1)由以上分析可知d为氮元素,l为氯元素,故答案为:氮;氯;
(2)表中所列元素中,原子最外层有2个电子的元素为He、Mg,故答案为:He、Mg;
(3)i是Al,原子核外有3个电子层,最外层电子数为3,原子结构示意图为,k为S元素,离子核外有3个电子层,最外层电子数为8,离子结构示意图为,
故答案为:;;
(4)l是Cl,最外层有7个电子,最高正价为+7价,最低负价为﹣1价,故答案为:+7;﹣1;
(5)e是O,f是F,g是Na,h是Mg,对应离子具有相同的核外电子排布,核电荷数越大离子半径越小,应为O2﹣>F﹣>Na+>Mg2+,
故答案为:O2﹣>F﹣>Na+>Mg2+;
(6)p为As元素,为非金属元素,位于周期表第四周期ⅤA族,故答案为:非金属;第四周期ⅤA族.
【点评】本题考查了周期表的结构应用,原子结构的分析判断,元素性质的应用,为高考常见题型,侧重于学生的分析能力的考查,注意周期表中,元素的推断,规律的应用是解题关键,题目难度中等.
同课章节目录
