2016-2017学年新人教版必修1 1.2《化学计量在实验中的应用》课件1 (109张)
文档属性
| 名称 | 2016-2017学年新人教版必修1 1.2《化学计量在实验中的应用》课件1 (109张) |  | |
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-27 13:28:36 | ||
图片预览










文档简介
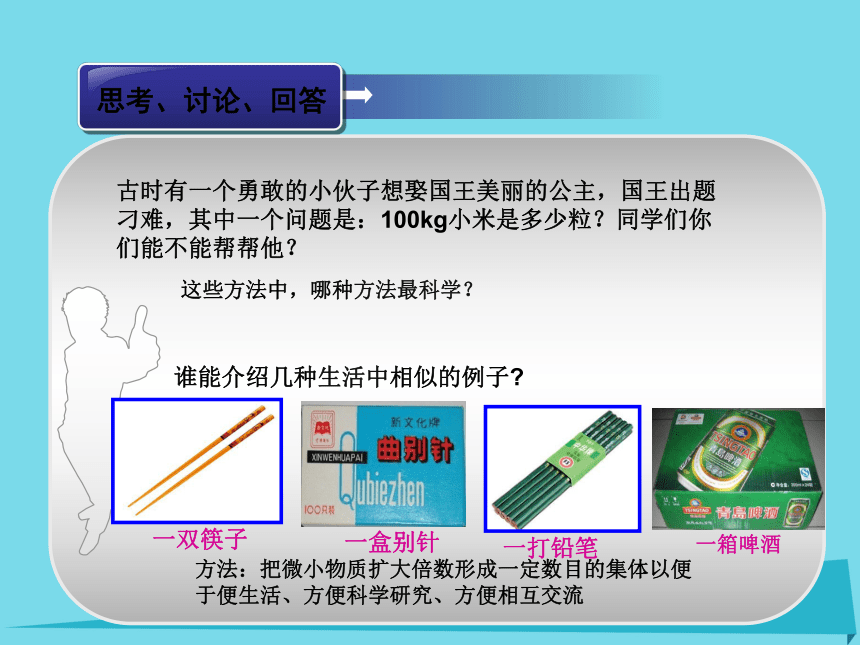
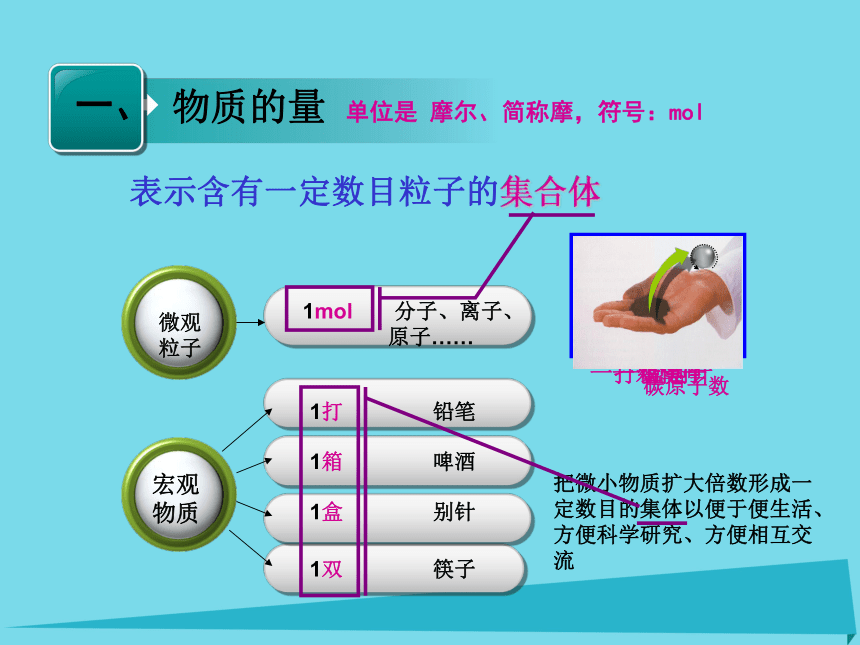
课件109张PPT。这些方法中,哪种方法最科学? 谁能介绍几种生活中相似的例子?古时有一个勇敢的小伙子想娶国王美丽的公主,国王出题刁难,其中一个问题是:100kg小米是多少粒?同学们你们能不能帮帮他?方法:把微小物质扩大倍数形成一定数目的集体以便于便生活、方便科学研究、方便相互交流 一箱啤酒一盒别针一打铅笔一双筷子12 g C中含多少个碳原子? 物质的量? 宏观
物质微观
粒子
表示含有一定数目粒子的集合体一箱啤酒一打铅笔一双筷子一盒别针单位是 摩尔、简称摩,符号:mol把微小物质扩大倍数形成一定数目的集体以便于便生活、方便科学研究、方便相互交流 1、是国际单位制七个基本物理量之一2、物质的量的单位是 摩尔、简称摩,符号:mol1 摩尔的标准:1 mol粒子集体所含的粒子数= 0.012 kg12C中所含的碳原子数实践体验:已知一个12C原子的质量为1.993×10-26 kg,问
0.012 kg12C中有多少个碳原子?≈ 6.02×10236.02×1023 符号: NA 单位: mol-1,数值:约为6.02×1023 科学上规定为: 0.012 Kg 12C 中所含的碳原子数规定解释:如果某物质含有与 0.012 Kg 12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。感受阿伏加德罗常数 如果把6.02×1023个直径为2.5cm的硬币排
成一行,可以来回于地球与太阳之间240.8亿次 如果把 6.02×1023 粒米给全球60亿人吃,
每人每天吃一斤,要吃14万年。
(1)摩尔是七个物理量之一。
(2)摩尔是物质的质量单位。
(3) 1摩尔大米含有 6.02×1023个米粒。
(4)1mol氢
错误。物质的量 是七个基本物理量之一 错误。摩尔是物质的量的单位错误。物质的量只适用于微观粒子,不能用来说明
宏观物质错误。没有指出是分子、原子或离子1、说出下列符号的意义:
①2H 、②2molH 、 ③2molH+ 、
④2molH2 、⑤4molFe3+ 、⑥a molSO3 、
2、用符号表示:
2摩尔水分子 、5摩尔硫酸根离子 、
n 摩尔氧原子 、1摩尔碳酸氢根离子 、
10摩尔亚铁离子 、3摩尔氯化氢分子 、
(1)1mol碳原子含有 个碳原子
(2)0.3mol硫酸分子含有 个硫酸分子
(3)10mol钠离子含有 个钠离子
(4)6mol电子含有 个电子
(5)0.5mol中子含有 个中子 1×NA
0.3×NA
10×NA
6×NA
0.5×NA物质的量是表示微粒的集体,可以用分数或小数表示。
物质的量(n)== 微粒数目(N)阿伏加德罗常数(NA) 1 摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子?H2O 11 molNA2HO212NANA1 mol2 mol微粒个数微粒集体物质的量微粒个数1个1个1个物质的量1mol1mol1mol微粒个数物质的量2个1个2个2mol1mol2mol一个比例关系
n1︰n2=N1︰N2
1、下列关于摩尔的说法中,正确的是( )
A.摩尔是一个物理量,含6.02×1023个粒子?
B. 摩尔是国际单位制的七个基本单位之一
C.摩尔既是物质的量的单位,又是粒子的数
量单位
D.摩尔的基准是0.012 Kg 12C中所含的碳原
子数√√ 2、下列关于阿伏加德罗常数的说法正确的是
( )
A.阿伏加德罗常数是一个纯数,没有单位
B.阿伏加德罗常数就是6.02×1023
C.阿伏加德罗常数是指1 mol 的任何粒子的
粒子数
D.阿伏加德罗常数的近似值为:
6.02×1023 mol-1√√3、1mol H2SO4中约含有 个硫酸分子,
个氧原子。4、含3.01×1023个Na+的 Na2SO4中约含 SO42- mol,5、3molNa2CO3·10H2O含有 NA氢原子、
含有 个钠离子和 个碳酸根离子 1molH2O
约含有6.02×1023个水分子,
质量是18g 1molAl
约含有6.02×1023 个铝原子,
质量是27g1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同, 1mol不同物质的质量也不同125698182317实践体验(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。Na的摩尔质量为 、
Na+的摩尔质量为 、
H2SO4的摩尔质量为 、
HNO3的摩尔质量为 、 1molFe的质量是: 、
1molO2的质量是: 、
1molH2SO4的质量是: 、
1molFe2+的质量是: 、(1)定义:(2)定义式:单位物质的量的物质所具有的质量叫摩尔质量。物质的质量、物质的量、摩尔质量之间的关系m(H2SO4)n(H2SO4)=解:M(H2SO4)=98g/molM(H2SO4)49gn(H2SO4)=98g/mol=0.5molN(H2SO4)==0.5mol×6.02×1023/moln(H2SO4)×NA=3.01×1023 2、 19.6 g硫酸是 molH2SO4 ,含有 个硫酸分子,其中含有 molH,计 个氢原子,含有 molO ,计 个氧原子 。
1、请计算:
A、24.5克H2SO4的物质的量是 、
B、11克CO2的物质的量是 、
C、2.5molNa2CO3的质量是 、
D、1.5molH2O的质量是 、一、物质的量(n):表示含有一定数目粒子的集合体二、阿伏加德罗常数:1 mol 任何粒子的粒子数。三、摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量导入1、如何定量的表示溶液的浓和稀?学过哪种方法?
如:将20gNaCl溶于80gH2O中得到NaCl溶液,则该溶液中NaCl的质量分数为?
2、很多反应都是在溶液中进行,如:在溶液中反应时,通常不称其质量,而是量它的体积V;同时,在化学反应中,反应物与生成物的物质的量n之间存在一定的关系——系数之比=物质的量之比。2 1 1 22mol 1 mol 1mol 2mol系数物质的量nn?V一、物质的量浓度1、定义:单位体积溶液中所含溶质B的物质的量——CB2、符号: CB3、公式:4、单位:mol ·L-1 或 mol/L物质的量n微粒数N NANAMM质量m气体体积V Vm物质的量浓度CB×V(1)、nB:溶质B的物质的量溶液(2)、V: 溶液的体积V溶液除特殊说明体积可相加,其它用(a)(b)溶液判断正误:
a.将58.5gNaCl溶于H2O得到 1L NaCl溶液,则CNaCl= 1.0 mol/L
b.将58.5gNaCl溶于 1L H2O得到NaCl溶液,则CNaCl= 1.0 mol/L溶液例.标况下,1L水中溶解了336LHCl气体,得到密度为1.17g/cm3的盐酸,求所得盐酸的物质的量浓度CHCl?解析:溶液例.在4℃时,100mL水中溶解了22.4LHCl气体(标况下)后形成溶液,下列说法正确是( )
A.该溶液的物质的量浓度为10.0mol/L
B.该溶液物质的量因溶液的密度未知而无法求得
C.该溶液的质量分数因溶液的密度未知而无法求得
D.所得溶液体积为22.5L溶液例.将4gNaOH溶于H2O中得到500mL溶液,求CNaOH?
例.欲得到1000mL 0.1mol/LNaOH溶液,需要NaOH的质量是多少?
例.
VLNa2SO4溶液中含Na+的物质的量浓度为1.00mol/L,求SO42-的物质的量浓度?VL硫酸铁溶液中含Fe3+mg,则SO42-的物质的量浓度为( )
A. B. C. D.5、CB与ω的关系例 已知浓盐酸的物质的量浓度为11.8mol/L,密度为1.18g/cm3,求浓盐酸的质量分数?物质的量浓度的有关计算物质的量浓度计算1.基本量的换算2.溶液中溶质微粒数目的计算3.质量分数与物质的量浓度的换算4.溶液稀释与浓缩5.两种不同浓度溶液混合6.化学反应中计算请大家计算一下下列各溶质的物质的量浓度:0.520.20.510.051.基本量的换算2.溶液中溶质微粒数目的计算 例: 2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。 22.408×10241.204×1024 3.溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)1000 ω ρ注:密度的单位是g/cm3
ω 是溶液的质量分数
M 是溶质的摩尔质量
例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
答:该硝酸中HNO3的物质的量浓度为22.4mol/L解:根据解题思路可得:
C=------------------ = ---------------------
1000 ω ρM631000× 94% ×1.5=22.4mol/L例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:根据解题思路可得:
C=---------------------- ω=--------------------
答:该溶液溶质的质量分数为7.4%M
1000 ω ρ1000ρ
C M=----------------------×100%1000×1.082×40=7.4%
4.溶液稀释与浓缩结论:浓溶液配制稀溶液前后溶质的量不变
思路:稀释溶液前后溶质的物质的量相等 C1V1= C2V2 例:将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
例:配制500mL1 mol/L的H2SO4溶液,需要密度为1.8g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5×1=V×1.8×98%÷98解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L5.两种不同浓度溶液混合 思路:C3V3 = C1V1+C2V2(混合前后溶质的物质的量总和不变)规律1:密度大于水的溶液,溶液的质量分数越大,密度越大,溶质物质的量浓度就越大,如盐酸、硫酸、氢氧化钠溶液。反之亦然。
规律2:同种溶质两种不同浓度的溶液混合 [溶质的质量分数分别为 a%、b%,混合溶液的密度为ρg/ml ]
(1)等质量混合后的质量分数为:(a%+b% ) /2,物质的量浓度为:1000 ρ(a%+b% ) /2∕M
(2)等体积混合(大大小小)
若ρ>1 g/mL,混合后的质量分数大于(a%+b% ) /2, ,物质的量浓度大于1000 ρ(a%+b% ) /2 ∕ M 如硫酸、硝酸溶液.
若ρ<1g/mL,混合后的质量分数小于 (a%+b% ) /2,物质的量浓度小于1000 ρ(a%+b% ) /2 ∕ M 如氨水、乙醇溶液.6.化学反应中计算例:中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
解: 2NaOH~~~~H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L1.物质的量浓度的概念表达式(计算公式)cB=n/V,其中V 表示__________的体积。
2.判断正误,正确的划“√”,错误的划“×”
(1)1 mol NaCl溶于1 L水所得溶液的物质的量浓度是1 mol·L-1 ( )
(2)将25 g CuSO4·5H2O溶解在1 L水中,所得溶液的物质的量浓度为0.1 mol·L-1 ( )
(3)把1 mol NH3通入水中得到1 L溶液,其物质的量浓度为1 mol·L-1 ( )
(4)将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1 ( )溶液× × √ 温故知新0.0011.游泳池里的水一般常加适量的CuSO4,用以杀灭其中的细菌,而对游泳者的身体无害。现取一水样300 mL,经分析其中含有0.019 2 g Cu2+,则水样中CuSO4的物质的量浓度为______mol·L-1。探究点一 溶质物质的量浓度的求算习题导学2.V L Fe2(SO4)3溶液中含Fe3+ m g,则该溶液中Fe3+的物质的量浓度为________mol·L-1,SO的物质的量浓度为________mol·L-1,溶质的物质的量浓度为________mol·L-1。习题导学体积(L) 计算溶质的物质的量浓度的基本依据是其概念,数学表达式为 。关键是从已知条件中找出溶质的 和溶液的 ,据此求出溶质的物质的量浓度cB。物质的量(mol)总结感悟一 溶质物质的量浓度的求算1.用1 L水吸收560 L氨气(标准状况),所得氨水的密度是0.90 g·mL-1。求:
(1)氨气的物质的量是__________。
(2)所得氨水溶液的物质的量浓度是__________。活学活用总结感悟1.从1 L 1 mol·L-1 NaOH溶液中取出100 mL
(1)取出的这100 mL NaOH溶液的物质的量浓度是______________,含NaOH的质量是______。
(2)若将取出的这100 mL NaOH溶液加水稀释至500 mL,所得溶液的物质的量浓度是_________________。4 g 探究点二 溶液的稀释或混合解析 (1)mB=0.1 L×1 mol·L-1×40 g·mol-1=4 g。习题导学2.欲将0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求两种溶液的体积比(忽略混合时溶液体积变化)。解析:设所需0.10 mol·L-1的NaOH溶液及所需0.60 mol·L-1的NaOH溶液的体积分别是V1和V2,根据混合前后溶质的物质的量不变列式得:
0.10 mol·L-1·V1+0.60 mol·L-1·V2=0.20 mol·L-1·(V1+V2)
解得:V1:V2 =4:1习题导学(1)浓溶液加水稀释后,溶质的物质的量不变:
c(浓)·V(浓)=c(稀)·V(稀)。
(2)同一溶质、不同浓度溶液的混合,溶质为原来各溶液中所含溶质的物质的量之和:c1·V1+c2·V2=c(混)·V(混)。
注意 混合后溶液的体积:
①若指出不考虑溶液体积改变,可认为是原溶液的体积之和;
②若给出混合后溶液的密度,应根据总结感悟二溶液的稀释或混合2.(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为________mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为______mol·L-1;溶质的质量为________g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为__________mol·L-1,SO的物质的量浓度为________mol·L-1。0.20.21.420.20.1活学活用(3)50 mL溶液用水稀释到100 mL,据c(浓)·V(浓)=c(稀)·V(稀),Na2SO4的浓度变为原来的0.5,即0.1 mol·L-1,故Na+浓度为0.2mol·L-1,SO浓度为0.1 mol·L-1。(2)从中取出50 mL溶液,浓度仍为0.2 mol·L-1
溶质的质量为m=n·M=c·V·M=0.2 mol·L-1×0.05 L×142 g·mol-1=1.42 g。活学活用1.市售浓硫酸中溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓硫酸中H2SO4的物质的量浓度。探究点三 物质的量浓度与溶质的质量分数、溶解度之间的相互求算解析:1 000 mL浓硫酸中H2SO4的质量为m(H2SO4)=ρ[H2SO4(aq)]·V[H2SO4(aq)]·w(H2SO4)=1.84 g·cm-3×98%×1 000 mL=1 803.2 g。
1 803.2 g H2SO4的物质的量为n(H2SO4)=18.4 mol。
因为1 000 mL浓硫酸中含18.4 mol H2SO4,所以市售浓硫酸中H2SO4的物质的量浓度为18.4 mol·L-1。 习题导学2.20 ℃,将60 g某固体物质完全溶解于水,配制成200 mL 密度为1.5 g·mL-1的饱和溶液,求20 ℃时该饱和溶液的物质的量浓度(该物质的摩尔质量为M g·mol-1) _________________。习题导学总结感悟三 物质的量浓度与溶质的质量分数、溶解度之间的相互求算活学活用活学活用物质的量浓度与溶质的质量分数、溶解度之间求算题目的解题思路一般有两个出发点:总结感悟1.2.0 g NaOH固体溶于水配成100 mL溶液,溶液中c(Na+)为 ( )
A.0.2 mol·L-1 B.0.3 mol·L-1
C.0.4 mol·L-1 D.0.5 mol·L-1D当堂巩固解析 c(Na+)=2.0 g÷40 g·mol-1÷0.1 L=0.5 mol·L-1。C自我·检测区当堂巩固13.6当堂巩固3.现用98%的浓H2SO4(ρ=1.84 g·cm-3)配制浓度为0.5 mol·L-1的稀硫酸500 mL,则所需浓H2SO4的体积为________ mL。物质的量浓度的有关计算物质的量浓度计算1.基本量的换算2.溶液中溶质微粒数目的计算3.质量分数与物质的量浓度的换算4.溶液稀释与浓缩5.两种不同浓度溶液混合6.化学反应中计算请大家计算一下下列各溶质的物质的量浓度:0.520.20.510.051.基本量的换算2.溶液中溶质微粒数目的计算 例: 2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。 22.408×10241.204×1024 3.溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)1000 ω ρ注:密度的单位是g/cm3
ω 是溶液的质量分数
M 是溶质的摩尔质量
例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
答:该硝酸中HNO3的物质的量浓度为22.4mol/L解:根据解题思路可得:
C=------------------ = ---------------------
1000 ω ρM631000× 94% ×1.5=22.4mol/L例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:根据解题思路可得:
C=---------------------- ω=---------------------
答:该溶液溶质的质量分数为7.4%M
1000 ω ρ1000ρ
C M=----------------------×100%1000×1.082×40=7.4%
4.溶液稀释与浓缩结论:浓溶液配制稀溶液前后溶质的量不变
思路:稀释溶液前后溶质的物质的量相等 C1V1= C2V2 例:将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
例:配制500mL1 mol/L的H2SO4溶液,需要密度为1.8g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5×1=V×1.8×98%÷98解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L5.两种不同浓度溶液混合 思路:C3V3 = C1V1+C2V2(混合前后溶质的物质的量总和不变)规律1:密度大于水的溶液,溶液的质量分数越大,密度越大,溶质物质的量浓度就越大,如盐酸、硫酸、氢氧化钠溶液。反之亦然。
规律2:同种溶质两种不同浓度的溶液混合 [溶质的质量分数分别为 a%、b%,混合溶液的密度为ρg/ml ]
(1)等质量混合后的质量分数为:(a%+b% ) /2,物质的量浓度为:1000 ρ(a%+b% ) /2∕M
(2)等体积混合(大大小小)
若ρ>1 g/mL,混合后的质量分数大于(a%+b% ) /2, ,物质的量浓度大于1000 ρ(a%+b% ) /2 ∕ M 如硫酸、硝酸溶液.
若ρ<1g/mL,混合后的质量分数小于 (a%+b% ) /2,物质的量浓度小于1000 ρ(a%+b% ) /2 ∕ M 如氨水、乙醇溶液.6.化学反应中计算例:中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
解: 2NaOH~~~~H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L1.物质的量浓度的概念表达式(计算公式)cB=n/V,其中V 表示__________的体积。
2.判断正误,正确的划“√”,错误的划“×”
(1)1 mol NaCl溶于1 L水所得溶液的物质的量浓度是1 mol·L-1 ( )
(2)将25 g CuSO4·5H2O溶解在1 L水中,所得溶液的物质的量浓度为0.1 mol·L-1 ( )
(3)把1 mol NH3通入水中得到1 L溶液,其物质的量浓度为1 mol·L-1 ( )
(4)将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1 ( )溶液× × √ 温故知新0.0011.游泳池里的水一般常加适量的CuSO4,用以杀灭其中的细菌,而对游泳者的身体无害。现取一水样300 mL,经分析其中含有0.019 2 g Cu2+,则水样中CuSO4的物质的量浓度为______mol·L-1。探究点一 溶质物质的量浓度的求算习题导学2.V L Fe2(SO4)3溶液中含Fe3+ m g,则该溶液中Fe3+的物质的量浓度为________mol·L-1,SO的物质的量浓度为________mol·L-1,溶质的物质的量浓度为________mol·L-1。习题导学体积(L) 计算溶质的物质的量浓度的基本依据是其概念,数学表达式为 。关键是从已知条件中找出溶质的 和溶液的 ,据此求出溶质的物质的量浓度cB。物质的量(mol)总结感悟一 溶质物质的量浓度的求算1.用1 L水吸收560 L氨气(标准状况),所得氨水的密度是0.90 g·mL-1。求:
(1)氨气的物质的量是__________。
(2)所得氨水溶液的物质的量浓度是__________。活学活用总结感悟1.从1 L 1 mol·L-1 NaOH溶液中取出100 mL
(1)取出的这100 mL NaOH溶液的物质的量浓度是______________,含NaOH的质量是______。
(2)若将取出的这100 mL NaOH溶液加水稀释至500 mL,所得溶液的物质的量浓度是_________________。4 g 探究点二 溶液的稀释或混合解析 (1)mB=0.1 L×1 mol·L-1×40 g·mol-1=4 g。习题导学2.欲将0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求两种溶液的体积比(忽略混合时溶液体积变化)。解析:设所需0.10 mol·L-1的NaOH溶液及所需0.60 mol·L-1的NaOH溶液的体积分别是V1和V2,根据混合前后溶质的物质的量不变列式得:
0.10 mol·L-1·V1+0.60 mol·L-1·V2=0.20 mol·L-1·(V1+V2)
解得:V1:V2 =4:1习题导学(1)浓溶液加水稀释后,溶质的物质的量不变:
c(浓)·V(浓)=c(稀)·V(稀)。
(2)同一溶质、不同浓度溶液的混合,溶质为原来各溶液中所含溶质的物质的量之和:c1·V1+c2·V2=c(混)·V(混)。
注意 混合后溶液的体积:
①若指出不考虑溶液体积改变,可认为是原溶液的体积之和;
②若给出混合后溶液的密度,应根据总结感悟二溶液的稀释或混合2.(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为________mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为______mol·L-1;溶质的质量为________g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为__________mol·L-1,SO的物质的量浓度为________mol·L-1。0.20.21.420.20.1活学活用(3)50 mL溶液用水稀释到100 mL,据c(浓)·V(浓)=c(稀)·V(稀),Na2SO4的浓度变为原来的0.5,即0.1 mol·L-1,故Na+浓度为0.2mol·L-1,SO浓度为0.1 mol·L-1。(2)从中取出50 mL溶液,浓度仍为0.2 mol·L-1
溶质的质量为m=n·M=c·V·M=0.2 mol·L-1×0.05 L×142 g·mol-1=1.42 g。活学活用1.市售浓硫酸中溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓硫酸中H2SO4的物质的量浓度。探究点三 物质的量浓度与溶质的质量分数、溶解度之间的相互求算解析:1 000 mL浓硫酸中H2SO4的质量为m(H2SO4)=ρ[H2SO4(aq)]·V[H2SO4(aq)]·w(H2SO4)=1.84 g·cm-3×98%×1 000 mL=1 803.2 g。
1 803.2 g H2SO4的物质的量为n(H2SO4)=18.4 mol。
因为1 000 mL浓硫酸中含18.4 mol H2SO4,所以市售浓硫酸中H2SO4的物质的量浓度为18.4 mol·L-1。 习题导学2.20 ℃,将60 g某固体物质完全溶解于水,配制成200 mL 密度为1.5 g·mL-1的饱和溶液,求20 ℃时该饱和溶液的物质的量浓度(该物质的摩尔质量为M g·mol-1) _________________。习题导学总结感悟三 物质的量浓度与溶质的质量分数、溶解度之间的相互求算活学活用活学活用物质的量浓度与溶质的质量分数、溶解度之间求算题目的解题思路一般有两个出发点:总结感悟1.2.0 g NaOH固体溶于水配成100 mL溶液,溶液中c(Na+)为 ( )
A.0.2 mol·L-1 B.0.3 mol·L-1
C.0.4 mol·L-1 D.0.5 mol·L-1D当堂巩固解析 c(Na+)=2.0 g÷40 g·mol-1÷0.1 L=0.5 mol·L-1。C当堂巩固13.6当堂巩固3.现用98%的浓H2SO4(ρ=1.84 g·cm-3)配制浓度为0.5 mol·L-1的稀硫酸500 mL,则所需浓H2SO4的体积为________ mL。
物质微观
粒子
表示含有一定数目粒子的集合体一箱啤酒一打铅笔一双筷子一盒别针单位是 摩尔、简称摩,符号:mol把微小物质扩大倍数形成一定数目的集体以便于便生活、方便科学研究、方便相互交流 1、是国际单位制七个基本物理量之一2、物质的量的单位是 摩尔、简称摩,符号:mol1 摩尔的标准:1 mol粒子集体所含的粒子数= 0.012 kg12C中所含的碳原子数实践体验:已知一个12C原子的质量为1.993×10-26 kg,问
0.012 kg12C中有多少个碳原子?≈ 6.02×10236.02×1023 符号: NA 单位: mol-1,数值:约为6.02×1023 科学上规定为: 0.012 Kg 12C 中所含的碳原子数规定解释:如果某物质含有与 0.012 Kg 12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。感受阿伏加德罗常数 如果把6.02×1023个直径为2.5cm的硬币排
成一行,可以来回于地球与太阳之间240.8亿次 如果把 6.02×1023 粒米给全球60亿人吃,
每人每天吃一斤,要吃14万年。
(1)摩尔是七个物理量之一。
(2)摩尔是物质的质量单位。
(3) 1摩尔大米含有 6.02×1023个米粒。
(4)1mol氢
错误。物质的量 是七个基本物理量之一 错误。摩尔是物质的量的单位错误。物质的量只适用于微观粒子,不能用来说明
宏观物质错误。没有指出是分子、原子或离子1、说出下列符号的意义:
①2H 、②2molH 、 ③2molH+ 、
④2molH2 、⑤4molFe3+ 、⑥a molSO3 、
2、用符号表示:
2摩尔水分子 、5摩尔硫酸根离子 、
n 摩尔氧原子 、1摩尔碳酸氢根离子 、
10摩尔亚铁离子 、3摩尔氯化氢分子 、
(1)1mol碳原子含有 个碳原子
(2)0.3mol硫酸分子含有 个硫酸分子
(3)10mol钠离子含有 个钠离子
(4)6mol电子含有 个电子
(5)0.5mol中子含有 个中子 1×NA
0.3×NA
10×NA
6×NA
0.5×NA物质的量是表示微粒的集体,可以用分数或小数表示。
物质的量(n)== 微粒数目(N)阿伏加德罗常数(NA) 1 摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子?H2O 11 molNA2HO212NANA1 mol2 mol微粒个数微粒集体物质的量微粒个数1个1个1个物质的量1mol1mol1mol微粒个数物质的量2个1个2个2mol1mol2mol一个比例关系
n1︰n2=N1︰N2
1、下列关于摩尔的说法中,正确的是( )
A.摩尔是一个物理量,含6.02×1023个粒子?
B. 摩尔是国际单位制的七个基本单位之一
C.摩尔既是物质的量的单位,又是粒子的数
量单位
D.摩尔的基准是0.012 Kg 12C中所含的碳原
子数√√ 2、下列关于阿伏加德罗常数的说法正确的是
( )
A.阿伏加德罗常数是一个纯数,没有单位
B.阿伏加德罗常数就是6.02×1023
C.阿伏加德罗常数是指1 mol 的任何粒子的
粒子数
D.阿伏加德罗常数的近似值为:
6.02×1023 mol-1√√3、1mol H2SO4中约含有 个硫酸分子,
个氧原子。4、含3.01×1023个Na+的 Na2SO4中约含 SO42- mol,5、3molNa2CO3·10H2O含有 NA氢原子、
含有 个钠离子和 个碳酸根离子 1molH2O
约含有6.02×1023个水分子,
质量是18g 1molAl
约含有6.02×1023 个铝原子,
质量是27g1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同, 1mol不同物质的质量也不同125698182317实践体验(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。Na的摩尔质量为 、
Na+的摩尔质量为 、
H2SO4的摩尔质量为 、
HNO3的摩尔质量为 、 1molFe的质量是: 、
1molO2的质量是: 、
1molH2SO4的质量是: 、
1molFe2+的质量是: 、(1)定义:(2)定义式:单位物质的量的物质所具有的质量叫摩尔质量。物质的质量、物质的量、摩尔质量之间的关系m(H2SO4)n(H2SO4)=解:M(H2SO4)=98g/molM(H2SO4)49gn(H2SO4)=98g/mol=0.5molN(H2SO4)==0.5mol×6.02×1023/moln(H2SO4)×NA=3.01×1023 2、 19.6 g硫酸是 molH2SO4 ,含有 个硫酸分子,其中含有 molH,计 个氢原子,含有 molO ,计 个氧原子 。
1、请计算:
A、24.5克H2SO4的物质的量是 、
B、11克CO2的物质的量是 、
C、2.5molNa2CO3的质量是 、
D、1.5molH2O的质量是 、一、物质的量(n):表示含有一定数目粒子的集合体二、阿伏加德罗常数:1 mol 任何粒子的粒子数。三、摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量导入1、如何定量的表示溶液的浓和稀?学过哪种方法?
如:将20gNaCl溶于80gH2O中得到NaCl溶液,则该溶液中NaCl的质量分数为?
2、很多反应都是在溶液中进行,如:在溶液中反应时,通常不称其质量,而是量它的体积V;同时,在化学反应中,反应物与生成物的物质的量n之间存在一定的关系——系数之比=物质的量之比。2 1 1 22mol 1 mol 1mol 2mol系数物质的量nn?V一、物质的量浓度1、定义:单位体积溶液中所含溶质B的物质的量——CB2、符号: CB3、公式:4、单位:mol ·L-1 或 mol/L物质的量n微粒数N NANAMM质量m气体体积V Vm物质的量浓度CB×V(1)、nB:溶质B的物质的量溶液(2)、V: 溶液的体积V溶液除特殊说明体积可相加,其它用(a)(b)溶液判断正误:
a.将58.5gNaCl溶于H2O得到 1L NaCl溶液,则CNaCl= 1.0 mol/L
b.将58.5gNaCl溶于 1L H2O得到NaCl溶液,则CNaCl= 1.0 mol/L溶液例.标况下,1L水中溶解了336LHCl气体,得到密度为1.17g/cm3的盐酸,求所得盐酸的物质的量浓度CHCl?解析:溶液例.在4℃时,100mL水中溶解了22.4LHCl气体(标况下)后形成溶液,下列说法正确是( )
A.该溶液的物质的量浓度为10.0mol/L
B.该溶液物质的量因溶液的密度未知而无法求得
C.该溶液的质量分数因溶液的密度未知而无法求得
D.所得溶液体积为22.5L溶液例.将4gNaOH溶于H2O中得到500mL溶液,求CNaOH?
例.欲得到1000mL 0.1mol/LNaOH溶液,需要NaOH的质量是多少?
例.
VLNa2SO4溶液中含Na+的物质的量浓度为1.00mol/L,求SO42-的物质的量浓度?VL硫酸铁溶液中含Fe3+mg,则SO42-的物质的量浓度为( )
A. B. C. D.5、CB与ω的关系例 已知浓盐酸的物质的量浓度为11.8mol/L,密度为1.18g/cm3,求浓盐酸的质量分数?物质的量浓度的有关计算物质的量浓度计算1.基本量的换算2.溶液中溶质微粒数目的计算3.质量分数与物质的量浓度的换算4.溶液稀释与浓缩5.两种不同浓度溶液混合6.化学反应中计算请大家计算一下下列各溶质的物质的量浓度:0.520.20.510.051.基本量的换算2.溶液中溶质微粒数目的计算 例: 2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。 22.408×10241.204×1024 3.溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)1000 ω ρ注:密度的单位是g/cm3
ω 是溶液的质量分数
M 是溶质的摩尔质量
例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
答:该硝酸中HNO3的物质的量浓度为22.4mol/L解:根据解题思路可得:
C=------------------ = ---------------------
1000 ω ρM631000× 94% ×1.5=22.4mol/L例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:根据解题思路可得:
C=---------------------- ω=--------------------
答:该溶液溶质的质量分数为7.4%M
1000 ω ρ1000ρ
C M=----------------------×100%1000×1.082×40=7.4%
4.溶液稀释与浓缩结论:浓溶液配制稀溶液前后溶质的量不变
思路:稀释溶液前后溶质的物质的量相等 C1V1= C2V2 例:将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
例:配制500mL1 mol/L的H2SO4溶液,需要密度为1.8g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5×1=V×1.8×98%÷98解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L5.两种不同浓度溶液混合 思路:C3V3 = C1V1+C2V2(混合前后溶质的物质的量总和不变)规律1:密度大于水的溶液,溶液的质量分数越大,密度越大,溶质物质的量浓度就越大,如盐酸、硫酸、氢氧化钠溶液。反之亦然。
规律2:同种溶质两种不同浓度的溶液混合 [溶质的质量分数分别为 a%、b%,混合溶液的密度为ρg/ml ]
(1)等质量混合后的质量分数为:(a%+b% ) /2,物质的量浓度为:1000 ρ(a%+b% ) /2∕M
(2)等体积混合(大大小小)
若ρ>1 g/mL,混合后的质量分数大于(a%+b% ) /2, ,物质的量浓度大于1000 ρ(a%+b% ) /2 ∕ M 如硫酸、硝酸溶液.
若ρ<1g/mL,混合后的质量分数小于 (a%+b% ) /2,物质的量浓度小于1000 ρ(a%+b% ) /2 ∕ M 如氨水、乙醇溶液.6.化学反应中计算例:中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
解: 2NaOH~~~~H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L1.物质的量浓度的概念表达式(计算公式)cB=n/V,其中V 表示__________的体积。
2.判断正误,正确的划“√”,错误的划“×”
(1)1 mol NaCl溶于1 L水所得溶液的物质的量浓度是1 mol·L-1 ( )
(2)将25 g CuSO4·5H2O溶解在1 L水中,所得溶液的物质的量浓度为0.1 mol·L-1 ( )
(3)把1 mol NH3通入水中得到1 L溶液,其物质的量浓度为1 mol·L-1 ( )
(4)将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1 ( )溶液× × √ 温故知新0.0011.游泳池里的水一般常加适量的CuSO4,用以杀灭其中的细菌,而对游泳者的身体无害。现取一水样300 mL,经分析其中含有0.019 2 g Cu2+,则水样中CuSO4的物质的量浓度为______mol·L-1。探究点一 溶质物质的量浓度的求算习题导学2.V L Fe2(SO4)3溶液中含Fe3+ m g,则该溶液中Fe3+的物质的量浓度为________mol·L-1,SO的物质的量浓度为________mol·L-1,溶质的物质的量浓度为________mol·L-1。习题导学体积(L) 计算溶质的物质的量浓度的基本依据是其概念,数学表达式为 。关键是从已知条件中找出溶质的 和溶液的 ,据此求出溶质的物质的量浓度cB。物质的量(mol)总结感悟一 溶质物质的量浓度的求算1.用1 L水吸收560 L氨气(标准状况),所得氨水的密度是0.90 g·mL-1。求:
(1)氨气的物质的量是__________。
(2)所得氨水溶液的物质的量浓度是__________。活学活用总结感悟1.从1 L 1 mol·L-1 NaOH溶液中取出100 mL
(1)取出的这100 mL NaOH溶液的物质的量浓度是______________,含NaOH的质量是______。
(2)若将取出的这100 mL NaOH溶液加水稀释至500 mL,所得溶液的物质的量浓度是_________________。4 g 探究点二 溶液的稀释或混合解析 (1)mB=0.1 L×1 mol·L-1×40 g·mol-1=4 g。习题导学2.欲将0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求两种溶液的体积比(忽略混合时溶液体积变化)。解析:设所需0.10 mol·L-1的NaOH溶液及所需0.60 mol·L-1的NaOH溶液的体积分别是V1和V2,根据混合前后溶质的物质的量不变列式得:
0.10 mol·L-1·V1+0.60 mol·L-1·V2=0.20 mol·L-1·(V1+V2)
解得:V1:V2 =4:1习题导学(1)浓溶液加水稀释后,溶质的物质的量不变:
c(浓)·V(浓)=c(稀)·V(稀)。
(2)同一溶质、不同浓度溶液的混合,溶质为原来各溶液中所含溶质的物质的量之和:c1·V1+c2·V2=c(混)·V(混)。
注意 混合后溶液的体积:
①若指出不考虑溶液体积改变,可认为是原溶液的体积之和;
②若给出混合后溶液的密度,应根据总结感悟二溶液的稀释或混合2.(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为________mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为______mol·L-1;溶质的质量为________g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为__________mol·L-1,SO的物质的量浓度为________mol·L-1。0.20.21.420.20.1活学活用(3)50 mL溶液用水稀释到100 mL,据c(浓)·V(浓)=c(稀)·V(稀),Na2SO4的浓度变为原来的0.5,即0.1 mol·L-1,故Na+浓度为0.2mol·L-1,SO浓度为0.1 mol·L-1。(2)从中取出50 mL溶液,浓度仍为0.2 mol·L-1
溶质的质量为m=n·M=c·V·M=0.2 mol·L-1×0.05 L×142 g·mol-1=1.42 g。活学活用1.市售浓硫酸中溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓硫酸中H2SO4的物质的量浓度。探究点三 物质的量浓度与溶质的质量分数、溶解度之间的相互求算解析:1 000 mL浓硫酸中H2SO4的质量为m(H2SO4)=ρ[H2SO4(aq)]·V[H2SO4(aq)]·w(H2SO4)=1.84 g·cm-3×98%×1 000 mL=1 803.2 g。
1 803.2 g H2SO4的物质的量为n(H2SO4)=18.4 mol。
因为1 000 mL浓硫酸中含18.4 mol H2SO4,所以市售浓硫酸中H2SO4的物质的量浓度为18.4 mol·L-1。 习题导学2.20 ℃,将60 g某固体物质完全溶解于水,配制成200 mL 密度为1.5 g·mL-1的饱和溶液,求20 ℃时该饱和溶液的物质的量浓度(该物质的摩尔质量为M g·mol-1) _________________。习题导学总结感悟三 物质的量浓度与溶质的质量分数、溶解度之间的相互求算活学活用活学活用物质的量浓度与溶质的质量分数、溶解度之间求算题目的解题思路一般有两个出发点:总结感悟1.2.0 g NaOH固体溶于水配成100 mL溶液,溶液中c(Na+)为 ( )
A.0.2 mol·L-1 B.0.3 mol·L-1
C.0.4 mol·L-1 D.0.5 mol·L-1D当堂巩固解析 c(Na+)=2.0 g÷40 g·mol-1÷0.1 L=0.5 mol·L-1。C自我·检测区当堂巩固13.6当堂巩固3.现用98%的浓H2SO4(ρ=1.84 g·cm-3)配制浓度为0.5 mol·L-1的稀硫酸500 mL,则所需浓H2SO4的体积为________ mL。物质的量浓度的有关计算物质的量浓度计算1.基本量的换算2.溶液中溶质微粒数目的计算3.质量分数与物质的量浓度的换算4.溶液稀释与浓缩5.两种不同浓度溶液混合6.化学反应中计算请大家计算一下下列各溶质的物质的量浓度:0.520.20.510.051.基本量的换算2.溶液中溶质微粒数目的计算 例: 2L 1mol/L的H2SO4溶液,含溶质的物质的量为 mol,含H+ 个,SO42- 个。 22.408×10241.204×1024 3.溶质的质量分数与物质的量浓度的换算
摩尔质量(g/mol) 密度(g/mL)1000 ω ρ注:密度的单位是g/cm3
ω 是溶液的质量分数
M 是溶质的摩尔质量
例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L思路:C = n / V 例:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。
答:该硝酸中HNO3的物质的量浓度为22.4mol/L解:根据解题思路可得:
C=------------------ = ---------------------
1000 ω ρM631000× 94% ×1.5=22.4mol/L例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:设有1L NaOH溶液,则m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
答:该溶液溶质的质量分数为7.4%思路: ω = m B /m(aq ) 例:2mol/LNaOH溶液(ρ=1.08g/cm3) 的溶质的质量分数为:解:根据解题思路可得:
C=---------------------- ω=---------------------
答:该溶液溶质的质量分数为7.4%M
1000 ω ρ1000ρ
C M=----------------------×100%1000×1.082×40=7.4%
4.溶液稀释与浓缩结论:浓溶液配制稀溶液前后溶质的量不变
思路:稀释溶液前后溶质的物质的量相等 C1V1= C2V2 例:将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为多少毫升?
例:配制500mL1 mol/L的H2SO4溶液,需要密度为1.8g/mL的浓硫酸(98%硫酸)多少毫升?
解: 0.5×1=V×1.8×98%÷98解:10mL×2mol/L=V[H2SO4(aq)]×0.5mol/L5.两种不同浓度溶液混合 思路:C3V3 = C1V1+C2V2(混合前后溶质的物质的量总和不变)规律1:密度大于水的溶液,溶液的质量分数越大,密度越大,溶质物质的量浓度就越大,如盐酸、硫酸、氢氧化钠溶液。反之亦然。
规律2:同种溶质两种不同浓度的溶液混合 [溶质的质量分数分别为 a%、b%,混合溶液的密度为ρg/ml ]
(1)等质量混合后的质量分数为:(a%+b% ) /2,物质的量浓度为:1000 ρ(a%+b% ) /2∕M
(2)等体积混合(大大小小)
若ρ>1 g/mL,混合后的质量分数大于(a%+b% ) /2, ,物质的量浓度大于1000 ρ(a%+b% ) /2 ∕ M 如硫酸、硝酸溶液.
若ρ<1g/mL,混合后的质量分数小于 (a%+b% ) /2,物质的量浓度小于1000 ρ(a%+b% ) /2 ∕ M 如氨水、乙醇溶液.6.化学反应中计算例:中和1升0.5 mol/LNaOH溶液,需要多少升 1mol/LH2SO4溶液?
解: 2NaOH~~~~H2SO4
2mol 1mol
1L×0.5mol/L V[H2SO4(aq)]×1mol/L1.物质的量浓度的概念表达式(计算公式)cB=n/V,其中V 表示__________的体积。
2.判断正误,正确的划“√”,错误的划“×”
(1)1 mol NaCl溶于1 L水所得溶液的物质的量浓度是1 mol·L-1 ( )
(2)将25 g CuSO4·5H2O溶解在1 L水中,所得溶液的物质的量浓度为0.1 mol·L-1 ( )
(3)把1 mol NH3通入水中得到1 L溶液,其物质的量浓度为1 mol·L-1 ( )
(4)将10 g CaCO3粉末加水配成100 mL溶液,CaCO3的物质的量浓度为1 mol·L-1 ( )溶液× × √ 温故知新0.0011.游泳池里的水一般常加适量的CuSO4,用以杀灭其中的细菌,而对游泳者的身体无害。现取一水样300 mL,经分析其中含有0.019 2 g Cu2+,则水样中CuSO4的物质的量浓度为______mol·L-1。探究点一 溶质物质的量浓度的求算习题导学2.V L Fe2(SO4)3溶液中含Fe3+ m g,则该溶液中Fe3+的物质的量浓度为________mol·L-1,SO的物质的量浓度为________mol·L-1,溶质的物质的量浓度为________mol·L-1。习题导学体积(L) 计算溶质的物质的量浓度的基本依据是其概念,数学表达式为 。关键是从已知条件中找出溶质的 和溶液的 ,据此求出溶质的物质的量浓度cB。物质的量(mol)总结感悟一 溶质物质的量浓度的求算1.用1 L水吸收560 L氨气(标准状况),所得氨水的密度是0.90 g·mL-1。求:
(1)氨气的物质的量是__________。
(2)所得氨水溶液的物质的量浓度是__________。活学活用总结感悟1.从1 L 1 mol·L-1 NaOH溶液中取出100 mL
(1)取出的这100 mL NaOH溶液的物质的量浓度是______________,含NaOH的质量是______。
(2)若将取出的这100 mL NaOH溶液加水稀释至500 mL,所得溶液的物质的量浓度是_________________。4 g 探究点二 溶液的稀释或混合解析 (1)mB=0.1 L×1 mol·L-1×40 g·mol-1=4 g。习题导学2.欲将0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求两种溶液的体积比(忽略混合时溶液体积变化)。解析:设所需0.10 mol·L-1的NaOH溶液及所需0.60 mol·L-1的NaOH溶液的体积分别是V1和V2,根据混合前后溶质的物质的量不变列式得:
0.10 mol·L-1·V1+0.60 mol·L-1·V2=0.20 mol·L-1·(V1+V2)
解得:V1:V2 =4:1习题导学(1)浓溶液加水稀释后,溶质的物质的量不变:
c(浓)·V(浓)=c(稀)·V(稀)。
(2)同一溶质、不同浓度溶液的混合,溶质为原来各溶液中所含溶质的物质的量之和:c1·V1+c2·V2=c(混)·V(混)。
注意 混合后溶液的体积:
①若指出不考虑溶液体积改变,可认为是原溶液的体积之和;
②若给出混合后溶液的密度,应根据总结感悟二溶液的稀释或混合2.(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为________mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为______mol·L-1;溶质的质量为________g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为__________mol·L-1,SO的物质的量浓度为________mol·L-1。0.20.21.420.20.1活学活用(3)50 mL溶液用水稀释到100 mL,据c(浓)·V(浓)=c(稀)·V(稀),Na2SO4的浓度变为原来的0.5,即0.1 mol·L-1,故Na+浓度为0.2mol·L-1,SO浓度为0.1 mol·L-1。(2)从中取出50 mL溶液,浓度仍为0.2 mol·L-1
溶质的质量为m=n·M=c·V·M=0.2 mol·L-1×0.05 L×142 g·mol-1=1.42 g。活学活用1.市售浓硫酸中溶质的质量分数为98%,密度为1.84 g·cm-3。计算市售浓硫酸中H2SO4的物质的量浓度。探究点三 物质的量浓度与溶质的质量分数、溶解度之间的相互求算解析:1 000 mL浓硫酸中H2SO4的质量为m(H2SO4)=ρ[H2SO4(aq)]·V[H2SO4(aq)]·w(H2SO4)=1.84 g·cm-3×98%×1 000 mL=1 803.2 g。
1 803.2 g H2SO4的物质的量为n(H2SO4)=18.4 mol。
因为1 000 mL浓硫酸中含18.4 mol H2SO4,所以市售浓硫酸中H2SO4的物质的量浓度为18.4 mol·L-1。 习题导学2.20 ℃,将60 g某固体物质完全溶解于水,配制成200 mL 密度为1.5 g·mL-1的饱和溶液,求20 ℃时该饱和溶液的物质的量浓度(该物质的摩尔质量为M g·mol-1) _________________。习题导学总结感悟三 物质的量浓度与溶质的质量分数、溶解度之间的相互求算活学活用活学活用物质的量浓度与溶质的质量分数、溶解度之间求算题目的解题思路一般有两个出发点:总结感悟1.2.0 g NaOH固体溶于水配成100 mL溶液,溶液中c(Na+)为 ( )
A.0.2 mol·L-1 B.0.3 mol·L-1
C.0.4 mol·L-1 D.0.5 mol·L-1D当堂巩固解析 c(Na+)=2.0 g÷40 g·mol-1÷0.1 L=0.5 mol·L-1。C当堂巩固13.6当堂巩固3.现用98%的浓H2SO4(ρ=1.84 g·cm-3)配制浓度为0.5 mol·L-1的稀硫酸500 mL,则所需浓H2SO4的体积为________ mL。
