2016河南省第十三届化学优质课高中组课件-人教版选修四 《化学反应原理》原电池 (共19张PPT)
文档属性
| 名称 | 2016河南省第十三届化学优质课高中组课件-人教版选修四 《化学反应原理》原电池 (共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 11.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-28 00:00:00 | ||
图片预览






文档简介
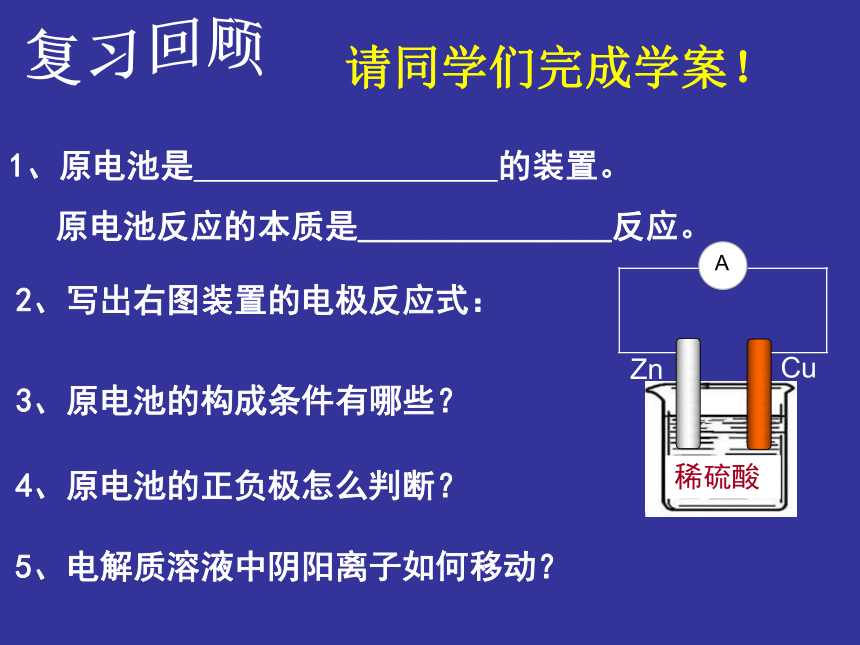
课件19张PPT。原电池 普通高中课程标准实验教科书 化学 选修四 《化学反应原理》 1、通过设计、再探简单原电池,加深学生对必修二原电池工作原理的再认识。 2、采用“实验—问题”的探究方法,师生共研原电池的优化与设计。3、通过本节学习,认识离子交换膜。【学习目标】 4、体会化学学科对个人生活和社会发展的贡献,关注环保问题,形成正确的环保观。 复习回顾3、原电池的构成条件有哪些?4、原电池的正负极怎么判断?5、电解质溶液中阴阳离子如何移动?请同学们完成学案!1、原电池是 的装置。原电池反应的本质是_______________反应。2、写出右图装置的电极反应式:3、原电池的构成条件有哪些?4、原电池的正负极怎么判断?5、电解质溶液中阴阳离子如何移动?请同学们核对答案!1、原电池是 将化学能转化为电能 的装置。原电池反应的本质是 氧化还原 反应。2、写出右图装置的电极反应式和总反应式:负极 Zn:Zn- 2e-=Zn2+正极 Cu: 2H++2e-=H2↑
两极一液一导线 氧化还原是中心 活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;
不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
阴离子移向负极 阳离子移向正极总反应式: Zn+2H+= Zn2++H2↑
实验一 再探单液电池 温馨提示
1、观察实验现象,并如实记录;
2、 注意合作分工,讲究效率。 请根据反应: Zn + CuSO4 = ZnSO4 + Cu, 设计一个原电池,并进行实验。 学生活动1预期现象:Zn片溶解 Cu片上有Cu析出
电流表指针发生偏转负极 Zn: Zn - 2e-=Zn2+(氧化反应)正极 Cu: Cu2++2e-=Cu (还原反应)为什么两个电极上均有铜析出?交流与研讨实验二 双液—盐桥电池琼胶是含水丰富的一种冻胶,离子在其中既可以运动,又能够起到固定作用。含饱和KCl溶液的琼胶
盐桥的作用?(1)形成闭合回路,代替两溶液直接接触。(2)平衡电荷,保持溶液呈电中性。交流与研讨盐桥电池的优点有哪些? 1、能产生持续、稳定的电流; 2、能量转化率高; 3、防止自放电。 化合价降低 得2e-负极:Cu – 2e- = Cu2+正极:2Fe3++2e- = 2Fe2+ 利用Cu+2Fe3+ = Cu2++2Fe2+,设计一个
带盐桥的电池。 化合价升高 失2e-电极材料:负极: Cu
正极 :C电解质溶液:Cu+2FeCl3 = CuCl2+ 2FeCl2学生活动2如何设计盐桥电池?离子交换膜简介 离子交换膜是一种含离子基团的、对溶液里的离子具有选择透过能力的高分子膜。实验三 盐桥变膜-离子交换膜电池阴离子交换膜离子交换膜电池离子交换膜电池装置“只有蓝天、没有雾霾”单液电池盐桥电池离子交换膜
电池?小结…练习巩固 利用Cu+2Ag+ = Cu2++2Ag反应,设计一个能产生持续、稳定电流的原电池装置,写出电极反应式,画出装置图并标出电子和离子移动方向。负极:Cu – 2e- = Cu2+正极:2Ag++2e- = 2Ag 2、收集资料,制作PPT 电池的发展史。 作业1、课本P73课后题。 3、回家搜集废干电池并拆开,弄清它 的构造及原理(如何防止污染)。欢迎各位专家、同行批评指导!谢谢大家!
两极一液一导线 氧化还原是中心 活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;
不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
阴离子移向负极 阳离子移向正极总反应式: Zn+2H+= Zn2++H2↑
实验一 再探单液电池 温馨提示
1、观察实验现象,并如实记录;
2、 注意合作分工,讲究效率。 请根据反应: Zn + CuSO4 = ZnSO4 + Cu, 设计一个原电池,并进行实验。 学生活动1预期现象:Zn片溶解 Cu片上有Cu析出
电流表指针发生偏转负极 Zn: Zn - 2e-=Zn2+(氧化反应)正极 Cu: Cu2++2e-=Cu (还原反应)为什么两个电极上均有铜析出?交流与研讨实验二 双液—盐桥电池琼胶是含水丰富的一种冻胶,离子在其中既可以运动,又能够起到固定作用。含饱和KCl溶液的琼胶
盐桥的作用?(1)形成闭合回路,代替两溶液直接接触。(2)平衡电荷,保持溶液呈电中性。交流与研讨盐桥电池的优点有哪些? 1、能产生持续、稳定的电流; 2、能量转化率高; 3、防止自放电。 化合价降低 得2e-负极:Cu – 2e- = Cu2+正极:2Fe3++2e- = 2Fe2+ 利用Cu+2Fe3+ = Cu2++2Fe2+,设计一个
带盐桥的电池。 化合价升高 失2e-电极材料:负极: Cu
正极 :C电解质溶液:Cu+2FeCl3 = CuCl2+ 2FeCl2学生活动2如何设计盐桥电池?离子交换膜简介 离子交换膜是一种含离子基团的、对溶液里的离子具有选择透过能力的高分子膜。实验三 盐桥变膜-离子交换膜电池阴离子交换膜离子交换膜电池离子交换膜电池装置“只有蓝天、没有雾霾”单液电池盐桥电池离子交换膜
电池?小结…练习巩固 利用Cu+2Ag+ = Cu2++2Ag反应,设计一个能产生持续、稳定电流的原电池装置,写出电极反应式,画出装置图并标出电子和离子移动方向。负极:Cu – 2e- = Cu2+正极:2Ag++2e- = 2Ag 2、收集资料,制作PPT 电池的发展史。 作业1、课本P73课后题。 3、回家搜集废干电池并拆开,弄清它 的构造及原理(如何防止污染)。欢迎各位专家、同行批评指导!谢谢大家!
