江苏省无锡市2015-2016学年高一(下)期末化学试卷(解析版)
文档属性
| 名称 | 江苏省无锡市2015-2016学年高一(下)期末化学试卷(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 175.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-29 13:53:23 | ||
图片预览




文档简介
2015-2016学年江苏省无锡市高一(下)期末化学试卷
一、单项选择题:本题包括14小题,毎小题3分,共42分.每小题只有一个选项符合题意
1.下列不属于低碳经济的是( )
A.太阳能发电
B.火力发电
C.推广节能灯
D.发展核电
2.下列属于高分子化合物且在自然界中原来并不存在的是( )
A.淀粉
B.蛋白质
C.纤维素
D.聚乙烯
3.化学与生活密切相关,下列说法正确的是( )
A.聚乙烯塑料的老化是由于发生了加成反应
B.煤经过气化和液化等物理变化可以转化为清洁燃料
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
4.下图各容器中均盛有稀盐酸,能形成原电池且铁为正极的是( )
A.
B.
C.
D.
5.下列物质的分子中,不含共价键的是( )
A.NaCl
B.Cl2
C.HCl
D.NaOH
6.常温下,1mol某气态烃CxHy完全燃烧需要氧气5mol,则x与y之和可能是( )
A.x+y=5
B.x+y=7
C.x+y=11
D.x+y=13
7.下列微粒中:①13Al3+;②;③;④O2﹣,其核外电子数相同的是( )
A.①②③
B.②③④
C.①②④
D.①③④
8.已知:4P(红磷,S)═P4(白磷,s)△H=+17kJ moL﹣1,则下列推论正确的是( )
A.当1
mol白磷完全转变成红磷时放出17kJ热量
B.正反应是一个放热反应
C.当4g红磷转变成白磷时吸收I7k
J热量
D.白磷比红磷稳定
9.下列说法正确的是( )
A.乙醇分子中的氢原子均可被钠置换
B.乙醇能与钠反应放出氢气,说明乙醉能电离出H+而表现酸性
C.乙醇分子羟基中的氢原子比乙烷分子中的氢原子活泼
D.乙醇分子羟基中的氢原子比水分子中的氢原子活泼
10.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应
②充分燃烧的产物不污染环境
③乙醇是一种可再生能源
④燃烧时放出大量热量.
A.①②③
B.①②④
C.①③④
D.②③④
11.已知原子序数,可以推断原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数 ⑥原子结构示意图 ⑦元素在周期表中的位置.
A.①②③④⑥
B.①④⑤⑥⑦
C.②③④⑤⑦
D.③④⑤⑥⑦
12.锗(Ge)是第4周期ⅣA族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是( )
A.锗是一种金属性很强的元素
B.锗酸(H4GeO4)是难溶于水的强酸
C.锗化氢(GeH4)稳定性很强
D.锗的单质具有半导体的性能
13.下列有关氰酸铵(NH4CNO)与尿素[CO(NH2)2]的说法正确的是( )
A.都是共价化合物
B.都是离子化合物
C.互为同分异构体
D.互为同系物
14.下列关于有机物的说法中不正确的是( )
A.正丁烷和异丁烷的熔、沸点不相同
B.乙烯、苯、乙酸分子中的所有原子都在同一平面上
C.C4H9Br的同分异构体有4种
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
二、不定项选择题:本题包括6小题,毎小题4分,共24分.每小题只有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分
15.生活中常常涉及到一些有机化合物的知识.下列叙述中正确的是( )
A.将米饭在嘴中多加咀嚼就会变甜
B.羊毛和棉花的主要成分都是纤维素
C.为提高加酶洗衣粉的去污能力,应使用热水进行洗涤
D.未成熟的苹果遇碘水会变蓝,是因为其中含有淀粉
16.下列有机物的命名正确的是( )
A.
B.(CH3)2CHCH3
甲基丙烷
C.
D.
17.在l01kPa时燃烧1t含FeS2质量分数为70%的黄铁矿(杂质不参加反应)生成固态Fe2O3和气
态SO2,放出4.98×106kJ的热量.表示上述反应的热化学方程式正确的是( )
A.4FeS2(
s)+11O2(
g)═2Fe2O3(
s)+8SO2(g)△H=﹣3414.8kJ moL
B.FeS2(s)+O2(g)═Fe2O3
(s)+2SO2(g)△H=﹣853.7kJ moL
C.4FeS2(s)+11O2(g)═2
Fe2O3
(s)+8SO2(g)△H+3414.8kJ moL
D.FeS2(s)+O2(g)═Fe2O3
(s)+2SO2(g)△H=+853.7kJ moL
18.在l℃时,10mL0.4mol L﹣1H2O2溶液发生催化分解:2H2O2
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min
0
2
4
6
V(
02
)/mL
0.0
9.9
17.2
22.4
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0﹣2min的平均反应速率比4﹣6min快
B.0﹣6min
的平均反应速率v(
H2O2)=3.3
x
10﹣2
moL﹣1 min﹣1
C.反应至
6min
时,c(
H2O2)=0.3mol L﹣1
D.反应至6min时,H2O2分解了
50%
19.下列实验能获得成功的是( )
A.用溴水可鉴别苯、乙醇、苯乙烯
B.加浓溴水,然后过滤可除去苯中的少量乙烯
C.用酸性KMnO4溶液可除去甲烷中的乙烯
D.用新制的Cu(OH)2悬浊液可鉴别乙醇、乙醛、乙酸
20.近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(a﹣羟基丁二酸)是这种饮料中的主要酸性物质,苹果酸的结构简式为:下列说法不正确的是( )
A.苹果酸在一定条件下能与乙醇发生反应
B.苹果酸在一定条件下能发生催化氧化反应
C.苹果酸在一定条件下能与乙酸发生反应
D.1mol苹果酸与Na2CO3溶液反应最多消耗3mol
Na2CO3
三、解答题(共4小题,满分54分)
21.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
(2)元素③、⑦、⑧中,原子半径从大到小的顺序是 (用元素符号表示).
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为 .
(4)元素④与元素⑧形成的化合物的电子式为 .
(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是 .(填酸的化学式).
(6)⑤⑥两元素相比较,金属性较强的是
(填名称),可以验证该结论的实验是 (填字母).
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性.
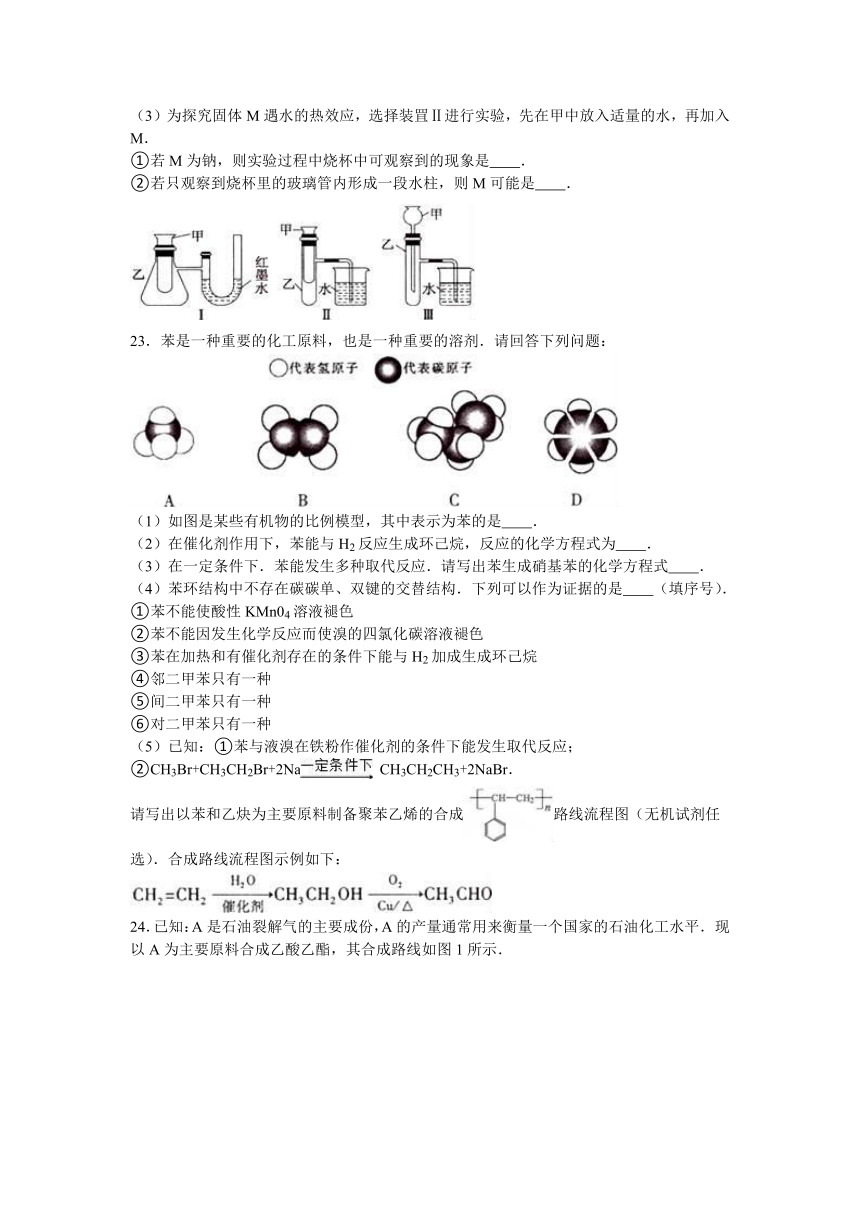
22.为了探究化学能与热能的转化,某实验小组设计了如下图所示三套实验装置:
(1)图示3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是 .
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里先加入适量氢氧化钡溶再加入稀硫酸,U形管中可观察到的现象 ,说明该反应属于 (填‘吸热”或“放热”)反应.
(3)为探究固体M遇水的热效应,选择装罝Ⅱ进行实验,先在甲中放入适量的水,再加入M.
①若M为钠,则实验过程中烧杯中可观察到的现象是 .
②若只观察到烧杯里的玻璃管内形成一段水柱,则M可能是 .
23.苯是一种重要的化工原料,也是一种重要的溶剂.请回答下列问题:
(1)如图是某些有机物的比例模型,其中表示为苯的是 .
(2)在催化剂作用下,苯能与H2反应生成环己烷,反应的化学方程式为 .
(3)在一定条件下.苯能发生多种取代反应.请写出苯生成硝基苯的化学方程式 .
(4)苯环结构中不存在碳碳单、双键的交替结构.下列可以作为证据的是 (填序号).
①苯不能使酸性KMn04溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环己烷
④邻二甲苯只有一种
⑤间二甲苯只有一种
⑥对二甲苯只有一种
(5)已知:①苯与液溴在铁粉作催化剂的条件下能发生取代反应;
②CH3Br+CH3CH2Br+2Na
CH3CH2CH3+2NaBr.
请写出以苯和乙炔为主要原料制备聚苯乙烯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
24.已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
(1)有机物D中官能团的名称为 ,①、④的反应类型分别为 、 .
(2)反应④的化学方程式为 .
(3)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图2的装罝制备乙酸乙酯.
①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: .
②试管Ⅱ中加入的试剂是饱和Na2CO3溶液,其作用是: .
③为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用该装置进行了以下4
个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ,再测其中有机层的厚度,实验记录如下:
实验编号
试管I中试剂
试管Ⅱ中有机层的厚度/cm
A
3mL乙醇、2mL乙酸、2mL
18mol L﹣1浓硫酸
3.0
B
3mL乙醇、2mL乙酸
0.1
C
3mL
乙醇、2mL
乙酸
2mL3mol L﹣1H2SO4
0.6
D
3mL乙醇、2mL乙酸、盐酸
0.6
实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,则进行实验D时应加入
mL mol L﹣1的盐酸.分析实验A和实验C的数据,可以推断出浓H2SO4的 (填“催化”或“吸水”)作用提高了乙酸乙酯的产率.
(4)乙醇在一定条件下可转化为有机物E,E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧.求E的化学式 (需写出计算过程).
2015-2016学年江苏省无锡市高一(下)期末化学试卷
参考答案与试题解析
一、单项选择题:本题包括14小题,毎小题3分,共42分.每小题只有一个选项符合题意
1.下列不属于低碳经济的是( )
A.太阳能发电
B.火力发电
C.推广节能灯
D.发展核电
【考点】使用化石燃料的利弊及新能源的开发.
【分析】“低碳经济”指的是生活作息时所耗用的能量要尽量减少,特别是减少二氧化碳的排放量,减缓生态恶化;可以从节电、节能和回收等环节来改变生活细节,据此进行分析判断即可.
【解答】解:A.太阳能是清洁能源,能减少二氧化碳的排放,故A错误;
B.火力发电用煤做燃料,加大二氧化碳的排放,不属于低碳经济,故B正确;
C.推广节能灯,能节约用电,能减少二氧化碳的排放,故C错误;
D.核电是清洁能源,能减少二氧化碳的排放,故D错误.
故选B.
2.下列属于高分子化合物且在自然界中原来并不存在的是( )
A.淀粉
B.蛋白质
C.纤维素
D.聚乙烯
【考点】有机高分子化合物的结构和性质.
【分析】高分子化合物(又称高聚物)一般相对分子质量高于10000,结构中有重复的结构单元;有机高分子化合物可以分为天然有机高分子化合物(如淀粉、纤维素、蛋白质天然橡胶等)和合成有机高分子化合物(如聚乙烯、聚氯乙烯等).
【解答】解:A.淀粉的相对分子质量在10000以上,为天然高分子化合物,故A错误;
B.蛋白质的相对分子质量在10000以上,为天然高分子化合物,故B错误;
C.纤维素的相对分子质量在10000以上,为天然高分子化合物,故C错误;
D.聚乙烯的相对分子质量在10000以上,为合成有机高分子化合物,故D正确.
故选D.
3.化学与生活密切相关,下列说法正确的是( )
A.聚乙烯塑料的老化是由于发生了加成反应
B.煤经过气化和液化等物理变化可以转化为清洁燃料
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
【考点】塑料的老化和降解;煤的干馏和综合利用;乙醇的工业制法;有机高分子化合物的结构和性质.
【分析】A.聚乙烯塑料是乙烯发生加成反应生成的高分子聚合物,聚乙烯的单体是乙烯;
B.煤的气化、液化都是化学变化;
C.碳纤维是碳的单质;
D.淀粉→葡萄糖→乙醇都是化学变化;
【解答】解:A.乙烯含碳碳双键其中1根键断裂,相互加成生成聚乙烯,聚乙烯中不存在双键,聚乙烯塑料的老化是由于长链断裂等原因,故A错误;
B.煤的气化是煤在氧气不足的条件下进行部分氧化形成H2、CO等气体的过程,煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品的过程,所以煤经过气化和液化等变化是化学变化,故B错误;
C.合成纤维、人造纤维都属于有机高分子材料,碳纤维是碳的单质,不属于有机高分子材料,故C错误;
D.用粮食酿酒时,先在糖化酶作用下水解为葡萄糖,然后在酵母作用下转变为酒精,都是化学变化,故D正确;故选D.
4.下图各容器中均盛有稀盐酸,能形成原电池且铁为正极的是( )
A.
B.
C.
D.
【考点】原电池和电解池的工作原理.
【分析】盐酸为电解质溶液,Fe为正极,各装置中另一种为负极,另一种金属的活泼性比铁强,还必须形成闭合回路,据此进行解答.
【解答】解:A.该装置中Al的活泼性大于Fe,铝为负极,Fe为正极,满足条件,故A正确;
B.该装置形成了原电池,铁为负极,不满足条件,故B错误;
C.该原电池中铁为负极,不满足条件,故C错误;
D.该装置没有形成闭合回路,没有构成原电池,故D错误;
故选A.
5.下列物质的分子中,不含共价键的是( )
A.NaCl
B.Cl2
C.HCl
D.NaOH
【考点】化学键.
【分析】一般来说,非金属元素之间形成共价键,活泼金属元素与非金属元素形成离子键,以此来解答.
【解答】解:A.NaCl中只含离子键,故A选;
B.Cl2中,只含共价键,故B不选;
C.HCl中,只含共价键,故C不选;
D.NaOH中,含离子键和H﹣O共价键,故D不选;
故选A.
6.常温下,1mol某气态烃CxHy完全燃烧需要氧气5mol,则x与y之和可能是( )
A.x+y=5
B.x+y=7
C.x+y=11
D.x+y=13
【考点】化学方程式的有关计算.
【分析】结合CxHy+(x+)O2xCO2+H2O计算.
【解答】解:常温下,1mol某气态烃CxHy完全燃烧需要氧气5mol,由CxHy+(x+)O2xCO2+H2O可知,x+=5,
x=1时,y=16不符合;
x=2时,y=12不符合;
x=3时,y=8,为丙烷符合,则x+y=11,
x=4时,y=4,可能x+y=8,
故选C.
7.下列微粒中:①13Al3+;②;③;④O2﹣,其核外电子数相同的是( )
A.①②③
B.②③④
C.①②④
D.①③④
【考点】原子核外电子排布.
【分析】根据质子数或原子序数与电子数的关系计算电子数.阳离子的核外电子数=质子数﹣所带电荷数,阴离子核外电子数=质子数+所带电荷数;结构示意图中弧线上的数字表示该层含有的电子数,核外电子数等于各层电子数之和.
【解答】解:①13Al3+,质子数是13,原子的电子数是13,由原子失去3个电子变成阳离子,所以该阳离子有10个电子;
②根据离子结构示意图知,核外电子数为2+8=10;
③根据电子式知,该离子最外层8个电子,氯原子为17号元素,内层有10个电子,所以该离子共有17+1=18个电子;
④O2﹣是由O原子得2个电子生成的,O原子有8个电子,所以O2﹣有10个电子;
故选:C.
8.已知:4P(红磷,S)═P4(白磷,s)△H=+17kJ moL﹣1,则下列推论正确的是( )
A.当1
mol白磷完全转变成红磷时放出17kJ热量
B.正反应是一个放热反应
C.当4g红磷转变成白磷时吸收I7k
J热量
D.白磷比红磷稳定
【考点】反应热和焓变.
【分析】由△H=+17kJ moL﹣1可知,正反应为吸热反应,则逆反应为放热反应,能量低的物质稳定,结合物质的量与反应中能量变化成正比计算.
【解答】解:A.4P(红磷,s)═P4(白磷,s)△H=+17kJ moL﹣1,则P4(白磷,s)═4P(红磷,s)△H=﹣17kJ moL﹣1,即当1
mol白磷完全转变成红磷时放出17kJ热量,故A正确;
B.由△H=+17kJ moL﹣1可知,正反应为吸热反应,故B错误;
C.由反应可知,4mol红磷转变成白磷时吸收I7k
J热量,故C错误;
D.由反应可知,红磷的能量低,则红磷稳定,故D错误;
故选A.
9.下列说法正确的是( )
A.乙醇分子中的氢原子均可被钠置换
B.乙醇能与钠反应放出氢气,说明乙醉能电离出H+而表现酸性
C.乙醇分子羟基中的氢原子比乙烷分子中的氢原子活泼
D.乙醇分子羟基中的氢原子比水分子中的氢原子活泼
【考点】有机物的结构和性质;乙醇的化学性质.
【分析】乙醇含有羟基,可与乙酸发生酯化反应生成乙酸乙酯,与水相比较,乙醇的﹣O﹣H难以断裂,可与钠反应,但反应较为缓慢,以此解答该题.
【解答】解:A.只有羟基的氢原子可与钠发生置换反应,故A错误;
B.乙醇含有羟基,可与钠发生置换反应生成氢气,但乙醇为非电解质,不显酸性,故B错误;
C.乙烷与钠不反应,可说明乙醇分子羟基中的氢原子比乙烷分子中的氢原子活泼,故C正确;
D.与水相比较,乙醇的﹣O﹣H难以断裂,可与钠反应,但反应较为缓慢,故D错误.
故选C.
10.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应
②充分燃烧的产物不污染环境
③乙醇是一种可再生能源
④燃烧时放出大量热量.
A.①②③
B.①②④
C.①③④
D.②③④
【考点】使用化石燃料的利弊及新能源的开发.
【分析】酒精燃烧生成二氧化碳和水,二氧化碳和水都不会污染空气;燃烧伴随着发光、发热等现象.乙醇可以通过粮食、秸杆发酵生成,也可以通过乙烯和水合成,因此酒精是可再生资源.
【解答】解:本题采用排除法最合适,①中燃烧是氧化反应,这是燃烧的一个共同性质,不能作为酒精燃烧的优点.例如硫和氧气燃烧生成二氧化硫,这也是一个氧化反应,并且污染空气.因为①不符合条件,所以就排除A、B、C,故选D.
11.已知原子序数,可以推断原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数 ⑥原子结构示意图 ⑦元素在周期表中的位置.
A.①②③④⑥
B.①④⑤⑥⑦
C.②③④⑤⑦
D.③④⑤⑥⑦
【考点】原子结构与元素周期律的关系;质子数、中子数、核外电子数及其相互联系.
【分析】由原子序数定义可直接得出①④⑤;由⑤和核外电子排布规律可推⑥,如:31号元素原子结构示意图为;由⑥可推⑦,如:31号元素位于第四周期ⅢA族.
【解答】解:原子序数=质子数=核电核数=核外电子数,由核外电子数和核外电子排布规律可推可知原子结构示意图,由原子结构示意图可知元素在周期表中的位置,即由原子序数定义可直接得出①④⑤;由⑤和核外电子排布规律可推⑥,如:31号元素原子结构示意图为;由⑥可推⑦,如:31号元素位于第四周期ⅢA族.
故选B.
12.锗(Ge)是第4周期ⅣA族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是( )
A.锗是一种金属性很强的元素
B.锗酸(H4GeO4)是难溶于水的强酸
C.锗化氢(GeH4)稳定性很强
D.锗的单质具有半导体的性能
【考点】元素周期表的结构及其应用.
【分析】处于金属区与非金属区的交界线上的元素常用于做半导体材料,锗和硅处于同一主族,根据同主族元素的金属性、非金属性的递变规律比较最高价含氧酸的酸性,结合元素周期律知识进行解答.
【解答】解:A.锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,故A错误;
B.锗和硅处于同一主族,主族元素的非金属性从上到下逐渐减弱,则硅的非金属性大于锗,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性比硅酸弱,为弱酸.碳酸溶液水,硅酸不溶于水,推知锗酸(H4GeO4)应难溶于水,故B错误;
C.锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,锗化氢(GeH4)稳定性很弱,故C错误;
D.锗处于金属区与非金属区的交界线上,既有金属性又有非金属性,常用于做半导体材料,故D正确;
故选D.
13.下列有关氰酸铵(NH4CNO)与尿素[CO(NH2)2]的说法正确的是( )
A.都是共价化合物
B.都是离子化合物
C.互为同分异构体
D.互为同系物
【考点】辨识简单有机化合物的同分异构体.
【分析】A.氰酸铵(NH4OCN)属于离子化合物;
B.尿素[CO(NH2)2]属于共价化合物;
C.分子式相同结构不同的化合物属于同分异构体;
D.结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物.
【解答】解:A.氰酸铵(NH4OCN)属于铵盐,是离子化合物,故A错误;
B.尿素[CO(NH2)2]中只含共价键,属于共价化合物,故B错误;
C.氰酸铵(NH4OCN)与尿素[CO(NH2)2]的分子式相同但结构不同,所以属于同分异构体,故C正确;
D.氰酸铵(NH4OCN)与尿素[CO(NH2)2]的分子式相同,分子组成不相差CH2原子团,不是同系物,故D错误;
故选C.
14.下列关于有机物的说法中不正确的是( )
A.正丁烷和异丁烷的熔、沸点不相同
B.乙烯、苯、乙酸分子中的所有原子都在同一平面上
C.C4H9Br的同分异构体有4种
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
【考点】常见有机化合物的结构;有机物的鉴别;同分异构现象和同分异构体.
【分析】A.同分异构体,支链越多,沸点越低;
B.乙酸中含甲基,为四面体结构;
C.同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物;
D.乙烯能使酸性高锰酸钾溶液褪色,而甲烷不能.
【解答】解:A.正丁烷和异丁烷互为同分异构体,支链越多,沸点越低,则熔沸点不同,故A正确;
B.乙烯、苯中所有原子都在同一平面上,而乙酸中含甲基,为四面体结构,不可能所有原子都在同一平面上,故B错误;
C.分子式为C4H9Br从饱和度看只能是饱和溴代烷烃,同分异构只是溴在碳上面链接位置不同而已,因为丁烷有两种同分异构体,它们一溴代物的种数即为C4H9Br的种数,正丁烷两种一溴代物,异丁烷两种一溴代物,共4种,所以分子式为C4H9Br的同分异构体共有4种,故C正确;
D.乙烯能使酸性高锰酸钾溶液褪色,而甲烷不能,则乙烯和甲烷可用酸性高锰酸钾溶液鉴别,故D正确;
故选B.
二、不定项选择题:本题包括6小题,毎小题4分,共24分.每小题只有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分
15.生活中常常涉及到一些有机化合物的知识.下列叙述中正确的是( )
A.将米饭在嘴中多加咀嚼就会变甜
B.羊毛和棉花的主要成分都是纤维素
C.为提高加酶洗衣粉的去污能力,应使用热水进行洗涤
D.未成熟的苹果遇碘水会变蓝,是因为其中含有淀粉
【考点】物质的组成、结构和性质的关系.
【分析】A.米饭在嘴中多加咀嚼,在唾液淀粉酶的作用下发生水解;
B.羊毛的成分为蛋白质;
C.酶洗衣粉在合适的温度下有利于去污,温度高时蛋白质发生变性;
D.淀粉遇碘单质变蓝.
【解答】解:A.米饭在嘴中多加咀嚼,在唾液淀粉酶的作用下发生水解生成葡萄糖,则米饭在嘴中多加咀嚼就会变甜,故A正确;
B.羊毛的成分为蛋白质,而棉花的主要成分是纤维素,故B错误;
C.酶洗衣粉在合适的温度下有利于去污,温度高时蛋白质发生变性,则应在温水中进行洗涤,故C错误;
D.淀粉遇碘单质变蓝,则未成熟的苹果遇碘水会变蓝,是因为其中含有淀粉,故D正确;
故选AD.
16.下列有机物的命名正确的是( )
A.
B.(CH3)2CHCH3
甲基丙烷
C.
D.
【考点】有机化合物命名.
【分析】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近﹣﹣﹣﹣﹣离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
【解答】解:A.该有机物为烯烃,碳碳双键在1号C,在3号C含有1个甲基,其正确名称为:3﹣甲基﹣1﹣丁烯,故A错误;
B.(CH3)2CHCH3为烷烃,主链为丙烷,在2号C含有1个甲基,其名称为2﹣甲基丙烷或甲基丙烷,故B正确;
C.烷烃命名中出现2﹣乙基,说明选取的主链不是最长碳链,该有机物主链为丁烷,在2号C含有1个甲基,该有机物名称为:2﹣甲基丁烷,故C错误;
D.该有机物为乙苯,名称书写不规范,故D错误;
故选B.
17.在l01kPa时燃烧1t含FeS2质量分数为70%的黄铁矿(杂质不参加反应)生成固态Fe2O3和气
态SO2,放出4.98×106kJ的热量.表示上述反应的热化学方程式正确的是( )
A.4FeS2(
s)+11O2(
g)═2Fe2O3(
s)+8SO2(g)△H=﹣3414.8kJ moL
B.FeS2(s)+O2(g)═Fe2O3
(s)+2SO2(g)△H=﹣853.7kJ moL
C.4FeS2(s)+11O2(g)═2
Fe2O3
(s)+8SO2(g)△H+3414.8kJ moL
D.FeS2(s)+O2(g)═Fe2O3
(s)+2SO2(g)△H=+853.7kJ moL
【考点】热化学方程式.
【分析】101kPa时燃烧1t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106
kJ的热量,则燃烧120g即1molFeS2会放出热量为:
kJ=853.7kJ,即FeS2(s)+O2(g)═Fe2O3(s)+2SO2(g);△H=﹣853.7kJ mol﹣1,据此进行解答.
【解答】解:101kPa时燃烧1t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106
kJ的热量,则燃烧120g即1molFeS2会放出热量为:
kJ=853.7kJ,即FeS2(s)+O2(g)═Fe2O3(s)+2SO2(g);△H=﹣853.7kJ mol﹣1,
A.4molFeS2(s)完全反应放出热量为853.7kJ×4=3414.8kJ,则反应的热化学方程式为:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g);△H=﹣3414.8kJ mol﹣1,故A正确;
B.根据分析可知,反应的热化学方程式为:FeS2(s)+O2(g)═Fe2O3(s)+2SO2(g);△H=﹣853.7kJ mol﹣1,故B正确;
C.该反应为放热反应,焓变值应该小于0,故C错误;
D.该反应为放热反应,焓变△H<0,故D错误;
故选AB.
18.在l℃时,10mL0.4mol L﹣1H2O2溶液发生催化分解:2H2O2
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min
0
2
4
6
V(
02
)/mL
0.0
9.9
17.2
22.4
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0﹣2min的平均反应速率比4﹣6min快
B.0﹣6min
的平均反应速率v(
H2O2)=3.3
x
10﹣2
moL﹣1 min﹣1
C.反应至
6min
时,c(
H2O2)=0.3mol L﹣1
D.反应至6min时,H2O2分解了
50%
【考点】化学反应速率的影响因素.
【分析】A.分别计算0~2min以及4~6min产生的氧气的物质的量,根据氧气的物质的量可计算
H2O2的反应速率大小;
B.计算0~6min产生的氧气的物质的量n(O2)==0.001mol,n(H202)=2n(O2)=0.002mol,可计算v(H202;
C.6min时,c(H2O2)=0.40﹣=0.20(mol/L);
D.6min时,H2O2分解的分解率为:×100%.
【解答】解:2H2O2
2H2O+O2↑,
A.0~2min产生的氧气的物质的量n(O2)==0.00044mol,n(H202)=2n(O2)=0.00088mol,v(H202)=≈4.4×10﹣2mol/(L min),4~6min产生的氧气的物质的量n(O2)==2.3×10﹣4mol,n(H202)=2n(O2)=4.6×10﹣4mol,
=2.3×10﹣2mol/L min,0~2min
H2O2平均反应速率比4~6min快,故A正确;
B.0~6min产生的氧气的物质的量n(O2)==0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=≈3.3×10﹣2mol/(L min),故B正确;
C.6min时,c(H2O2)=0.40﹣=0.20(mol/L),故C错误;
D.6min时,H2O2分解的分解率为:×100%=50%,故D正确,
故选C.
19.下列实验能获得成功的是( )
A.用溴水可鉴别苯、乙醇、苯乙烯
B.加浓溴水,然后过滤可除去苯中的少量乙烯
C.用酸性KMnO4溶液可除去甲烷中的乙烯
D.用新制的Cu(OH)2悬浊液可鉴别乙醇、乙醛、乙酸
【考点】化学实验方案的评价;物质的检验和鉴别的基本方法选择及应用.
【分析】A.苯与溴水分层、乙醇与溴水互溶,苯乙烯使溴水褪色;
B.溴易溶于苯;
C.乙烯被高锰酸钾氧化生成二氧化碳;
D.乙醛、乙酸、乙醇3种物质与新制Cu(OH)2反应的现象分别为:砖红色沉淀、蓝色溶液、无现象.
【解答】解:A.苯与溴水分层、乙醇与溴水互溶,苯乙烯使溴水褪色,现象不同,可鉴别,故A正确;
B.溴易溶于苯,引入新杂质,不能除杂,故B错误;
C.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,不能除杂,故C错误;
D.乙醛、乙酸、乙醇3种物质与新制Cu(OH)2反应的现象分别为:砖红色沉淀、蓝色溶液、无现象,现象不同可鉴别,故D正确;
故选AD.
20.近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(a﹣羟基丁二酸)是这种饮料中的主要酸性物质,苹果酸的结构简式为:下列说法不正确的是( )
A.苹果酸在一定条件下能与乙醇发生反应
B.苹果酸在一定条件下能发生催化氧化反应
C.苹果酸在一定条件下能与乙酸发生反应
D.1mol苹果酸与Na2CO3溶液反应最多消耗3mol
Na2CO3
【考点】有机物的结构和性质.
【分析】由结构可知,分子中含﹣COOH、﹣OH,结合羧酸、醇的性质来解答.
【解答】解:A.含﹣COOH,与乙醇发生酯化反应,故A正确;
B.含﹣OH,且与﹣OH相连C上有H,在一定条件下能发生催化氧化反应,故B正确;
C.含﹣OH,在一定条件下能与乙酸发生酯化反应,故C正确;
D.只有﹣COOH与碳酸钠反应,1mol苹果酸与Na2CO3溶液反应最多消耗1mol
Na2CO3,故D错误;
故选D.
三、解答题(共4小题,满分54分)
21.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
(2)元素③、⑦、⑧中,原子半径从大到小的顺序是 S>Cl>F (用元素符号表示).
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为 Al(OH)3+OH﹣=AlO2﹣+2H2O .
(4)元素④与元素⑧形成的化合物的电子式为 .
(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是 HClO4 .(填酸的化学式).
(6)⑤⑥两元素相比较,金属性较强的是 镁
(填名称),可以验证该结论的实验是 BC (填字母).
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性.
【考点】位置结构性质的相互关系应用.
【分析】由元素在周期表中位置,可知①为C、②为N、③为F、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)表中化学性质最不活泼的元素为Ar,原子核外有18个电子,各层电子数为2、8、8;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)元素④和⑥的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(4)元素④与元素⑧形成的化合物为NaCl,由钠离子与氯离子构成;
(5)高氯酸的酸性最强;
(6)同周期自左而右非金属性减弱;根据金属与酸置换出氢气的难易程度、金属之间的置换反应、其最高价氧化物的水化物碱性强弱等判断金属性强弱.
【解答】解:由元素在周期表中位置,可知①为C、②为N、③为F、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)表中化学性质最不活泼的元素为Ar,原子核外有18个电子,原子结构示意图为:,
故答案为:;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:S>Cl>F,
故答案为:S>Cl>F;
(3)元素④和⑥的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O,
故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O;
(4)元素④与元素⑧形成的化合物为NaCl,由钠离子与氯离子构成,电子式为:,
故答案为:;
(5)高氯酸的酸性最强,高氯酸的化学式为:HClO4,
故答案为:HClO4;
(6)同周期自左而右非金属性减弱,故金属性Mg>Al,
A.Mg、Al两种元素在空气中久置,金属表面有氧化物膜,分别放入热水中,不能根据反应判断金属性强弱,故A错误;
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,反应越剧烈,说明金属性越强,故B正确;
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液,溶液碱性越强,说明金属性越强,故C正确;
D.二者都是金属,没有气态氢化物,不能比较氢化物的稳定性判断金属性强弱,故D错误,
故答案为:镁;BC.
22.为了探究化学能与热能的转化,某实验小组设计了如下图所示三套实验装置:
(1)图示3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是 Ⅲ .
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里先加入适量氢氧化钡溶再加入稀硫酸,U形管中可观察到的现象 左端液柱降低,右端液柱升高 ,说明该反应属于 放热 (填‘吸热”或“放热”)反应.
(3)为探究固体M遇水的热效应,选择装罝Ⅱ进行实验,先在甲中放入适量的水,再加入M.
①若M为钠,则实验过程中烧杯中可观察到的现象是 产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱 .
②若只观察到烧杯里的玻璃管内形成一段水柱,则M可能是 硝酸铵 .
【考点】常见的能量转化形式.
【分析】(1)装置Ⅰ和Ⅱ都可以分别通过右边装置中液面变化、是否有气泡判断反应是吸热还是放热,而装置Ⅲ是将生成的气体直接通入水中,无法判断该反应是吸热还是放热反应;
(2)酸碱中和反应为放热反应,反应放出的热使锥形瓶中温度升高,气体体积增大,据此判断U型管中液面的变化;
(3)①钠与水的反应为放热反应,温度升高导致大试管中气体受热压强增大,烧杯中有气泡产生,冷却后体积减小,压强减小,导管中会形成水柱;
②若只观察到烧杯里的玻璃管内形成一段水柱,说明M溶于水后导致大试管中温度降低,压强减小;
【解答】解:(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热还是吸热;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应放热还是吸热;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能证明该反应是放热反应还是吸热反应,
故答案为:Ⅲ;
(2)氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U型管左端液柱降低,右端液柱升高,
故答案为:左端液柱降低,右端液柱升高;放热;
(3))①若M为钠,钠与水反应生成氢氧化钠和氢气,该反应为放热反应,放热的热量使大试管中温度升高,气体压强增大,所以右边烧杯中有气泡产生,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱,
故答案为:产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱;
②若观察到烧杯里的玻璃管内形成一段水柱,说明M溶于水后导致大试管中温度降低,压强减小,证明M溶于水为吸热过程,溶于水能够吸收热量的物质有:硝酸铵、氯化铵等,
故答案为:硝酸铵;
23.苯是一种重要的化工原料,也是一种重要的溶剂.请回答下列问题:
(1)如图是某些有机物的比例模型,其中表示为苯的是 D .
(2)在催化剂作用下,苯能与H2反应生成环己烷,反应的化学方程式为 +3H2 .
(3)在一定条件下.苯能发生多种取代反应.请写出苯生成硝基苯的化学方程式 .
(4)苯环结构中不存在碳碳单、双键的交替结构.下列可以作为证据的是 ①②④ (填序号).
①苯不能使酸性KMn04溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环己烷
④邻二甲苯只有一种
⑤间二甲苯只有一种
⑥对二甲苯只有一种
(5)已知:①苯与液溴在铁粉作催化剂的条件下能发生取代反应;
②CH3Br+CH3CH2Br+2Na
CH3CH2CH3+2NaBr.
请写出以苯和乙炔为主要原料制备聚苯乙烯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
【考点】有机物的合成.
【分析】(1)苯分子中含有6个C原子、6个H原子,每个C原子和1个H原子之间形成1个共价键,6个碳原子之间形成一个大π键;
(2)在催化剂条件下,苯和氢气完全加成生成环己烷;
(3)在浓硫酸作催化剂、加热50℃~60℃条件下,苯和浓硝酸发生取代反应生成硝基苯;
(4)如果苯中存在碳碳双键,则苯能和溴发生加成反应,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,邻二甲苯应该有两种;
(5)HC≡CH和HBr发生加成反应生成CH2=CHBr,苯发生取代反应生成溴苯,CH2=CHBr和溴苯、钠在一定条件下发生取代反应生成苯乙烯,苯乙烯在一定条件下发生加聚反应生成聚苯乙烯.
【解答】解:(1)苯分子中含有6个C原子、6个H原子,每个C原子和1个H原子之间形成1个共价键,6个碳原子之间形成一个大π键,根据图知,A是甲烷、B是乙烯、C是丙烷、D是苯,故答案为:D;
(2)在催化剂条件下,苯和氢气完全加成生成环己烷,反应方程式为+3H2,
故答案为:
+3H2;
(3)苯与浓硝酸、浓硫酸在加热条件下发生取代反应生成硝基苯与水,化学方程式为:,
故答案为:;
(4)如果苯中存在碳碳双键,则苯能和溴发生加成反应,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,邻二甲苯应该有两种,要证明苯中不存在碳碳双键,可以根据苯不能使酸性高锰酸钾溶液褪色、不能和溴水发生化学反应而使溴水褪色、邻二甲苯只有一种结构来判断,
故答案为:①②④;
(5)HC≡CH和HBr发生加成反应生成CH2=CHBr,苯发生取代反应生成溴苯,CH2=CHBr和溴苯、钠在一定条件下发生取代反应生成苯乙烯,苯乙烯在一定条件下发生加聚反应生成聚苯乙烯,其合成路线为,
故答案为:.
24.已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
(1)有机物D中官能团的名称为 羧基 ,①、④的反应类型分别为 加成反应 、 酯化反应或取代反应 .
(2)反应④的化学方程式为 CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O .
(3)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图2的装罝制备乙酸乙酯.
①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 防倒吸 .
②试管Ⅱ中加入的试剂是饱和Na2CO3溶液,其作用是: 吸收乙酸和乙醇,降低乙酸乙酯的溶解度 .
③为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用该装置进行了以下4
个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ,再测其中有机层的厚度,实验记录如下:
实验编号
试管I中试剂
试管Ⅱ中有机层的厚度/cm
A
3mL乙醇、2mL乙酸、2mL
18mol L﹣1浓硫酸
3.0
B
3mL乙醇、2mL乙酸
0.1
C
3mL
乙醇、2mL
乙酸
2mL3mol L﹣1H2SO4
0.6
D
3mL乙醇、2mL乙酸、盐酸
0.6
实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,则进行实验D时应加入 2
mL 6 mol L﹣1的盐酸.分析实验A和实验C的数据,可以推断出浓H2SO4的 吸水 (填“催化”或“吸水”)作用提高了乙酸乙酯的产率.
(4)乙醇在一定条件下可转化为有机物E,E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧.求E的化学式 C原子个数=≈4、H原子个数=≈10,则O原子个数==1,则C、H、O原子个数之比=4:10:1,则E的化学式为C4H10O (需写出计算过程).
【考点】有机物的合成.
【分析】(1)(2)A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,
A和水发生加成反应生成B,B催化氧化生成C、C发生氧化反应生成D,B和D发生酯化反应生成乙酸乙酯,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH;
(3)①有缓冲作用的装置能防止倒吸;
②饱和碳酸钠溶液能抑制乙酸乙酯溶解,能吸收可溶性物质、能和比碳酸强的酸反应;
③实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,应该使混合溶液中氢离子浓度相等;分析实验A和实验C的数据,减少生成物水的量能促进平衡正向移动;
(4)E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧,
该化合物中C原子个数=≈4、H原子个数=≈10,则O原子个数==1,则C、H、O原子个数之比=4:10:1.
【解答】解:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,
A和水发生加成反应生成B,B催化氧化生成C、C发生氧化反应生成D,B和D发生酯化反应生成乙酸乙酯,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH;
(1)D是乙酸,其官能团名称是羧基,①、④的反应类型分别为加成反应、酯化反应或取代反应,
故答案为:羧基;酯化反应或取代反应;
(2)反应④的化学方程式为CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O,故答案为:CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O;
(3)①有缓冲作用的装置能防止倒吸,该装置中球形干燥管有缓冲作用,所以能防止倒吸,故答案为:防倒吸;
②饱和碳酸钠溶液能抑制乙酸乙酯溶解,乙醇能溶于饱和碳酸钠溶液,乙酸能和饱和碳酸钠反应生成可溶性的乙酸钠,同时生成二氧化碳和水,所以饱和碳酸钠溶液的作用是吸收乙酸和乙醇、降低乙酸乙酯的溶解度,
故答案为:吸收乙酸和乙醇,降低乙酸乙酯的溶解度;
③实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,应该使混合溶液中氢离子浓度相等,则稀硫酸和盐酸的体积相等为2mL,稀盐酸浓度是硫酸的2倍,为6mol/L;分析实验A和实验C的数据,减少生成物水的量能促进平衡正向移动,从而判断浓硫酸有吸水性,
故答案为:2;6;吸水;
(4)E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧,
该化合物中C原子个数=≈4、H原子个数=≈10,则O原子个数==1,则C、H、O原子个数之比=4:10:1,则E的化学式为C4H10O,
故答案为:C4H10O.
2016年10月27日
一、单项选择题:本题包括14小题,毎小题3分,共42分.每小题只有一个选项符合题意
1.下列不属于低碳经济的是( )
A.太阳能发电
B.火力发电
C.推广节能灯
D.发展核电
2.下列属于高分子化合物且在自然界中原来并不存在的是( )
A.淀粉
B.蛋白质
C.纤维素
D.聚乙烯
3.化学与生活密切相关,下列说法正确的是( )
A.聚乙烯塑料的老化是由于发生了加成反应
B.煤经过气化和液化等物理变化可以转化为清洁燃料
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
4.下图各容器中均盛有稀盐酸,能形成原电池且铁为正极的是( )
A.
B.
C.
D.
5.下列物质的分子中,不含共价键的是( )
A.NaCl
B.Cl2
C.HCl
D.NaOH
6.常温下,1mol某气态烃CxHy完全燃烧需要氧气5mol,则x与y之和可能是( )
A.x+y=5
B.x+y=7
C.x+y=11
D.x+y=13
7.下列微粒中:①13Al3+;②;③;④O2﹣,其核外电子数相同的是( )
A.①②③
B.②③④
C.①②④
D.①③④
8.已知:4P(红磷,S)═P4(白磷,s)△H=+17kJ moL﹣1,则下列推论正确的是( )
A.当1
mol白磷完全转变成红磷时放出17kJ热量
B.正反应是一个放热反应
C.当4g红磷转变成白磷时吸收I7k
J热量
D.白磷比红磷稳定
9.下列说法正确的是( )
A.乙醇分子中的氢原子均可被钠置换
B.乙醇能与钠反应放出氢气,说明乙醉能电离出H+而表现酸性
C.乙醇分子羟基中的氢原子比乙烷分子中的氢原子活泼
D.乙醇分子羟基中的氢原子比水分子中的氢原子活泼
10.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应
②充分燃烧的产物不污染环境
③乙醇是一种可再生能源
④燃烧时放出大量热量.
A.①②③
B.①②④
C.①③④
D.②③④
11.已知原子序数,可以推断原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数 ⑥原子结构示意图 ⑦元素在周期表中的位置.
A.①②③④⑥
B.①④⑤⑥⑦
C.②③④⑤⑦
D.③④⑤⑥⑦
12.锗(Ge)是第4周期ⅣA族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是( )
A.锗是一种金属性很强的元素
B.锗酸(H4GeO4)是难溶于水的强酸
C.锗化氢(GeH4)稳定性很强
D.锗的单质具有半导体的性能
13.下列有关氰酸铵(NH4CNO)与尿素[CO(NH2)2]的说法正确的是( )
A.都是共价化合物
B.都是离子化合物
C.互为同分异构体
D.互为同系物
14.下列关于有机物的说法中不正确的是( )
A.正丁烷和异丁烷的熔、沸点不相同
B.乙烯、苯、乙酸分子中的所有原子都在同一平面上
C.C4H9Br的同分异构体有4种
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
二、不定项选择题:本题包括6小题,毎小题4分,共24分.每小题只有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分
15.生活中常常涉及到一些有机化合物的知识.下列叙述中正确的是( )
A.将米饭在嘴中多加咀嚼就会变甜
B.羊毛和棉花的主要成分都是纤维素
C.为提高加酶洗衣粉的去污能力,应使用热水进行洗涤
D.未成熟的苹果遇碘水会变蓝,是因为其中含有淀粉
16.下列有机物的命名正确的是( )
A.
B.(CH3)2CHCH3
甲基丙烷
C.
D.
17.在l01kPa时燃烧1t含FeS2质量分数为70%的黄铁矿(杂质不参加反应)生成固态Fe2O3和气
态SO2,放出4.98×106kJ的热量.表示上述反应的热化学方程式正确的是( )
A.4FeS2(
s)+11O2(
g)═2Fe2O3(
s)+8SO2(g)△H=﹣3414.8kJ moL
B.FeS2(s)+O2(g)═Fe2O3
(s)+2SO2(g)△H=﹣853.7kJ moL
C.4FeS2(s)+11O2(g)═2
Fe2O3
(s)+8SO2(g)△H+3414.8kJ moL
D.FeS2(s)+O2(g)═Fe2O3
(s)+2SO2(g)△H=+853.7kJ moL
18.在l℃时,10mL0.4mol L﹣1H2O2溶液发生催化分解:2H2O2
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min
0
2
4
6
V(
02
)/mL
0.0
9.9
17.2
22.4
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0﹣2min的平均反应速率比4﹣6min快
B.0﹣6min
的平均反应速率v(
H2O2)=3.3
x
10﹣2
moL﹣1 min﹣1
C.反应至
6min
时,c(
H2O2)=0.3mol L﹣1
D.反应至6min时,H2O2分解了
50%
19.下列实验能获得成功的是( )
A.用溴水可鉴别苯、乙醇、苯乙烯
B.加浓溴水,然后过滤可除去苯中的少量乙烯
C.用酸性KMnO4溶液可除去甲烷中的乙烯
D.用新制的Cu(OH)2悬浊液可鉴别乙醇、乙醛、乙酸
20.近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(a﹣羟基丁二酸)是这种饮料中的主要酸性物质,苹果酸的结构简式为:下列说法不正确的是( )
A.苹果酸在一定条件下能与乙醇发生反应
B.苹果酸在一定条件下能发生催化氧化反应
C.苹果酸在一定条件下能与乙酸发生反应
D.1mol苹果酸与Na2CO3溶液反应最多消耗3mol
Na2CO3
三、解答题(共4小题,满分54分)
21.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
(2)元素③、⑦、⑧中,原子半径从大到小的顺序是 (用元素符号表示).
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为 .
(4)元素④与元素⑧形成的化合物的电子式为 .
(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是 .(填酸的化学式).
(6)⑤⑥两元素相比较,金属性较强的是
(填名称),可以验证该结论的实验是 (填字母).
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性.
22.为了探究化学能与热能的转化,某实验小组设计了如下图所示三套实验装置:
(1)图示3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是 .
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里先加入适量氢氧化钡溶再加入稀硫酸,U形管中可观察到的现象 ,说明该反应属于 (填‘吸热”或“放热”)反应.
(3)为探究固体M遇水的热效应,选择装罝Ⅱ进行实验,先在甲中放入适量的水,再加入M.
①若M为钠,则实验过程中烧杯中可观察到的现象是 .
②若只观察到烧杯里的玻璃管内形成一段水柱,则M可能是 .
23.苯是一种重要的化工原料,也是一种重要的溶剂.请回答下列问题:
(1)如图是某些有机物的比例模型,其中表示为苯的是 .
(2)在催化剂作用下,苯能与H2反应生成环己烷,反应的化学方程式为 .
(3)在一定条件下.苯能发生多种取代反应.请写出苯生成硝基苯的化学方程式 .
(4)苯环结构中不存在碳碳单、双键的交替结构.下列可以作为证据的是 (填序号).
①苯不能使酸性KMn04溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环己烷
④邻二甲苯只有一种
⑤间二甲苯只有一种
⑥对二甲苯只有一种
(5)已知:①苯与液溴在铁粉作催化剂的条件下能发生取代反应;
②CH3Br+CH3CH2Br+2Na
CH3CH2CH3+2NaBr.
请写出以苯和乙炔为主要原料制备聚苯乙烯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
24.已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
(1)有机物D中官能团的名称为 ,①、④的反应类型分别为 、 .
(2)反应④的化学方程式为 .
(3)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图2的装罝制备乙酸乙酯.
①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: .
②试管Ⅱ中加入的试剂是饱和Na2CO3溶液,其作用是: .
③为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用该装置进行了以下4
个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ,再测其中有机层的厚度,实验记录如下:
实验编号
试管I中试剂
试管Ⅱ中有机层的厚度/cm
A
3mL乙醇、2mL乙酸、2mL
18mol L﹣1浓硫酸
3.0
B
3mL乙醇、2mL乙酸
0.1
C
3mL
乙醇、2mL
乙酸
2mL3mol L﹣1H2SO4
0.6
D
3mL乙醇、2mL乙酸、盐酸
0.6
实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,则进行实验D时应加入
mL mol L﹣1的盐酸.分析实验A和实验C的数据,可以推断出浓H2SO4的 (填“催化”或“吸水”)作用提高了乙酸乙酯的产率.
(4)乙醇在一定条件下可转化为有机物E,E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧.求E的化学式 (需写出计算过程).
2015-2016学年江苏省无锡市高一(下)期末化学试卷
参考答案与试题解析
一、单项选择题:本题包括14小题,毎小题3分,共42分.每小题只有一个选项符合题意
1.下列不属于低碳经济的是( )
A.太阳能发电
B.火力发电
C.推广节能灯
D.发展核电
【考点】使用化石燃料的利弊及新能源的开发.
【分析】“低碳经济”指的是生活作息时所耗用的能量要尽量减少,特别是减少二氧化碳的排放量,减缓生态恶化;可以从节电、节能和回收等环节来改变生活细节,据此进行分析判断即可.
【解答】解:A.太阳能是清洁能源,能减少二氧化碳的排放,故A错误;
B.火力发电用煤做燃料,加大二氧化碳的排放,不属于低碳经济,故B正确;
C.推广节能灯,能节约用电,能减少二氧化碳的排放,故C错误;
D.核电是清洁能源,能减少二氧化碳的排放,故D错误.
故选B.
2.下列属于高分子化合物且在自然界中原来并不存在的是( )
A.淀粉
B.蛋白质
C.纤维素
D.聚乙烯
【考点】有机高分子化合物的结构和性质.
【分析】高分子化合物(又称高聚物)一般相对分子质量高于10000,结构中有重复的结构单元;有机高分子化合物可以分为天然有机高分子化合物(如淀粉、纤维素、蛋白质天然橡胶等)和合成有机高分子化合物(如聚乙烯、聚氯乙烯等).
【解答】解:A.淀粉的相对分子质量在10000以上,为天然高分子化合物,故A错误;
B.蛋白质的相对分子质量在10000以上,为天然高分子化合物,故B错误;
C.纤维素的相对分子质量在10000以上,为天然高分子化合物,故C错误;
D.聚乙烯的相对分子质量在10000以上,为合成有机高分子化合物,故D正确.
故选D.
3.化学与生活密切相关,下列说法正确的是( )
A.聚乙烯塑料的老化是由于发生了加成反应
B.煤经过气化和液化等物理变化可以转化为清洁燃料
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
【考点】塑料的老化和降解;煤的干馏和综合利用;乙醇的工业制法;有机高分子化合物的结构和性质.
【分析】A.聚乙烯塑料是乙烯发生加成反应生成的高分子聚合物,聚乙烯的单体是乙烯;
B.煤的气化、液化都是化学变化;
C.碳纤维是碳的单质;
D.淀粉→葡萄糖→乙醇都是化学变化;
【解答】解:A.乙烯含碳碳双键其中1根键断裂,相互加成生成聚乙烯,聚乙烯中不存在双键,聚乙烯塑料的老化是由于长链断裂等原因,故A错误;
B.煤的气化是煤在氧气不足的条件下进行部分氧化形成H2、CO等气体的过程,煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品的过程,所以煤经过气化和液化等变化是化学变化,故B错误;
C.合成纤维、人造纤维都属于有机高分子材料,碳纤维是碳的单质,不属于有机高分子材料,故C错误;
D.用粮食酿酒时,先在糖化酶作用下水解为葡萄糖,然后在酵母作用下转变为酒精,都是化学变化,故D正确;故选D.
4.下图各容器中均盛有稀盐酸,能形成原电池且铁为正极的是( )
A.
B.
C.
D.
【考点】原电池和电解池的工作原理.
【分析】盐酸为电解质溶液,Fe为正极,各装置中另一种为负极,另一种金属的活泼性比铁强,还必须形成闭合回路,据此进行解答.
【解答】解:A.该装置中Al的活泼性大于Fe,铝为负极,Fe为正极,满足条件,故A正确;
B.该装置形成了原电池,铁为负极,不满足条件,故B错误;
C.该原电池中铁为负极,不满足条件,故C错误;
D.该装置没有形成闭合回路,没有构成原电池,故D错误;
故选A.
5.下列物质的分子中,不含共价键的是( )
A.NaCl
B.Cl2
C.HCl
D.NaOH
【考点】化学键.
【分析】一般来说,非金属元素之间形成共价键,活泼金属元素与非金属元素形成离子键,以此来解答.
【解答】解:A.NaCl中只含离子键,故A选;
B.Cl2中,只含共价键,故B不选;
C.HCl中,只含共价键,故C不选;
D.NaOH中,含离子键和H﹣O共价键,故D不选;
故选A.
6.常温下,1mol某气态烃CxHy完全燃烧需要氧气5mol,则x与y之和可能是( )
A.x+y=5
B.x+y=7
C.x+y=11
D.x+y=13
【考点】化学方程式的有关计算.
【分析】结合CxHy+(x+)O2xCO2+H2O计算.
【解答】解:常温下,1mol某气态烃CxHy完全燃烧需要氧气5mol,由CxHy+(x+)O2xCO2+H2O可知,x+=5,
x=1时,y=16不符合;
x=2时,y=12不符合;
x=3时,y=8,为丙烷符合,则x+y=11,
x=4时,y=4,可能x+y=8,
故选C.
7.下列微粒中:①13Al3+;②;③;④O2﹣,其核外电子数相同的是( )
A.①②③
B.②③④
C.①②④
D.①③④
【考点】原子核外电子排布.
【分析】根据质子数或原子序数与电子数的关系计算电子数.阳离子的核外电子数=质子数﹣所带电荷数,阴离子核外电子数=质子数+所带电荷数;结构示意图中弧线上的数字表示该层含有的电子数,核外电子数等于各层电子数之和.
【解答】解:①13Al3+,质子数是13,原子的电子数是13,由原子失去3个电子变成阳离子,所以该阳离子有10个电子;
②根据离子结构示意图知,核外电子数为2+8=10;
③根据电子式知,该离子最外层8个电子,氯原子为17号元素,内层有10个电子,所以该离子共有17+1=18个电子;
④O2﹣是由O原子得2个电子生成的,O原子有8个电子,所以O2﹣有10个电子;
故选:C.
8.已知:4P(红磷,S)═P4(白磷,s)△H=+17kJ moL﹣1,则下列推论正确的是( )
A.当1
mol白磷完全转变成红磷时放出17kJ热量
B.正反应是一个放热反应
C.当4g红磷转变成白磷时吸收I7k
J热量
D.白磷比红磷稳定
【考点】反应热和焓变.
【分析】由△H=+17kJ moL﹣1可知,正反应为吸热反应,则逆反应为放热反应,能量低的物质稳定,结合物质的量与反应中能量变化成正比计算.
【解答】解:A.4P(红磷,s)═P4(白磷,s)△H=+17kJ moL﹣1,则P4(白磷,s)═4P(红磷,s)△H=﹣17kJ moL﹣1,即当1
mol白磷完全转变成红磷时放出17kJ热量,故A正确;
B.由△H=+17kJ moL﹣1可知,正反应为吸热反应,故B错误;
C.由反应可知,4mol红磷转变成白磷时吸收I7k
J热量,故C错误;
D.由反应可知,红磷的能量低,则红磷稳定,故D错误;
故选A.
9.下列说法正确的是( )
A.乙醇分子中的氢原子均可被钠置换
B.乙醇能与钠反应放出氢气,说明乙醉能电离出H+而表现酸性
C.乙醇分子羟基中的氢原子比乙烷分子中的氢原子活泼
D.乙醇分子羟基中的氢原子比水分子中的氢原子活泼
【考点】有机物的结构和性质;乙醇的化学性质.
【分析】乙醇含有羟基,可与乙酸发生酯化反应生成乙酸乙酯,与水相比较,乙醇的﹣O﹣H难以断裂,可与钠反应,但反应较为缓慢,以此解答该题.
【解答】解:A.只有羟基的氢原子可与钠发生置换反应,故A错误;
B.乙醇含有羟基,可与钠发生置换反应生成氢气,但乙醇为非电解质,不显酸性,故B错误;
C.乙烷与钠不反应,可说明乙醇分子羟基中的氢原子比乙烷分子中的氢原子活泼,故C正确;
D.与水相比较,乙醇的﹣O﹣H难以断裂,可与钠反应,但反应较为缓慢,故D错误.
故选C.
10.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应
②充分燃烧的产物不污染环境
③乙醇是一种可再生能源
④燃烧时放出大量热量.
A.①②③
B.①②④
C.①③④
D.②③④
【考点】使用化石燃料的利弊及新能源的开发.
【分析】酒精燃烧生成二氧化碳和水,二氧化碳和水都不会污染空气;燃烧伴随着发光、发热等现象.乙醇可以通过粮食、秸杆发酵生成,也可以通过乙烯和水合成,因此酒精是可再生资源.
【解答】解:本题采用排除法最合适,①中燃烧是氧化反应,这是燃烧的一个共同性质,不能作为酒精燃烧的优点.例如硫和氧气燃烧生成二氧化硫,这也是一个氧化反应,并且污染空气.因为①不符合条件,所以就排除A、B、C,故选D.
11.已知原子序数,可以推断原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数 ⑥原子结构示意图 ⑦元素在周期表中的位置.
A.①②③④⑥
B.①④⑤⑥⑦
C.②③④⑤⑦
D.③④⑤⑥⑦
【考点】原子结构与元素周期律的关系;质子数、中子数、核外电子数及其相互联系.
【分析】由原子序数定义可直接得出①④⑤;由⑤和核外电子排布规律可推⑥,如:31号元素原子结构示意图为;由⑥可推⑦,如:31号元素位于第四周期ⅢA族.
【解答】解:原子序数=质子数=核电核数=核外电子数,由核外电子数和核外电子排布规律可推可知原子结构示意图,由原子结构示意图可知元素在周期表中的位置,即由原子序数定义可直接得出①④⑤;由⑤和核外电子排布规律可推⑥,如:31号元素原子结构示意图为;由⑥可推⑦,如:31号元素位于第四周期ⅢA族.
故选B.
12.锗(Ge)是第4周期ⅣA族元素,处于周期表中金属区与非金属区的交界线上,下列叙述正确的是( )
A.锗是一种金属性很强的元素
B.锗酸(H4GeO4)是难溶于水的强酸
C.锗化氢(GeH4)稳定性很强
D.锗的单质具有半导体的性能
【考点】元素周期表的结构及其应用.
【分析】处于金属区与非金属区的交界线上的元素常用于做半导体材料,锗和硅处于同一主族,根据同主族元素的金属性、非金属性的递变规律比较最高价含氧酸的酸性,结合元素周期律知识进行解答.
【解答】解:A.锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,故A错误;
B.锗和硅处于同一主族,主族元素的非金属性从上到下逐渐减弱,则硅的非金属性大于锗,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性比硅酸弱,为弱酸.碳酸溶液水,硅酸不溶于水,推知锗酸(H4GeO4)应难溶于水,故B错误;
C.锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,锗化氢(GeH4)稳定性很弱,故C错误;
D.锗处于金属区与非金属区的交界线上,既有金属性又有非金属性,常用于做半导体材料,故D正确;
故选D.
13.下列有关氰酸铵(NH4CNO)与尿素[CO(NH2)2]的说法正确的是( )
A.都是共价化合物
B.都是离子化合物
C.互为同分异构体
D.互为同系物
【考点】辨识简单有机化合物的同分异构体.
【分析】A.氰酸铵(NH4OCN)属于离子化合物;
B.尿素[CO(NH2)2]属于共价化合物;
C.分子式相同结构不同的化合物属于同分异构体;
D.结构相似、分子组成相差若干个“CH2”原子团的有机化合物互相称为同系物.
【解答】解:A.氰酸铵(NH4OCN)属于铵盐,是离子化合物,故A错误;
B.尿素[CO(NH2)2]中只含共价键,属于共价化合物,故B错误;
C.氰酸铵(NH4OCN)与尿素[CO(NH2)2]的分子式相同但结构不同,所以属于同分异构体,故C正确;
D.氰酸铵(NH4OCN)与尿素[CO(NH2)2]的分子式相同,分子组成不相差CH2原子团,不是同系物,故D错误;
故选C.
14.下列关于有机物的说法中不正确的是( )
A.正丁烷和异丁烷的熔、沸点不相同
B.乙烯、苯、乙酸分子中的所有原子都在同一平面上
C.C4H9Br的同分异构体有4种
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
【考点】常见有机化合物的结构;有机物的鉴别;同分异构现象和同分异构体.
【分析】A.同分异构体,支链越多,沸点越低;
B.乙酸中含甲基,为四面体结构;
C.同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物;
D.乙烯能使酸性高锰酸钾溶液褪色,而甲烷不能.
【解答】解:A.正丁烷和异丁烷互为同分异构体,支链越多,沸点越低,则熔沸点不同,故A正确;
B.乙烯、苯中所有原子都在同一平面上,而乙酸中含甲基,为四面体结构,不可能所有原子都在同一平面上,故B错误;
C.分子式为C4H9Br从饱和度看只能是饱和溴代烷烃,同分异构只是溴在碳上面链接位置不同而已,因为丁烷有两种同分异构体,它们一溴代物的种数即为C4H9Br的种数,正丁烷两种一溴代物,异丁烷两种一溴代物,共4种,所以分子式为C4H9Br的同分异构体共有4种,故C正确;
D.乙烯能使酸性高锰酸钾溶液褪色,而甲烷不能,则乙烯和甲烷可用酸性高锰酸钾溶液鉴别,故D正确;
故选B.
二、不定项选择题:本题包括6小题,毎小题4分,共24分.每小题只有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分
15.生活中常常涉及到一些有机化合物的知识.下列叙述中正确的是( )
A.将米饭在嘴中多加咀嚼就会变甜
B.羊毛和棉花的主要成分都是纤维素
C.为提高加酶洗衣粉的去污能力,应使用热水进行洗涤
D.未成熟的苹果遇碘水会变蓝,是因为其中含有淀粉
【考点】物质的组成、结构和性质的关系.
【分析】A.米饭在嘴中多加咀嚼,在唾液淀粉酶的作用下发生水解;
B.羊毛的成分为蛋白质;
C.酶洗衣粉在合适的温度下有利于去污,温度高时蛋白质发生变性;
D.淀粉遇碘单质变蓝.
【解答】解:A.米饭在嘴中多加咀嚼,在唾液淀粉酶的作用下发生水解生成葡萄糖,则米饭在嘴中多加咀嚼就会变甜,故A正确;
B.羊毛的成分为蛋白质,而棉花的主要成分是纤维素,故B错误;
C.酶洗衣粉在合适的温度下有利于去污,温度高时蛋白质发生变性,则应在温水中进行洗涤,故C错误;
D.淀粉遇碘单质变蓝,则未成熟的苹果遇碘水会变蓝,是因为其中含有淀粉,故D正确;
故选AD.
16.下列有机物的命名正确的是( )
A.
B.(CH3)2CHCH3
甲基丙烷
C.
D.
【考点】有机化合物命名.
【分析】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近﹣﹣﹣﹣﹣离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
【解答】解:A.该有机物为烯烃,碳碳双键在1号C,在3号C含有1个甲基,其正确名称为:3﹣甲基﹣1﹣丁烯,故A错误;
B.(CH3)2CHCH3为烷烃,主链为丙烷,在2号C含有1个甲基,其名称为2﹣甲基丙烷或甲基丙烷,故B正确;
C.烷烃命名中出现2﹣乙基,说明选取的主链不是最长碳链,该有机物主链为丁烷,在2号C含有1个甲基,该有机物名称为:2﹣甲基丁烷,故C错误;
D.该有机物为乙苯,名称书写不规范,故D错误;
故选B.
17.在l01kPa时燃烧1t含FeS2质量分数为70%的黄铁矿(杂质不参加反应)生成固态Fe2O3和气
态SO2,放出4.98×106kJ的热量.表示上述反应的热化学方程式正确的是( )
A.4FeS2(
s)+11O2(
g)═2Fe2O3(
s)+8SO2(g)△H=﹣3414.8kJ moL
B.FeS2(s)+O2(g)═Fe2O3
(s)+2SO2(g)△H=﹣853.7kJ moL
C.4FeS2(s)+11O2(g)═2
Fe2O3
(s)+8SO2(g)△H+3414.8kJ moL
D.FeS2(s)+O2(g)═Fe2O3
(s)+2SO2(g)△H=+853.7kJ moL
【考点】热化学方程式.
【分析】101kPa时燃烧1t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106
kJ的热量,则燃烧120g即1molFeS2会放出热量为:
kJ=853.7kJ,即FeS2(s)+O2(g)═Fe2O3(s)+2SO2(g);△H=﹣853.7kJ mol﹣1,据此进行解答.
【解答】解:101kPa时燃烧1t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106
kJ的热量,则燃烧120g即1molFeS2会放出热量为:
kJ=853.7kJ,即FeS2(s)+O2(g)═Fe2O3(s)+2SO2(g);△H=﹣853.7kJ mol﹣1,
A.4molFeS2(s)完全反应放出热量为853.7kJ×4=3414.8kJ,则反应的热化学方程式为:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g);△H=﹣3414.8kJ mol﹣1,故A正确;
B.根据分析可知,反应的热化学方程式为:FeS2(s)+O2(g)═Fe2O3(s)+2SO2(g);△H=﹣853.7kJ mol﹣1,故B正确;
C.该反应为放热反应,焓变值应该小于0,故C错误;
D.该反应为放热反应,焓变△H<0,故D错误;
故选AB.
18.在l℃时,10mL0.4mol L﹣1H2O2溶液发生催化分解:2H2O2
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min
0
2
4
6
V(
02
)/mL
0.0
9.9
17.2
22.4
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0﹣2min的平均反应速率比4﹣6min快
B.0﹣6min
的平均反应速率v(
H2O2)=3.3
x
10﹣2
moL﹣1 min﹣1
C.反应至
6min
时,c(
H2O2)=0.3mol L﹣1
D.反应至6min时,H2O2分解了
50%
【考点】化学反应速率的影响因素.
【分析】A.分别计算0~2min以及4~6min产生的氧气的物质的量,根据氧气的物质的量可计算
H2O2的反应速率大小;
B.计算0~6min产生的氧气的物质的量n(O2)==0.001mol,n(H202)=2n(O2)=0.002mol,可计算v(H202;
C.6min时,c(H2O2)=0.40﹣=0.20(mol/L);
D.6min时,H2O2分解的分解率为:×100%.
【解答】解:2H2O2
2H2O+O2↑,
A.0~2min产生的氧气的物质的量n(O2)==0.00044mol,n(H202)=2n(O2)=0.00088mol,v(H202)=≈4.4×10﹣2mol/(L min),4~6min产生的氧气的物质的量n(O2)==2.3×10﹣4mol,n(H202)=2n(O2)=4.6×10﹣4mol,
=2.3×10﹣2mol/L min,0~2min
H2O2平均反应速率比4~6min快,故A正确;
B.0~6min产生的氧气的物质的量n(O2)==0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=≈3.3×10﹣2mol/(L min),故B正确;
C.6min时,c(H2O2)=0.40﹣=0.20(mol/L),故C错误;
D.6min时,H2O2分解的分解率为:×100%=50%,故D正确,
故选C.
19.下列实验能获得成功的是( )
A.用溴水可鉴别苯、乙醇、苯乙烯
B.加浓溴水,然后过滤可除去苯中的少量乙烯
C.用酸性KMnO4溶液可除去甲烷中的乙烯
D.用新制的Cu(OH)2悬浊液可鉴别乙醇、乙醛、乙酸
【考点】化学实验方案的评价;物质的检验和鉴别的基本方法选择及应用.
【分析】A.苯与溴水分层、乙醇与溴水互溶,苯乙烯使溴水褪色;
B.溴易溶于苯;
C.乙烯被高锰酸钾氧化生成二氧化碳;
D.乙醛、乙酸、乙醇3种物质与新制Cu(OH)2反应的现象分别为:砖红色沉淀、蓝色溶液、无现象.
【解答】解:A.苯与溴水分层、乙醇与溴水互溶,苯乙烯使溴水褪色,现象不同,可鉴别,故A正确;
B.溴易溶于苯,引入新杂质,不能除杂,故B错误;
C.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,不能除杂,故C错误;
D.乙醛、乙酸、乙醇3种物质与新制Cu(OH)2反应的现象分别为:砖红色沉淀、蓝色溶液、无现象,现象不同可鉴别,故D正确;
故选AD.
20.近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(a﹣羟基丁二酸)是这种饮料中的主要酸性物质,苹果酸的结构简式为:下列说法不正确的是( )
A.苹果酸在一定条件下能与乙醇发生反应
B.苹果酸在一定条件下能发生催化氧化反应
C.苹果酸在一定条件下能与乙酸发生反应
D.1mol苹果酸与Na2CO3溶液反应最多消耗3mol
Na2CO3
【考点】有机物的结构和性质.
【分析】由结构可知,分子中含﹣COOH、﹣OH,结合羧酸、醇的性质来解答.
【解答】解:A.含﹣COOH,与乙醇发生酯化反应,故A正确;
B.含﹣OH,且与﹣OH相连C上有H,在一定条件下能发生催化氧化反应,故B正确;
C.含﹣OH,在一定条件下能与乙酸发生酯化反应,故C正确;
D.只有﹣COOH与碳酸钠反应,1mol苹果酸与Na2CO3溶液反应最多消耗1mol
Na2CO3,故D错误;
故选D.
三、解答题(共4小题,满分54分)
21.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
(2)元素③、⑦、⑧中,原子半径从大到小的顺序是 S>Cl>F (用元素符号表示).
(3)元素④和⑥的最高价氧化物的水化物在水溶液中反应的离子方程式为 Al(OH)3+OH﹣=AlO2﹣+2H2O .
(4)元素④与元素⑧形成的化合物的电子式为 .
(5)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是 HClO4 .(填酸的化学式).
(6)⑤⑥两元素相比较,金属性较强的是 镁
(填名称),可以验证该结论的实验是 BC (填字母).
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素的气态氢化物的稳定性.
【考点】位置结构性质的相互关系应用.
【分析】由元素在周期表中位置,可知①为C、②为N、③为F、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)表中化学性质最不活泼的元素为Ar,原子核外有18个电子,各层电子数为2、8、8;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)元素④和⑥的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(4)元素④与元素⑧形成的化合物为NaCl,由钠离子与氯离子构成;
(5)高氯酸的酸性最强;
(6)同周期自左而右非金属性减弱;根据金属与酸置换出氢气的难易程度、金属之间的置换反应、其最高价氧化物的水化物碱性强弱等判断金属性强弱.
【解答】解:由元素在周期表中位置,可知①为C、②为N、③为F、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)表中化学性质最不活泼的元素为Ar,原子核外有18个电子,原子结构示意图为:,
故答案为:;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:S>Cl>F,
故答案为:S>Cl>F;
(3)元素④和⑥的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O,
故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O;
(4)元素④与元素⑧形成的化合物为NaCl,由钠离子与氯离子构成,电子式为:,
故答案为:;
(5)高氯酸的酸性最强,高氯酸的化学式为:HClO4,
故答案为:HClO4;
(6)同周期自左而右非金属性减弱,故金属性Mg>Al,
A.Mg、Al两种元素在空气中久置,金属表面有氧化物膜,分别放入热水中,不能根据反应判断金属性强弱,故A错误;
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,反应越剧烈,说明金属性越强,故B正确;
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液,溶液碱性越强,说明金属性越强,故C正确;
D.二者都是金属,没有气态氢化物,不能比较氢化物的稳定性判断金属性强弱,故D错误,
故答案为:镁;BC.
22.为了探究化学能与热能的转化,某实验小组设计了如下图所示三套实验装置:
(1)图示3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是 Ⅲ .
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里先加入适量氢氧化钡溶再加入稀硫酸,U形管中可观察到的现象 左端液柱降低,右端液柱升高 ,说明该反应属于 放热 (填‘吸热”或“放热”)反应.
(3)为探究固体M遇水的热效应,选择装罝Ⅱ进行实验,先在甲中放入适量的水,再加入M.
①若M为钠,则实验过程中烧杯中可观察到的现象是 产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱 .
②若只观察到烧杯里的玻璃管内形成一段水柱,则M可能是 硝酸铵 .
【考点】常见的能量转化形式.
【分析】(1)装置Ⅰ和Ⅱ都可以分别通过右边装置中液面变化、是否有气泡判断反应是吸热还是放热,而装置Ⅲ是将生成的气体直接通入水中,无法判断该反应是吸热还是放热反应;
(2)酸碱中和反应为放热反应,反应放出的热使锥形瓶中温度升高,气体体积增大,据此判断U型管中液面的变化;
(3)①钠与水的反应为放热反应,温度升高导致大试管中气体受热压强增大,烧杯中有气泡产生,冷却后体积减小,压强减小,导管中会形成水柱;
②若只观察到烧杯里的玻璃管内形成一段水柱,说明M溶于水后导致大试管中温度降低,压强减小;
【解答】解:(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热还是吸热;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应放热还是吸热;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能证明该反应是放热反应还是吸热反应,
故答案为:Ⅲ;
(2)氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U型管左端液柱降低,右端液柱升高,
故答案为:左端液柱降低,右端液柱升高;放热;
(3))①若M为钠,钠与水反应生成氢氧化钠和氢气,该反应为放热反应,放热的热量使大试管中温度升高,气体压强增大,所以右边烧杯中有气泡产生,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱,
故答案为:产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱;
②若观察到烧杯里的玻璃管内形成一段水柱,说明M溶于水后导致大试管中温度降低,压强减小,证明M溶于水为吸热过程,溶于水能够吸收热量的物质有:硝酸铵、氯化铵等,
故答案为:硝酸铵;
23.苯是一种重要的化工原料,也是一种重要的溶剂.请回答下列问题:
(1)如图是某些有机物的比例模型,其中表示为苯的是 D .
(2)在催化剂作用下,苯能与H2反应生成环己烷,反应的化学方程式为 +3H2 .
(3)在一定条件下.苯能发生多种取代反应.请写出苯生成硝基苯的化学方程式 .
(4)苯环结构中不存在碳碳单、双键的交替结构.下列可以作为证据的是 ①②④ (填序号).
①苯不能使酸性KMn04溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环己烷
④邻二甲苯只有一种
⑤间二甲苯只有一种
⑥对二甲苯只有一种
(5)已知:①苯与液溴在铁粉作催化剂的条件下能发生取代反应;
②CH3Br+CH3CH2Br+2Na
CH3CH2CH3+2NaBr.
请写出以苯和乙炔为主要原料制备聚苯乙烯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
【考点】有机物的合成.
【分析】(1)苯分子中含有6个C原子、6个H原子,每个C原子和1个H原子之间形成1个共价键,6个碳原子之间形成一个大π键;
(2)在催化剂条件下,苯和氢气完全加成生成环己烷;
(3)在浓硫酸作催化剂、加热50℃~60℃条件下,苯和浓硝酸发生取代反应生成硝基苯;
(4)如果苯中存在碳碳双键,则苯能和溴发生加成反应,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,邻二甲苯应该有两种;
(5)HC≡CH和HBr发生加成反应生成CH2=CHBr,苯发生取代反应生成溴苯,CH2=CHBr和溴苯、钠在一定条件下发生取代反应生成苯乙烯,苯乙烯在一定条件下发生加聚反应生成聚苯乙烯.
【解答】解:(1)苯分子中含有6个C原子、6个H原子,每个C原子和1个H原子之间形成1个共价键,6个碳原子之间形成一个大π键,根据图知,A是甲烷、B是乙烯、C是丙烷、D是苯,故答案为:D;
(2)在催化剂条件下,苯和氢气完全加成生成环己烷,反应方程式为+3H2,
故答案为:
+3H2;
(3)苯与浓硝酸、浓硫酸在加热条件下发生取代反应生成硝基苯与水,化学方程式为:,
故答案为:;
(4)如果苯中存在碳碳双键,则苯能和溴发生加成反应,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,邻二甲苯应该有两种,要证明苯中不存在碳碳双键,可以根据苯不能使酸性高锰酸钾溶液褪色、不能和溴水发生化学反应而使溴水褪色、邻二甲苯只有一种结构来判断,
故答案为:①②④;
(5)HC≡CH和HBr发生加成反应生成CH2=CHBr,苯发生取代反应生成溴苯,CH2=CHBr和溴苯、钠在一定条件下发生取代反应生成苯乙烯,苯乙烯在一定条件下发生加聚反应生成聚苯乙烯,其合成路线为,
故答案为:.
24.已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
(1)有机物D中官能团的名称为 羧基 ,①、④的反应类型分别为 加成反应 、 酯化反应或取代反应 .
(2)反应④的化学方程式为 CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O .
(3)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用图2的装罝制备乙酸乙酯.
①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 防倒吸 .
②试管Ⅱ中加入的试剂是饱和Na2CO3溶液,其作用是: 吸收乙酸和乙醇,降低乙酸乙酯的溶解度 .
③为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用该装置进行了以下4
个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ,再测其中有机层的厚度,实验记录如下:
实验编号
试管I中试剂
试管Ⅱ中有机层的厚度/cm
A
3mL乙醇、2mL乙酸、2mL
18mol L﹣1浓硫酸
3.0
B
3mL乙醇、2mL乙酸
0.1
C
3mL
乙醇、2mL
乙酸
2mL3mol L﹣1H2SO4
0.6
D
3mL乙醇、2mL乙酸、盐酸
0.6
实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,则进行实验D时应加入 2
mL 6 mol L﹣1的盐酸.分析实验A和实验C的数据,可以推断出浓H2SO4的 吸水 (填“催化”或“吸水”)作用提高了乙酸乙酯的产率.
(4)乙醇在一定条件下可转化为有机物E,E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧.求E的化学式 C原子个数=≈4、H原子个数=≈10,则O原子个数==1,则C、H、O原子个数之比=4:10:1,则E的化学式为C4H10O (需写出计算过程).
【考点】有机物的合成.
【分析】(1)(2)A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,
A和水发生加成反应生成B,B催化氧化生成C、C发生氧化反应生成D,B和D发生酯化反应生成乙酸乙酯,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH;
(3)①有缓冲作用的装置能防止倒吸;
②饱和碳酸钠溶液能抑制乙酸乙酯溶解,能吸收可溶性物质、能和比碳酸强的酸反应;
③实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,应该使混合溶液中氢离子浓度相等;分析实验A和实验C的数据,减少生成物水的量能促进平衡正向移动;
(4)E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧,
该化合物中C原子个数=≈4、H原子个数=≈10,则O原子个数==1,则C、H、O原子个数之比=4:10:1.
【解答】解:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,
A和水发生加成反应生成B,B催化氧化生成C、C发生氧化反应生成D,B和D发生酯化反应生成乙酸乙酯,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH;
(1)D是乙酸,其官能团名称是羧基,①、④的反应类型分别为加成反应、酯化反应或取代反应,
故答案为:羧基;酯化反应或取代反应;
(2)反应④的化学方程式为CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O,故答案为:CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O;
(3)①有缓冲作用的装置能防止倒吸,该装置中球形干燥管有缓冲作用,所以能防止倒吸,故答案为:防倒吸;
②饱和碳酸钠溶液能抑制乙酸乙酯溶解,乙醇能溶于饱和碳酸钠溶液,乙酸能和饱和碳酸钠反应生成可溶性的乙酸钠,同时生成二氧化碳和水,所以饱和碳酸钠溶液的作用是吸收乙酸和乙醇、降低乙酸乙酯的溶解度,
故答案为:吸收乙酸和乙醇,降低乙酸乙酯的溶解度;
③实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,应该使混合溶液中氢离子浓度相等,则稀硫酸和盐酸的体积相等为2mL,稀盐酸浓度是硫酸的2倍,为6mol/L;分析实验A和实验C的数据,减少生成物水的量能促进平衡正向移动,从而判断浓硫酸有吸水性,
故答案为:2;6;吸水;
(4)E的相对分子质里为74,其分子中碳、氢的质量分数分别为64.9%、13.5%,其余为氧,
该化合物中C原子个数=≈4、H原子个数=≈10,则O原子个数==1,则C、H、O原子个数之比=4:10:1,则E的化学式为C4H10O,
故答案为:C4H10O.
2016年10月27日
同课章节目录
