浙江省杭州市西湖高级中学苏教版高中化学必修1:1.1.4 物质的分散系 (共26张PPT)
文档属性
| 名称 | 浙江省杭州市西湖高级中学苏教版高中化学必修1:1.1.4 物质的分散系 (共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-10-31 10:41:09 | ||
图片预览







文档简介
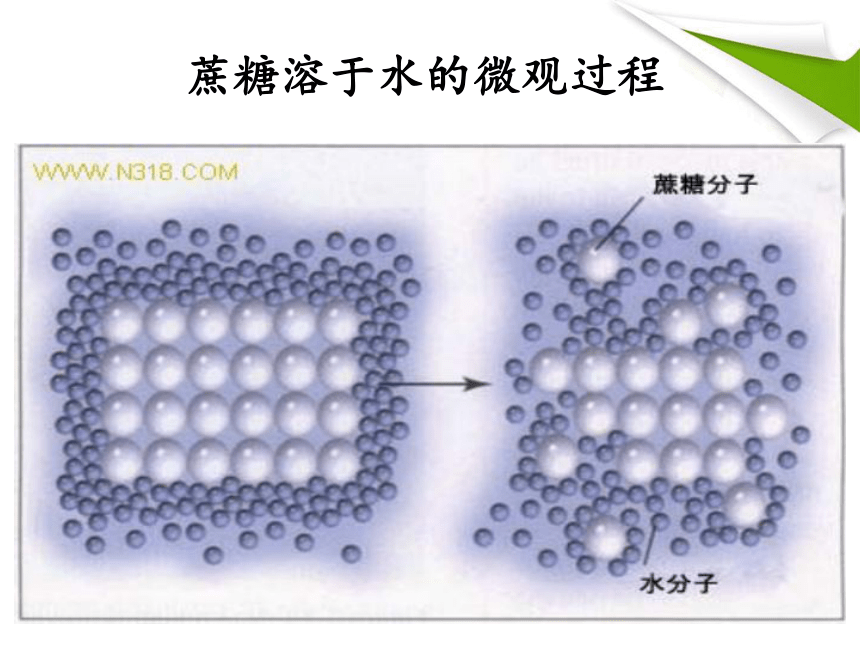
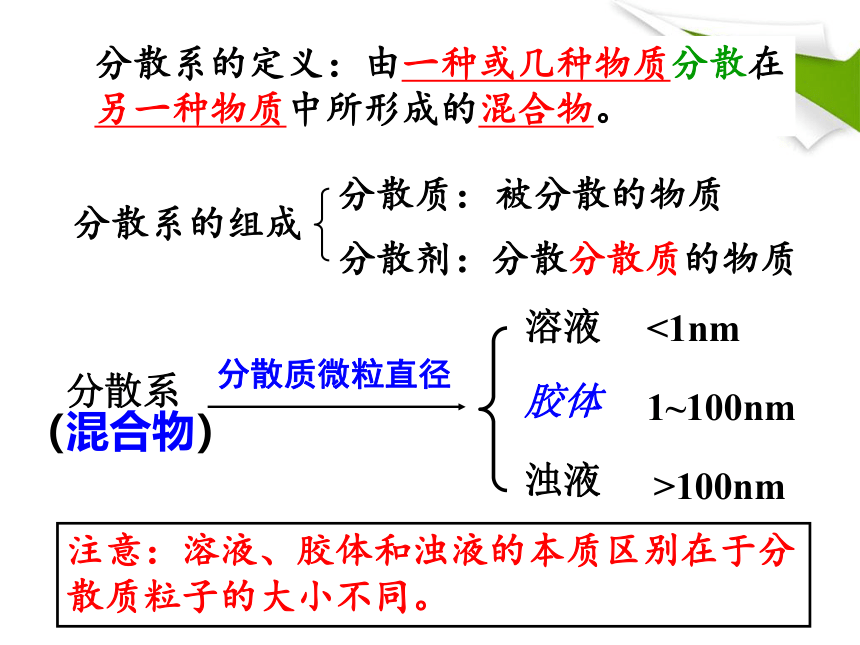
课件26张PPT。清晨的树林······§ 1.1.4物质的分散系蔗糖溶于水的微观过程分散系的定义:由一种或几种物质分散在另一种物质中所形成的混合物。分散质:分散剂:被分散的物质分散分散质的物质分散系的组成分散质微粒直径注意:溶液、胶体和浊液的本质区别在于分散质粒子的大小不同。<1nm>100nm1~100nm[胶体的性质]丁达尔效应:光束通过胶体时出现一条光亮通路的现象。硫酸铜溶液氢氧化铁胶体实验现象:光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路,而溶液没有。可用于区分胶体和溶液胶体的吸附性清晨的树林······气溶胶:如雾、云、烟等。
液溶胶:如Fe(OH)3胶体等。
固溶胶:如有色玻璃等。 ——根据分散剂状态可分为 胶体的分类:1. 下列关于胶体的叙述不正确的是 ( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 [随堂练习]C2.胶体区别于其他分散系的本质特征是 ( )
A.光束穿过胶体时形成一条光亮的“通路”
B.胶体粒子大小在1 nm~100 nm之间
C.胶体粒子可以透过滤纸
D.胶体粒子不能透过半透膜[随堂练习]B[电解质和非电解质]分析溶液导电性不同的原因氯化钠溶解的微观过程蔗糖溶解的微观过程[电解质和非电解质]1、电解质:在水溶液中或熔融状态下能导电的化合物。 2、非电解质:在水溶液中和熔融状态下都不能导电的化合物。 电解质在水溶液中或熔融状态下产生自由移动的离子的过程称为电离。酸、碱、盐和水大部分的有机化合物电离方程式练习:写出下列物质在水溶液中的电离方程式1、硝酸钾
2、碳酸钠
3、氯酸钾
4、氢氧化钙[随堂练习]1.铜、石墨和食盐水都能导电,所以它们是电解质。2.NaCl是电解质,所以NaCl晶体能导电。3.NH3、CO2、SO2的水溶液能导电,所以它们是电解质。 错,电解质和非电解质都是化合物,所以单质和化合物既不是电解质也不是非电解质。 错,在氯化钠晶体中无自由移动的离子,所以氯化钠晶体不导电。 错, NH3、CO2、SO2本身不能电离出自由移动的离子,它们的水溶液能导电是因为生成了NH3·H2O、H2CO3、H2SO3 ,这些物质在水溶能电离出自由移动离子。有下列物质:①烧碱固体 ②铁 ③氯化氢气体 ④稀硫酸 ⑤SO2 ⑥氨水 ⑦碳酸钠 ⑧蔗糖 ⑨熔融氯化钠 ⑩胆矾。请用序号填空
(1)上述状态下可以导电的是 ;
(2)属于电解质的是 ;
(3)属于非电解质的是 。分散质微粒直径分散系的定义:由一种或几种物质分散在另一种物质中所形成的混合物。分散质:分散剂:被分散的物质分散分散质的物质分散系的组成水小油滴 水小土粒水蔗糖固液混合物,液体是分散剂;
根据量的相对多少来判断:分散剂>分散质[复习回顾]1.溶液和浊液在性质上有哪些差异? 2.为什么溶液和浊液在性质会有这样的差异? 思考:溶液:均一、稳定;浊液:不均一、不稳定 溶液、胶体和浊液的本质区别在于分散质粒子的大小不同。浊液:分散质粒子的直径大于10-7m。溶液:分散质粒子的直径小于10-9m;胶体:分散质粒子的直径大于10-9m,小于 10-7m;[拓展视野]胶体的吸附性与水的净化 日常生活中我们常用来净水的是KAl(SO4)2·12H2O(十二水合硫酸铝钾),俗称明矾,它溶于水可形成Al(OH)3胶体, Al(OH)3胶体具有吸附性,能吸附水中悬浮的颗粒并沉降,是一种良好的净水剂。所有可溶性铝盐都可以作净水剂。豆浆牛奶水氢氧化铁 水小土粒水硫酸铜固液混合物,液体是分散剂;
根据量的相对多少来判断:分散剂>分散质自然界中的丁达尔现象
液溶胶:如Fe(OH)3胶体等。
固溶胶:如有色玻璃等。 ——根据分散剂状态可分为 胶体的分类:1. 下列关于胶体的叙述不正确的是 ( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 [随堂练习]C2.胶体区别于其他分散系的本质特征是 ( )
A.光束穿过胶体时形成一条光亮的“通路”
B.胶体粒子大小在1 nm~100 nm之间
C.胶体粒子可以透过滤纸
D.胶体粒子不能透过半透膜[随堂练习]B[电解质和非电解质]分析溶液导电性不同的原因氯化钠溶解的微观过程蔗糖溶解的微观过程[电解质和非电解质]1、电解质:在水溶液中或熔融状态下能导电的化合物。 2、非电解质:在水溶液中和熔融状态下都不能导电的化合物。 电解质在水溶液中或熔融状态下产生自由移动的离子的过程称为电离。酸、碱、盐和水大部分的有机化合物电离方程式练习:写出下列物质在水溶液中的电离方程式1、硝酸钾
2、碳酸钠
3、氯酸钾
4、氢氧化钙[随堂练习]1.铜、石墨和食盐水都能导电,所以它们是电解质。2.NaCl是电解质,所以NaCl晶体能导电。3.NH3、CO2、SO2的水溶液能导电,所以它们是电解质。 错,电解质和非电解质都是化合物,所以单质和化合物既不是电解质也不是非电解质。 错,在氯化钠晶体中无自由移动的离子,所以氯化钠晶体不导电。 错, NH3、CO2、SO2本身不能电离出自由移动的离子,它们的水溶液能导电是因为生成了NH3·H2O、H2CO3、H2SO3 ,这些物质在水溶能电离出自由移动离子。有下列物质:①烧碱固体 ②铁 ③氯化氢气体 ④稀硫酸 ⑤SO2 ⑥氨水 ⑦碳酸钠 ⑧蔗糖 ⑨熔融氯化钠 ⑩胆矾。请用序号填空
(1)上述状态下可以导电的是 ;
(2)属于电解质的是 ;
(3)属于非电解质的是 。分散质微粒直径分散系的定义:由一种或几种物质分散在另一种物质中所形成的混合物。分散质:分散剂:被分散的物质分散分散质的物质分散系的组成水小油滴 水小土粒水蔗糖固液混合物,液体是分散剂;
根据量的相对多少来判断:分散剂>分散质[复习回顾]1.溶液和浊液在性质上有哪些差异? 2.为什么溶液和浊液在性质会有这样的差异? 思考:溶液:均一、稳定;浊液:不均一、不稳定 溶液、胶体和浊液的本质区别在于分散质粒子的大小不同。浊液:分散质粒子的直径大于10-7m。溶液:分散质粒子的直径小于10-9m;胶体:分散质粒子的直径大于10-9m,小于 10-7m;[拓展视野]胶体的吸附性与水的净化 日常生活中我们常用来净水的是KAl(SO4)2·12H2O(十二水合硫酸铝钾),俗称明矾,它溶于水可形成Al(OH)3胶体, Al(OH)3胶体具有吸附性,能吸附水中悬浮的颗粒并沉降,是一种良好的净水剂。所有可溶性铝盐都可以作净水剂。豆浆牛奶水氢氧化铁 水小土粒水硫酸铜固液混合物,液体是分散剂;
根据量的相对多少来判断:分散剂>分散质自然界中的丁达尔现象
