山东省济南市锦泽技工学校2015-2016学年高一(上)期末化学试卷(a卷)(解析版)
文档属性
| 名称 | 山东省济南市锦泽技工学校2015-2016学年高一(上)期末化学试卷(a卷)(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 62.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-11-03 15:09:57 | ||
图片预览




文档简介
2015-2016学年山东省济南市锦泽技工学校高一(上)期末化学试卷(A卷)
一、选择题(本题包括21小题,每题3分,共63分;每小题只有一个选项符合题意)
1.下列有关环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10﹣4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
2.将金属钠分别投入下列物质的水溶液中,既有气体又有沉淀生成的是( )
A.MgCl2
B.K2SO4
C.NaCl
D.HCl
3.在某无色透明的酸性溶液中,能大量共存的离子组是( )
A.Na+、MnO4﹣、K+、NO3﹣
B.Na+、Mg2+、SO42﹣、Cl﹣
C.Na+、Ba2+、OH﹣、NO3﹣
D.K+、SO42﹣、HCO3﹣、Na+
4.下列变化中,需加入氧化剂的是( )
A.SO3→SO2
B.HCl→H2
C.FeCl2→FeCl3
D.Fe2O3→Fe
5.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
A.H2S+2HNO3═S↓+2NO2↑+2H2O
B.CuO+2HNO3═Cu(NO3)2+H2O
C.4HNO34NO2↑+O2↑+2H2O
D.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
6.下列化合物能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
A.②③⑤⑦⑧
B.①④⑥⑦
C.②③⑤⑥⑦
D.④⑥⑦⑧
7.实验室欲配制100mL
0.5mol/L的NaOH溶液,配制过程中的下列做法会使所配浓度偏高的是( )
A.称量NaOH固体时,放在烧杯中且称量较慢
B.定容时,俯视刻度线
C.定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出
D.移液前,容量瓶中有少量蒸馏水
8.下列有关物质分类的正确组合是( )
分类组合
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
H2SO4
NaHCO3
SiO2
CO2
B
NaOH
HCl
NaCl
Na2O
CO
C
NaOH
CH3COOH
CaF2
Na2O2
SO2
D
KOH
HNO3
CaCO3
CaO
SO3
A.A
B.B
C.C
D.D
9.溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.是否均一、透明、稳定
C.是否能透过滤纸或半透膜
D.分散质微粒直径大小
10.下列离子方程式书写错误的是( )
A.铁与稀硫酸反应:2Fe+6H+═2Fe2++3H2↑
B.碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+═Ca2++2CO2↑+2H2O
C.醋酸与氢氧化钾溶液反应:CH3COOH+OH﹣═CH3COO﹣+H2O
D.硝酸银溶液与氯化钾溶液反应:Ag++Cl﹣═AgCl↓
11.酸雨能造成多方面的危害,下列说法中与酸雨有直接关系的是( )
①造成植物死亡
②造成土壤酸化
③使湖泊富营养化,鱼类死亡
④危害建筑设施
⑤危害桥梁和电缆.
A.②③
B.③④⑤
C.①③⑤
D.①②④⑤
12.点燃的镁条伸入盛有下列气体的集气瓶中,能继续燃烧的是( )
①O2
②Cl2
③水蒸气
④CO2.
A.只有①
B.只有①②
C.只有①③④
D.只有①②④
13.下列关于药品的保存方法正确的是( )
A.少量钠保存在汽油中
B.固态碘盛放在细口玻璃瓶中
C.液溴保存在加有少量水的盖有玻璃塞的棕色细口瓶中
D.浓硝酸盛放在盖有橡胶塞的棕色瓶中
14.已知常温下氯酸钾与浓盐酸反应能放出氯气,现按如图进行卤素的性质实验.玻璃管内分别装有滴有少量不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
①
②
③
④
A
黄绿色
橙色
蓝色
红色
B
黄绿色
橙色
蓝色
白色
C
黄绿色
无色
紫色
红色
D
无色
橙色
紫色
白色
A.A
B.B
C.C
D.D
15.下列有关硅及其化合物的说法正确的是( )
A.晶体硅具有金属光泽,可以导电,属于金属材料
B.常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在
C.SiO2是一种酸性氧化物,能够与水反应生成相应的酸
D.除去SiO2中混有的CaCO3可加入适量的稀盐酸
16.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为( )
A.1:1
B.1:3
C.1:2
D.4:1
17.将2.56g
Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05
mol
B.1
mol
C.1.05
mol
D.0.13
mol
18.下列说法中,正确的是( )
A.制取水泥和玻璃的原料中都含有石灰石
B.普通玻璃是电的绝缘体,这种透明的固体物质属于晶体
C.石英玻璃能经受温度剧变且抵抗酸碱的腐蚀
D.硅酸盐可用氧化物表示其组成,这表明硅酸盐是由氧化物组成的
19.喷泉是一种常见的自然现象,如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体;下列气体和液体的组合中不可能形成喷泉的是( )
A.HCl和H2O
B.O2和H2O
C.NH3和H2O
D.CO2和NaOH溶液
20.下列各组稀溶液,只用试管和胶头滴管不能鉴别的是( )
A.AlCl3和KOH
B.Na2CO3和盐酸
C.Na[Al(OH)4]和盐酸
D.AlCl3和氨水
21.下列说法中,正确的是( )
A.铁是人类在生产、生活中最早使用的金属
B.金、银、铜是应用最广泛的金属材料
C.钛被誉为“21世纪的金属”,应用前景很广阔
D.铜是导电性、导热性最好的黑色金属
二、填空题(本题包括2小题,共19分)
22.在3NO2+H2O=2HNO3+NO反应中,被氧化的元素是 ,被还原的元素是 ;氧化剂是 ,还原剂是 ,氧化剂与还原剂的物质的量之比为 ;氧化产物是 ,还原产物是 ;当有3molNO2参加反应时,转移电子总数为 ,当转移4mol电子时,生成标准状况下的NO 升.
23.(1)除去FeCl2溶液中混有的FeCl3,用 试剂除去,离子方程式为
(2)除去FeCl3溶液中混有的FeCl2,用 试剂除去,离子方程式为
(3)FeCl3溶液腐蚀铜箔线路板的离子方程式
(4)Na2O2与CO2反应的化学方程式 .
三、推断题(共12分)
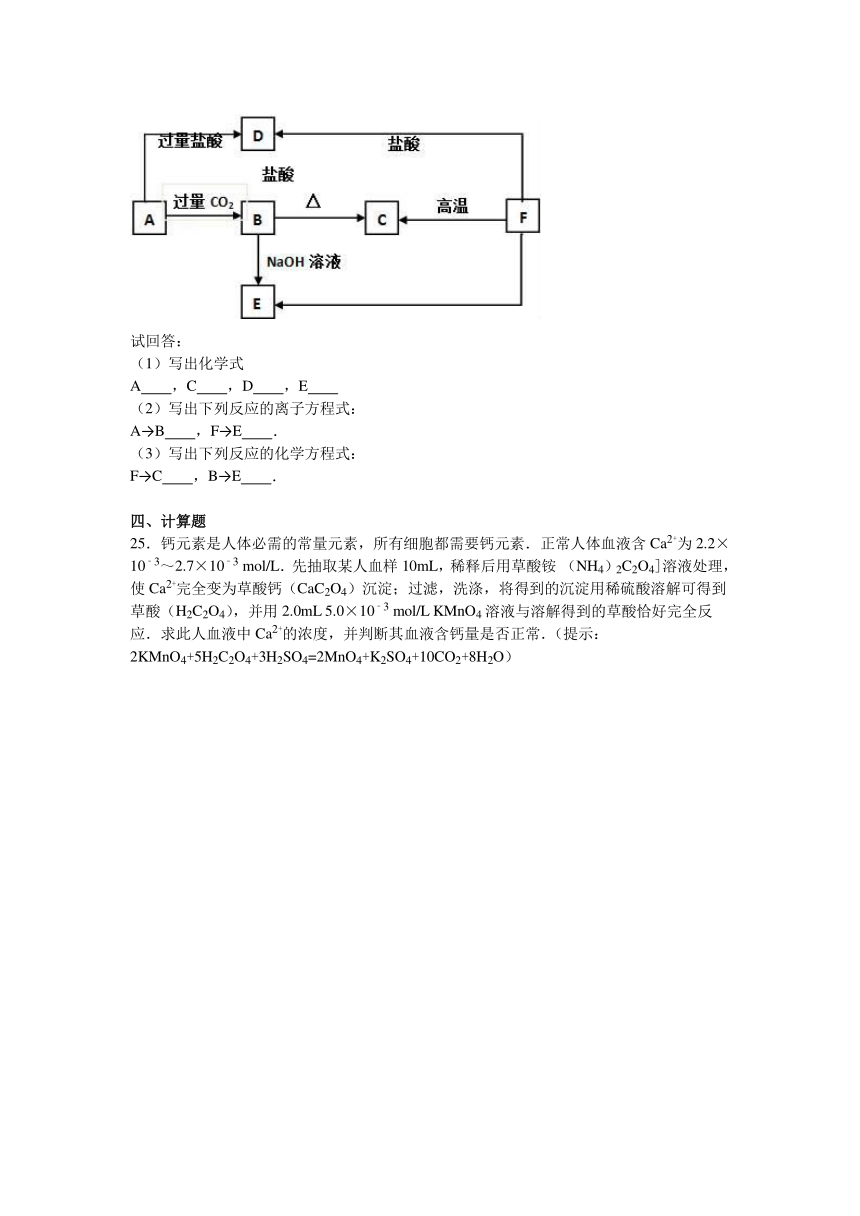
24.A、B、C、D、E五种化合物,均含有某种常见金属元素,A中又含有钾元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的具有两性的白色固体,E易溶于水.
试回答:
(1)写出化学式
A ,C ,D ,E
(2)写出下列反应的离子方程式:
A→B ,F→E .
(3)写出下列反应的化学方程式:
F→C ,B→E .
四、计算题
25.钙元素是人体必需的常量元素,所有细胞都需要钙元素.正常人体血液含Ca2+为2.2×10﹣3~2.7×10﹣3
mol/L.先抽取某人血样10mL,稀释后用草酸铵
(NH4)2C2O4]溶液处理,使Ca2+完全变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0mL
5.0×10﹣3
mol/L
KMnO4溶液与溶解得到的草酸恰好完全反应.求此人血液中Ca2+的浓度,并判断其血液含钙量是否正常.(提示:2KMnO4+5H2C2O4+3H2SO4=2MnO4+K2SO4+10CO2+8H2O)
2015-2016学年山东省济南市锦泽技工学校高一(上)期末化学试卷(A卷)
参考答案与试题解析
一、选择题(本题包括21小题,每题3分,共63分;每小题只有一个选项符合题意)
1.下列有关环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10﹣4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
【考点】常见的生活环境的污染及治理.
【分析】A.高温下石灰石分解生成CaO,可与SO2反应;
B.臭氧可引起鼻和喉头粘膜的刺激;
C.酸雨pH<5.6;
D.含磷废水易导致水体富营养化.
【解答】解:A.高温下石灰石分解生成CaO,可与SO2以及氧气反应生成硫酸钙,减少废气中SO2的量,故A正确;
B.臭氧的体积分数超过10﹣4%,除对人体有一定毒害外,引起哮喘发作,导致上呼吸道疾病恶化,同时刺激眼睛,使视觉敏感度和视力降低,故B错误;
C.酸雨pH<5.6,故C错误;
D.含磷废水易导致水体富营养化,应经处理后才能排放,故D错误.
故选A.
2.将金属钠分别投入下列物质的水溶液中,既有气体又有沉淀生成的是( )
A.MgCl2
B.K2SO4
C.NaCl
D.HCl
【考点】钠的化学性质.
【分析】钠投入到溶液中,钠先和水反应生成氢氧化钠和氢气,然后氢氧化钠再和部分盐发生复分解反应,根据反应后产物的溶解性判断.
【解答】解:钠投入到溶液中,钠先和水反应生成氢氧化钠和氢气,
A.氢氧化钠和氯化镁反应生成白色沉淀氢氧化镁,故A正确;
B.氢氧化钠和K2SO4不反应,所以没有沉淀生成,故B错误;
C.氢氧化钠和NaCl不反应,故C错误;
D.氢氧化钠和HCl反应生成氯化钠,故D错误;
故选A.
3.在某无色透明的酸性溶液中,能大量共存的离子组是( )
A.Na+、MnO4﹣、K+、NO3﹣
B.Na+、Mg2+、SO42﹣、Cl﹣
C.Na+、Ba2+、OH﹣、NO3﹣
D.K+、SO42﹣、HCO3﹣、Na+
【考点】离子共存问题.
【分析】酸性溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合离子的颜色来解答.
【解答】解:A.MnO4﹣为紫色,与无色不符,故A不选;
B.酸溶液中该组离子之间不反应,可大量共存,且离子均为无色,故B选;
C.H+、OH﹣结合生成水,不能共存,故C不选;
D.HCO3﹣、H+结合生成水和二氧化碳,不能共存,故D不选;
故选B.
4.下列变化中,需加入氧化剂的是( )
A.SO3→SO2
B.HCl→H2
C.FeCl2→FeCl3
D.Fe2O3→Fe
【考点】氧化还原反应.
【分析】需加入氧化剂,则选项中为还原剂的变化,还原剂中某元素的化合价升高,以此来解答.
【解答】解:A.SO3→SO2中,S元素的化合价降低,需要加还原剂实现,故A不选;
B.HCl→H2中,H元素的化合价降低,需要加还原剂实现,故B不选;
C.FeCl2→FeCl3中,Fe元素的化合价升高,需要加氧化剂才能实现,故C选;
D.Fe2O3→Fe中,Fe元素的化合价降低,需要加还原剂实现,故D不选;
故选C.
5.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
A.H2S+2HNO3═S↓+2NO2↑+2H2O
B.CuO+2HNO3═Cu(NO3)2+H2O
C.4HNO34NO2↑+O2↑+2H2O
D.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
【考点】硝酸的化学性质;氧化还原反应.
【分析】HNO3表现出氧化性,应被还原,N元素化合价降低,又表现出酸性,可生成硝酸盐,以此解答.
【解答】解:A.反应中硝酸只表现为氧化性,故A错误;
B.硝酸只表现为酸性,不是氧化还原反应,故B错误;
C.硝酸分解,既表现出氧化性,又表现出还原性,不表现出酸性,故C错误;
D.硝酸钡还原生成NO,表现为氧化性,生成硝酸铜,表现为酸性,故D正确.
故选:D.
6.下列化合物能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
A.②③⑤⑦⑧
B.①④⑥⑦
C.②③⑤⑥⑦
D.④⑥⑦⑧
【考点】常见金属元素的单质及其化合物的综合应用.
【分析】氯气有强氧化性,和变价金属反应生成最高价态化合物,硫的氧化性较弱,和变价金属反应生成低价态化合物,硫和氢气可以生成硫化氢,硫和铝反应可以生成硫化铝,据此分析解答.
【解答】解:硫的氧化性较弱,和铜反应生成Cu2S,2Cu+SCu2S,故①错误,⑤正确;
硫的氧化性较弱,和铁反应生成FeS,Fe+SFeS,故②正确,④错误;
硫和铝反应可以生成硫化铝,2Al+3SAl2S3,故③正确;
氯气有强氧化性,和铁反应生成氯化铁,2Fe+3Cl22FeCl3,故⑧正确,⑥错误,
硫和氢气可以生成硫化氢,H2+SH2S,故⑦正确,
正确的为②③⑤⑧⑦,
故选A.
7.实验室欲配制100mL
0.5mol/L的NaOH溶液,配制过程中的下列做法会使所配浓度偏高的是( )
A.称量NaOH固体时,放在烧杯中且称量较慢
B.定容时,俯视刻度线
C.定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出
D.移液前,容量瓶中有少量蒸馏水
【考点】配制一定物质的量浓度的溶液.
【分析】分析操作对溶质的物质的量和溶液体积的影响,依据c=进行误差分析,凡是使溶质的物质的量n偏大或者使溶液体积V偏小的操作,溶液浓度都偏高,反正溶液浓度偏低.
【解答】解:A.氢氧化钠易潮解变质,称量NaOH固体时,放在烧杯中且称量较慢,导致配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低,故A错误;
B.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故B正确;
C.定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出,导致溶液中溶质的物质的量偏小,溶液浓度偏低,故C错误;
D.容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故D错误;
故选B.
8.下列有关物质分类的正确组合是( )
分类组合
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
H2SO4
NaHCO3
SiO2
CO2
B
NaOH
HCl
NaCl
Na2O
CO
C
NaOH
CH3COOH
CaF2
Na2O2
SO2
D
KOH
HNO3
CaCO3
CaO
SO3
A.A
B.B
C.C
D.D
【考点】酸、碱、盐、氧化物的概念及其相互联系.
【分析】酸是指电离时生成的阳离子全部是氢离子的化合物;
碱是指电离时生成的阴离子全部是氢氧根离子的化合物;
盐是指由金属离子(或铵根离子)和酸根离子组成的化合物,根据以上概念分析;
碱性氧化物是和酸反应生成盐和水的
氧化物;
酸性氧化物是和碱反应生成盐和水的氧化物.
【解答】解:A.碳酸钠是盐,不是碱,二氧化硅为酸性氧化物,故A错误;
B.选项中CO为不成盐氧化物,不是酸性氧化物,故B错误;
C.选项中过氧化钠和酸反应,生成盐、水和氧气,发生的是氧化还原反应,不是碱性氧化物,故C错误;
D.KOH属于碱,HNO3属于酸,CaCO3属于盐,CaO属于碱性氧化物,SO3属于酸性氧化物,故D正确;
故选D.
9.溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.是否均一、透明、稳定
C.是否能透过滤纸或半透膜
D.分散质微粒直径大小
【考点】分散系、胶体与溶液的概念及关系.
【分析】溶液、胶体和浊液这三种分散系的本质区别是分散质微粒直径大小.
【解答】解;A.胶体和浊液的分散质都是大量分子或离子的集合体,故A不选;
B.溶液、胶体是均一、稳定的,故B不选;
C.溶液、胶体都能通过滤纸,故C不选;
D.当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,故D选;
故选D.
10.下列离子方程式书写错误的是( )
A.铁与稀硫酸反应:2Fe+6H+═2Fe2++3H2↑
B.碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+═Ca2++2CO2↑+2H2O
C.醋酸与氢氧化钾溶液反应:CH3COOH+OH﹣═CH3COO﹣+H2O
D.硝酸银溶液与氯化钾溶液反应:Ag++Cl﹣═AgCl↓
【考点】离子方程式的书写.
【分析】A.Fe与稀硫酸反应生成硫酸亚铁和氢气;
B.碳酸氢钙为易溶物,离子方程式中应该拆开;
C.醋酸与氢氧化钾溶液反应生成醋酸钾和水;
D.硝酸银与氯化钾溶液反应生成氯化银沉淀和硝酸钾.
【解答】解:A.铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为:2Fe+6H+═2Fe2++3H2↑,故A正确;
B.碳酸氢钙溶液与盐酸反应生成氯化钙、二氧化碳气体和水,正确的离子方程式为:HCO3﹣+H+═CO2↑+H2O,故B错误;
C.醋酸与氢氧化钾溶液反应的离子方程式为:CH3COOH+OH﹣═CH3COO﹣+H2O,故C正确;
D.硝酸银溶液与氯化钾溶液反应生成AgCl沉淀和硝酸钾,反应的离子方程式为:Ag++Cl﹣═AgCl↓,故D正确;
故选B.
11.酸雨能造成多方面的危害,下列说法中与酸雨有直接关系的是( )
①造成植物死亡
②造成土壤酸化
③使湖泊富营养化,鱼类死亡
④危害建筑设施
⑤危害桥梁和电缆.
A.②③
B.③④⑤
C.①③⑤
D.①②④⑤
【考点】"三废"处理与环境保护.
【分析】酸雨中含有亚硫酸、硫酸或硝酸,具有酸性,结合酸的性质解答该题.
【解答】解:①酸雨可导致植物死亡,故正确;
②酸雨酸性较强,可造成土壤酸化,故正确;
③含磷、氮较多的废水的排放可导致湖泊富营养化,鱼类死亡,与酸雨无关,故错误;
④酸雨可危害建筑设施,故正确;
⑤酸雨可与碳酸盐、金属等反应,可危害桥梁和电缆,故正确.
故选D.
12.点燃的镁条伸入盛有下列气体的集气瓶中,能继续燃烧的是( )
①O2
②Cl2
③水蒸气
④CO2.
A.只有①
B.只有①②
C.只有①③④
D.只有①②④
【考点】镁的化学性质.
【分析】镁能在氮气、二氧化碳、空气、氯气中燃烧生成化合物,不与水蒸气反应,据此分析解答.
【解答】解:Mg在氧气中剧烈燃烧,发出耀眼的强光,生成白色固体MgO:2Mg+O22MgO,在氯气中的燃烧方程式为:Mg+Cl2MgCl2,在二氧化碳中燃烧的化学方程式为:CO2+2Mg2MgO+C,
所以镁条在①O2、②Cl2、④CO2.在③水蒸气不能燃烧,
故选D.
13.下列关于药品的保存方法正确的是( )
A.少量钠保存在汽油中
B.固态碘盛放在细口玻璃瓶中
C.液溴保存在加有少量水的盖有玻璃塞的棕色细口瓶中
D.浓硝酸盛放在盖有橡胶塞的棕色瓶中
【考点】化学试剂的存放.
【分析】A.汽油易挥发、易燃烧;
B.固体药品盛放在广口瓶;
C.液溴易挥发,需液封;
D.浓硝酸具有强氧化性、不稳定性,见光分解;
【解答】解:A.汽油易挥发、易燃烧,所以不能将钠保存在汽油里,一般保存在煤油中,故A错误;
B.固态碘盛放在广口玻璃瓶中,便于取用,故B错误;
C.溴单质易挥发,应在盛溴的试剂瓶里加一些水来防止溴挥发,水封法保存,故C正确;
D.浓硝酸具有强氧化性,能够使橡胶老化,不能使用橡胶塞,故D错误;
故选:C.
14.已知常温下氯酸钾与浓盐酸反应能放出氯气,现按如图进行卤素的性质实验.玻璃管内分别装有滴有少量不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
①
②
③
④
A
黄绿色
橙色
蓝色
红色
B
黄绿色
橙色
蓝色
白色
C
黄绿色
无色
紫色
红色
D
无色
橙色
紫色
白色
A.A
B.B
C.C
D.D
【考点】氯、溴、碘及其化合物的综合应用.
【分析】根据题给信息,常温下氯酸钾与浓盐酸反应放出Cl2,①处充满黄绿色Cl2;氯气进入玻璃管后与②处NaBr溶液发生置换反应生成Br2;氯气和③处KI溶液反应置换出I2;④处利用氯气与碱液反应进行Cl2的尾气吸收.
【解答】解:常温下氯酸钾与浓盐酸反应放出Cl2,①处充满黄绿色Cl2;
氯气进入玻璃管后与②处NaBr溶液发生置换反应生成Br2,白色棉球变为橙色;
氯气和③处KI溶液反应置换出I2,遇淀粉变蓝;
④处利用氯气与碱液反应进行Cl2的尾气吸收,尽管反应生成的物质均为无色,但棉球本身是白色的,所以④处的颜色为白色.
故选B.
15.下列有关硅及其化合物的说法正确的是( )
A.晶体硅具有金属光泽,可以导电,属于金属材料
B.常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在
C.SiO2是一种酸性氧化物,能够与水反应生成相应的酸
D.除去SiO2中混有的CaCO3可加入适量的稀盐酸
【考点】硅和二氧化硅.
【分析】A.硅是非金属元素;
B.硅属于亲氧元素,在自然界中以化合态存在;
C.SiO2是一种酸性氧化物,SiO2不溶于水;
D.根据原物质和杂质的性质选择适当的除杂剂和分离方法,除杂(提纯)是指除去杂质,同时被提纯物质不得改变,加入适量的稀盐酸可除去SiO2中混有的CaCO3;
【解答】解:A.硅单质是半导体材料,可以导电,但属于非金属材料,故A错误;
B.硅的化学性质不活泼,但硅属于亲氧元素,在自然界中以化合态存在,不能以游离态存在,广泛存在于矿物和岩石中,故B错误;
C.酸性氧化物不一定都与水反应生成相应的酸,SiO2不溶于水,不能够与水反应生成相应的酸,故C错误;
D.盐酸和碳酸钙反应生成可溶性的氯化钙,二氧化硅和盐酸不反应,然后采用过滤的方法除去氯化钙,所以能除去杂质,故D正确;
故选D.
16.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为( )
A.1:1
B.1:3
C.1:2
D.4:1
【考点】氧化还原反应.
【分析】NO2与水反应方程式3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,据此进行判断.
【解答】解:NO2与水反应产生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,
所以发生还原反应和发生氧化反应的NO2的质量比为1:2,
故选C.
17.将2.56g
Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05
mol
B.1
mol
C.1.05
mol
D.0.13
mol
【考点】硝酸的化学性质;化学方程式的有关计算.
【分析】铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量.
【解答】解:铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,
则n(NO2)+n(NO)==0.05mol,即被还原的硝酸的物质的量为0.05mol,
n(Cu)==0.04mol,则生成n(Cu(NO3)2)=0.04mol,
可知表现酸性的硝酸的物质的量为0.04mol×2=0.08mol,
则参加反应的硝酸的物质的量为:0.05mol+0.08mol=0.13mol.
故选D.
18.下列说法中,正确的是( )
A.制取水泥和玻璃的原料中都含有石灰石
B.普通玻璃是电的绝缘体,这种透明的固体物质属于晶体
C.石英玻璃能经受温度剧变且抵抗酸碱的腐蚀
D.硅酸盐可用氧化物表示其组成,这表明硅酸盐是由氧化物组成的
【考点】玻璃的主要化学成分、生产原料及其用途.
【分析】A.生产玻璃的原料是纯碱、石灰石和石英,生产水泥以黏土和石灰石,据此解答;
B.玻璃为混合物;
C.二氧化硅能够与氢氧化钠反应生成硅酸钠和水;
D.硅酸盐含硅的盐类,它可以表示成氧化物的形式,但不能认为硅酸盐中含有这些氧化物.
【解答】解:A.生产玻璃的原料是纯碱、石灰石和石英,生产水泥以黏土和石灰石,所以制取水泥和玻璃时都需要的原料石灰石,故A正确;
B.普通玻璃是混合物,没有固定熔沸点,不属于晶体,故B错误;
C.石英玻璃主要成分二氧化硅,二氧化硅能够碱反应,不耐碱腐蚀,故C错误;
D.硅酸盐含硅的盐类,它可以表示成氧化物的形式,但不能认为硅酸盐中含有这些氧化物,故D错误;
故选:A.
19.喷泉是一种常见的自然现象,如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体;下列气体和液体的组合中不可能形成喷泉的是( )
A.HCl和H2O
B.O2和H2O
C.NH3和H2O
D.CO2和NaOH溶液
【考点】实验装置综合.
【分析】在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体,若形成喷泉,则气体极易溶于液体或气体极易与液体反应,以此来解答.
【解答】解:在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体,若形成喷泉,则气体极易溶于液体或气体极易与液体反应,
A.HCl极易溶于水,则可形成喷泉,故A不选;
B.氧气不溶于水,则不能形成喷泉,故B选;
C.氨气极易溶于水,可形成喷泉,故C不选;
D.二氧化碳极易与NaOH反应,产生压强差,形成喷泉,故D不选;
故选B.
20.下列各组稀溶液,只用试管和胶头滴管不能鉴别的是( )
A.AlCl3和KOH
B.Na2CO3和盐酸
C.Na[Al(OH)4]和盐酸
D.AlCl3和氨水
【考点】物质的检验和鉴别的基本方法选择及应用.
【分析】只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的物质可以采用相互滴加的方法检验,滴加顺序不同,现象不同的可以鉴别.
【解答】解:A.将氯化铝溶液滴加到KOH溶液中先没有现象,后生成沉淀,将KOH滴到氯化铝溶液中先生成沉淀后沉淀消失,二者现象不同,可鉴别,故A不选;
B.Na2CO3溶液滴入稀盐酸中,立即产生气体,若将盐酸滴入Na2CO3溶液中,开始没有气体生成,后有气体生成,二者显现不同,可鉴别,故B不选;
C.向Na[Al(OH)4]溶液加盐酸,先有沉淀后沉淀消失,而向盐酸中加Na[Al(OH)4]溶液,先没有沉淀后生成沉淀,现象不同,能鉴别,故C不选;
D.无论将氨水滴到AlCl3溶液中还是将AlCl3溶液滴到氨水中都生成白色沉淀,现象相同,不能鉴别,故D选.
故选D.
21.下列说法中,正确的是( )
A.铁是人类在生产、生活中最早使用的金属
B.金、银、铜是应用最广泛的金属材料
C.钛被誉为“21世纪的金属”,应用前景很广阔
D.铜是导电性、导热性最好的黑色金属
【考点】常见金属元素的单质及其化合物的综合应用.
【分析】A、由于铜的活动性比较弱,以单质形式存在的比较多,在我国,距今4000年前的夏朝已经开始使用红铜,即天然铜.铁比铜活泼,到春秋时期才发现使用,铝的活动性比铁还强,难以炼制铝的单质,所以到近代才被大量应用;
B、世界上应用最广泛的金属材料是铁;
C、金属钛的机械强度搞,抗腐蚀能力强,被誉为21世纪的金属;
D、导体都能导电,但是常温下,导电能力是不同的,导电性从强到弱的是银、铜、铁.
【解答】解:A、由于铜的活动性比较弱,以单质形式存在的比较多,在我国,距今4000年前的夏朝已经开始使用红铜,即天然铜.铁比铜活泼,到春秋时期才发现使用,铝的活动性比铁还强,难以炼制铝的单质,所以到近代才被大量应用,是铜而非铁,故A错误;
B、世界上应用最广泛的金属材料是铁,故B错误;
C、金属钛的机械强度搞,抗腐蚀性能力强,被誉为21世纪的金属,故C正确;
D、导体都能导电,但是常温下,导电能力是不同的,导电性从强到弱的是银、铜、铁,最好的是银,故D错误;
故选C.
二、填空题(本题包括2小题,共19分)
22.在3NO2+H2O=2HNO3+NO反应中,被氧化的元素是 N ,被还原的元素是 N ;氧化剂是 NO2 ,还原剂是 NO2 ,氧化剂与还原剂的物质的量之比为 1:2 ;氧化产物是 HNO3 ,还原产物是 NO ;当有3molNO2参加反应时,转移电子总数为 2NA ,当转移4mol电子时,生成标准状况下的NO 44.8 升.
【考点】氧化还原反应.
【分析】3NO2+H2O═2HNO3+NO反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,根据化合价的变化计算.
【解答】解:3NO2+H2O═2HNO3+NO反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,被氧化的元素和被还原的元素都是N元素,所以NO2既是氧化剂也是还原剂,氧化剂被还原生成还原产物为NO,还原剂被氧化生成氧化产物为HNO3,氧化剂与还原剂的物质的量之比为1:2;当有3molNO2参加反应时,转移电子总数为2NA;当转移4mol电子时,生成NO为2mol,在标准状况下的体积为44.8L;
故答案为:N;
N;
NO2;
NO2;
1:2;
HNO3;NO;
2NA;
44.8.
23.(1)除去FeCl2溶液中混有的FeCl3,用 Fe粉 试剂除去,离子方程式为 2Fe3++Fe=3Fe2+
(2)除去FeCl3溶液中混有的FeCl2,用 氯水(Cl2) 试剂除去,离子方程式为 Cl2+2Fe2+═2Fe3+
(3)FeCl3溶液腐蚀铜箔线路板的离子方程式 2Cu+2Fe3+═2Fe2++Cu2+
(4)Na2O2与CO2反应的化学方程式 2Na2O2+2CO2═2Na2CO3+O2↑ .
【考点】物质的分离、提纯的基本方法选择与应用;离子方程式的书写.
【分析】(1)Fe能与氯化铁反应生成氯化亚铁;
(2)FeCl2可与氯气反应生成FeCl3;
(3)铁离子具有强氧化性,可氧化铜;
(4)Na2O2与CO2反应生成碳酸钠和氧气.
【解答】解:(1)Fe能与氯化铁反应生成氯化亚铁,则选择除杂试剂为Fe粉,发生的离子反应为2Fe3++Fe=3Fe2+,故答案为:Fe粉;2Fe3++Fe=3Fe2+;
(2)FeCl2可与氯气反应生成FeCl3,可加入氯水或通入氯气,反应的离子方程式为Cl2+2Fe2+═2Fe3+,故答案为:氯水(Cl2);
Cl2+2Fe2+═2Fe3+;
(3)铁离子具有强氧化性,可氧化铜,反应的离子方程式为2Cu+2Fe3+═2Fe2++Cu2+,故答案为:2Cu+2Fe3+═2Fe2++Cu2+;
(4)Na2O2与CO2反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2↑,故答案为:2Na2O2+2CO2═2Na2CO3+O2↑.
三、推断题(共12分)
24.A、B、C、D、E五种化合物,均含有某种常见金属元素,A中又含有钾元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的具有两性的白色固体,E易溶于水.
试回答:
(1)写出化学式
A KAlO2 ,C A12O3 ,D AlCl3 ,E NaAlO2
(2)写出下列反应的离子方程式:
A→B AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ ,F→E 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ .
(3)写出下列反应的化学方程式:
F→C 2Al+Fe2O3Al2O3+2Fe ,B→E Al(OH)3+NaOH=NaAlO2+2H2O .
【考点】无机物的推断.
【分析】A、B、C、D、E五种化合物,均含有某种常见金属元素,A中又含有钾元素,且A为澄清溶液,C为难溶的具有两性的白色固体,根据图示可知B能够与NaOH溶液反应生成E,E易溶于水,则A为KAlO2,B为Al(OH)3,C为A12O3,E为NaAlO2;A与过量盐酸反应生成D,则D为AlCl3;F在高温下能够生成C(A12O3),还能够与盐酸反应生成D(AlCl3),则F为金属Al,据此结合对应物质的性质进行解答.
【解答】解:A、B、C、D、E五种化合物,均含有某种常见金属元素,A中又含有钾元素,且A为澄清溶液,C为难溶的具有两性的白色固体,根据图示可知B能够与NaOH溶液反应生成E,E易溶于水,则A为KAlO2,B为Al(OH)3,C为A12O3;A与过量盐酸反应生成D,则D为AlCl3;F在高温下能够生成C(A12O3),还能够与盐酸反应生成D(AlCl3),则F为金属Al,
(1)根据分析可知,A为KAlO2,C为A12O3,D为AlCl3,E为NaAlO2,
故答案为:KAlO2;A12O3;AlCl3;NaAlO2;
(2)A→B的反应为AlO2﹣和Al(OH)3的转化,反应的离子方程式为:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;
F→E为Al与氢氧化钠溶液的反应,反应的离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(3
)
F→C可以为Al在高温下与氧化铁反应生成氧化铝和铁,反应的化学方程式为:2Al+Fe2O3Al2O3+2Fe;
B→E为氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:2Al+Fe2O3Al2O3+2Fe;Al(OH)3+NaOH=NaAlO2+2H2O.
四、计算题
25.钙元素是人体必需的常量元素,所有细胞都需要钙元素.正常人体血液含Ca2+为2.2×10﹣3~2.7×10﹣3
mol/L.先抽取某人血样10mL,稀释后用草酸铵
(NH4)2C2O4]溶液处理,使Ca2+完全变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0mL
5.0×10﹣3
mol/L
KMnO4溶液与溶解得到的草酸恰好完全反应.求此人血液中Ca2+的浓度,并判断其血液含钙量是否正常.(提示:2KMnO4+5H2C2O4+3H2SO4=2MnO4+K2SO4+10CO2+8H2O)
【考点】化学方程式的有关计算.
【分析】根据方程式计算草酸钙的物质的量,根据元素守恒可知血液中钙离子物质的量再计算浓度.
【解答】解:消耗高锰酸钾的物质的量为:5.0×10﹣3mol/L×0.002L=1×10﹣5mol,
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O
2
5
1×10﹣5mol
n(H2C2O4)
=,
n(H2C2O4)=2.5×10﹣5mol,
C2O42﹣﹣﹣﹣﹣﹣H2C2O4﹣﹣﹣﹣CaC2O4﹣﹣﹣Ca2+
1
1
1
1
2.5×10﹣5mol
n(Ca2+)
n(Ca2+)=2.5×10﹣5mol
CCa2+)===2.5×10﹣3mol/L,
浓度为mol=2.5×10﹣3
mol/L,介于2.2×10﹣3~2.7×10﹣3
mol/L之间,所以此人健康,
答:此人血液中的Ca2+的物质的量浓度为2.5×10﹣3
mol/L,此人健康.
2016年11月3日
一、选择题(本题包括21小题,每题3分,共63分;每小题只有一个选项符合题意)
1.下列有关环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10﹣4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
2.将金属钠分别投入下列物质的水溶液中,既有气体又有沉淀生成的是( )
A.MgCl2
B.K2SO4
C.NaCl
D.HCl
3.在某无色透明的酸性溶液中,能大量共存的离子组是( )
A.Na+、MnO4﹣、K+、NO3﹣
B.Na+、Mg2+、SO42﹣、Cl﹣
C.Na+、Ba2+、OH﹣、NO3﹣
D.K+、SO42﹣、HCO3﹣、Na+
4.下列变化中,需加入氧化剂的是( )
A.SO3→SO2
B.HCl→H2
C.FeCl2→FeCl3
D.Fe2O3→Fe
5.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
A.H2S+2HNO3═S↓+2NO2↑+2H2O
B.CuO+2HNO3═Cu(NO3)2+H2O
C.4HNO34NO2↑+O2↑+2H2O
D.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
6.下列化合物能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
A.②③⑤⑦⑧
B.①④⑥⑦
C.②③⑤⑥⑦
D.④⑥⑦⑧
7.实验室欲配制100mL
0.5mol/L的NaOH溶液,配制过程中的下列做法会使所配浓度偏高的是( )
A.称量NaOH固体时,放在烧杯中且称量较慢
B.定容时,俯视刻度线
C.定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出
D.移液前,容量瓶中有少量蒸馏水
8.下列有关物质分类的正确组合是( )
分类组合
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
H2SO4
NaHCO3
SiO2
CO2
B
NaOH
HCl
NaCl
Na2O
CO
C
NaOH
CH3COOH
CaF2
Na2O2
SO2
D
KOH
HNO3
CaCO3
CaO
SO3
A.A
B.B
C.C
D.D
9.溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.是否均一、透明、稳定
C.是否能透过滤纸或半透膜
D.分散质微粒直径大小
10.下列离子方程式书写错误的是( )
A.铁与稀硫酸反应:2Fe+6H+═2Fe2++3H2↑
B.碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+═Ca2++2CO2↑+2H2O
C.醋酸与氢氧化钾溶液反应:CH3COOH+OH﹣═CH3COO﹣+H2O
D.硝酸银溶液与氯化钾溶液反应:Ag++Cl﹣═AgCl↓
11.酸雨能造成多方面的危害,下列说法中与酸雨有直接关系的是( )
①造成植物死亡
②造成土壤酸化
③使湖泊富营养化,鱼类死亡
④危害建筑设施
⑤危害桥梁和电缆.
A.②③
B.③④⑤
C.①③⑤
D.①②④⑤
12.点燃的镁条伸入盛有下列气体的集气瓶中,能继续燃烧的是( )
①O2
②Cl2
③水蒸气
④CO2.
A.只有①
B.只有①②
C.只有①③④
D.只有①②④
13.下列关于药品的保存方法正确的是( )
A.少量钠保存在汽油中
B.固态碘盛放在细口玻璃瓶中
C.液溴保存在加有少量水的盖有玻璃塞的棕色细口瓶中
D.浓硝酸盛放在盖有橡胶塞的棕色瓶中
14.已知常温下氯酸钾与浓盐酸反应能放出氯气,现按如图进行卤素的性质实验.玻璃管内分别装有滴有少量不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
①
②
③
④
A
黄绿色
橙色
蓝色
红色
B
黄绿色
橙色
蓝色
白色
C
黄绿色
无色
紫色
红色
D
无色
橙色
紫色
白色
A.A
B.B
C.C
D.D
15.下列有关硅及其化合物的说法正确的是( )
A.晶体硅具有金属光泽,可以导电,属于金属材料
B.常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在
C.SiO2是一种酸性氧化物,能够与水反应生成相应的酸
D.除去SiO2中混有的CaCO3可加入适量的稀盐酸
16.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为( )
A.1:1
B.1:3
C.1:2
D.4:1
17.将2.56g
Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05
mol
B.1
mol
C.1.05
mol
D.0.13
mol
18.下列说法中,正确的是( )
A.制取水泥和玻璃的原料中都含有石灰石
B.普通玻璃是电的绝缘体,这种透明的固体物质属于晶体
C.石英玻璃能经受温度剧变且抵抗酸碱的腐蚀
D.硅酸盐可用氧化物表示其组成,这表明硅酸盐是由氧化物组成的
19.喷泉是一种常见的自然现象,如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体;下列气体和液体的组合中不可能形成喷泉的是( )
A.HCl和H2O
B.O2和H2O
C.NH3和H2O
D.CO2和NaOH溶液
20.下列各组稀溶液,只用试管和胶头滴管不能鉴别的是( )
A.AlCl3和KOH
B.Na2CO3和盐酸
C.Na[Al(OH)4]和盐酸
D.AlCl3和氨水
21.下列说法中,正确的是( )
A.铁是人类在生产、生活中最早使用的金属
B.金、银、铜是应用最广泛的金属材料
C.钛被誉为“21世纪的金属”,应用前景很广阔
D.铜是导电性、导热性最好的黑色金属
二、填空题(本题包括2小题,共19分)
22.在3NO2+H2O=2HNO3+NO反应中,被氧化的元素是 ,被还原的元素是 ;氧化剂是 ,还原剂是 ,氧化剂与还原剂的物质的量之比为 ;氧化产物是 ,还原产物是 ;当有3molNO2参加反应时,转移电子总数为 ,当转移4mol电子时,生成标准状况下的NO 升.
23.(1)除去FeCl2溶液中混有的FeCl3,用 试剂除去,离子方程式为
(2)除去FeCl3溶液中混有的FeCl2,用 试剂除去,离子方程式为
(3)FeCl3溶液腐蚀铜箔线路板的离子方程式
(4)Na2O2与CO2反应的化学方程式 .
三、推断题(共12分)
24.A、B、C、D、E五种化合物,均含有某种常见金属元素,A中又含有钾元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的具有两性的白色固体,E易溶于水.
试回答:
(1)写出化学式
A ,C ,D ,E
(2)写出下列反应的离子方程式:
A→B ,F→E .
(3)写出下列反应的化学方程式:
F→C ,B→E .
四、计算题
25.钙元素是人体必需的常量元素,所有细胞都需要钙元素.正常人体血液含Ca2+为2.2×10﹣3~2.7×10﹣3
mol/L.先抽取某人血样10mL,稀释后用草酸铵
(NH4)2C2O4]溶液处理,使Ca2+完全变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0mL
5.0×10﹣3
mol/L
KMnO4溶液与溶解得到的草酸恰好完全反应.求此人血液中Ca2+的浓度,并判断其血液含钙量是否正常.(提示:2KMnO4+5H2C2O4+3H2SO4=2MnO4+K2SO4+10CO2+8H2O)
2015-2016学年山东省济南市锦泽技工学校高一(上)期末化学试卷(A卷)
参考答案与试题解析
一、选择题(本题包括21小题,每题3分,共63分;每小题只有一个选项符合题意)
1.下列有关环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10﹣4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
【考点】常见的生活环境的污染及治理.
【分析】A.高温下石灰石分解生成CaO,可与SO2反应;
B.臭氧可引起鼻和喉头粘膜的刺激;
C.酸雨pH<5.6;
D.含磷废水易导致水体富营养化.
【解答】解:A.高温下石灰石分解生成CaO,可与SO2以及氧气反应生成硫酸钙,减少废气中SO2的量,故A正确;
B.臭氧的体积分数超过10﹣4%,除对人体有一定毒害外,引起哮喘发作,导致上呼吸道疾病恶化,同时刺激眼睛,使视觉敏感度和视力降低,故B错误;
C.酸雨pH<5.6,故C错误;
D.含磷废水易导致水体富营养化,应经处理后才能排放,故D错误.
故选A.
2.将金属钠分别投入下列物质的水溶液中,既有气体又有沉淀生成的是( )
A.MgCl2
B.K2SO4
C.NaCl
D.HCl
【考点】钠的化学性质.
【分析】钠投入到溶液中,钠先和水反应生成氢氧化钠和氢气,然后氢氧化钠再和部分盐发生复分解反应,根据反应后产物的溶解性判断.
【解答】解:钠投入到溶液中,钠先和水反应生成氢氧化钠和氢气,
A.氢氧化钠和氯化镁反应生成白色沉淀氢氧化镁,故A正确;
B.氢氧化钠和K2SO4不反应,所以没有沉淀生成,故B错误;
C.氢氧化钠和NaCl不反应,故C错误;
D.氢氧化钠和HCl反应生成氯化钠,故D错误;
故选A.
3.在某无色透明的酸性溶液中,能大量共存的离子组是( )
A.Na+、MnO4﹣、K+、NO3﹣
B.Na+、Mg2+、SO42﹣、Cl﹣
C.Na+、Ba2+、OH﹣、NO3﹣
D.K+、SO42﹣、HCO3﹣、Na+
【考点】离子共存问题.
【分析】酸性溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合离子的颜色来解答.
【解答】解:A.MnO4﹣为紫色,与无色不符,故A不选;
B.酸溶液中该组离子之间不反应,可大量共存,且离子均为无色,故B选;
C.H+、OH﹣结合生成水,不能共存,故C不选;
D.HCO3﹣、H+结合生成水和二氧化碳,不能共存,故D不选;
故选B.
4.下列变化中,需加入氧化剂的是( )
A.SO3→SO2
B.HCl→H2
C.FeCl2→FeCl3
D.Fe2O3→Fe
【考点】氧化还原反应.
【分析】需加入氧化剂,则选项中为还原剂的变化,还原剂中某元素的化合价升高,以此来解答.
【解答】解:A.SO3→SO2中,S元素的化合价降低,需要加还原剂实现,故A不选;
B.HCl→H2中,H元素的化合价降低,需要加还原剂实现,故B不选;
C.FeCl2→FeCl3中,Fe元素的化合价升高,需要加氧化剂才能实现,故C选;
D.Fe2O3→Fe中,Fe元素的化合价降低,需要加还原剂实现,故D不选;
故选C.
5.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )
A.H2S+2HNO3═S↓+2NO2↑+2H2O
B.CuO+2HNO3═Cu(NO3)2+H2O
C.4HNO34NO2↑+O2↑+2H2O
D.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
【考点】硝酸的化学性质;氧化还原反应.
【分析】HNO3表现出氧化性,应被还原,N元素化合价降低,又表现出酸性,可生成硝酸盐,以此解答.
【解答】解:A.反应中硝酸只表现为氧化性,故A错误;
B.硝酸只表现为酸性,不是氧化还原反应,故B错误;
C.硝酸分解,既表现出氧化性,又表现出还原性,不表现出酸性,故C错误;
D.硝酸钡还原生成NO,表现为氧化性,生成硝酸铜,表现为酸性,故D正确.
故选:D.
6.下列化合物能用相应元素的单质直接化合生成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3 ⑤Cu2S ⑥FeCl2⑦H2S ⑧FeCl3.
A.②③⑤⑦⑧
B.①④⑥⑦
C.②③⑤⑥⑦
D.④⑥⑦⑧
【考点】常见金属元素的单质及其化合物的综合应用.
【分析】氯气有强氧化性,和变价金属反应生成最高价态化合物,硫的氧化性较弱,和变价金属反应生成低价态化合物,硫和氢气可以生成硫化氢,硫和铝反应可以生成硫化铝,据此分析解答.
【解答】解:硫的氧化性较弱,和铜反应生成Cu2S,2Cu+SCu2S,故①错误,⑤正确;
硫的氧化性较弱,和铁反应生成FeS,Fe+SFeS,故②正确,④错误;
硫和铝反应可以生成硫化铝,2Al+3SAl2S3,故③正确;
氯气有强氧化性,和铁反应生成氯化铁,2Fe+3Cl22FeCl3,故⑧正确,⑥错误,
硫和氢气可以生成硫化氢,H2+SH2S,故⑦正确,
正确的为②③⑤⑧⑦,
故选A.
7.实验室欲配制100mL
0.5mol/L的NaOH溶液,配制过程中的下列做法会使所配浓度偏高的是( )
A.称量NaOH固体时,放在烧杯中且称量较慢
B.定容时,俯视刻度线
C.定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出
D.移液前,容量瓶中有少量蒸馏水
【考点】配制一定物质的量浓度的溶液.
【分析】分析操作对溶质的物质的量和溶液体积的影响,依据c=进行误差分析,凡是使溶质的物质的量n偏大或者使溶液体积V偏小的操作,溶液浓度都偏高,反正溶液浓度偏低.
【解答】解:A.氢氧化钠易潮解变质,称量NaOH固体时,放在烧杯中且称量较慢,导致配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低,故A错误;
B.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故B正确;
C.定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出,导致溶液中溶质的物质的量偏小,溶液浓度偏低,故C错误;
D.容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故D错误;
故选B.
8.下列有关物质分类的正确组合是( )
分类组合
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
H2SO4
NaHCO3
SiO2
CO2
B
NaOH
HCl
NaCl
Na2O
CO
C
NaOH
CH3COOH
CaF2
Na2O2
SO2
D
KOH
HNO3
CaCO3
CaO
SO3
A.A
B.B
C.C
D.D
【考点】酸、碱、盐、氧化物的概念及其相互联系.
【分析】酸是指电离时生成的阳离子全部是氢离子的化合物;
碱是指电离时生成的阴离子全部是氢氧根离子的化合物;
盐是指由金属离子(或铵根离子)和酸根离子组成的化合物,根据以上概念分析;
碱性氧化物是和酸反应生成盐和水的
氧化物;
酸性氧化物是和碱反应生成盐和水的氧化物.
【解答】解:A.碳酸钠是盐,不是碱,二氧化硅为酸性氧化物,故A错误;
B.选项中CO为不成盐氧化物,不是酸性氧化物,故B错误;
C.选项中过氧化钠和酸反应,生成盐、水和氧气,发生的是氧化还原反应,不是碱性氧化物,故C错误;
D.KOH属于碱,HNO3属于酸,CaCO3属于盐,CaO属于碱性氧化物,SO3属于酸性氧化物,故D正确;
故选D.
9.溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.是否均一、透明、稳定
C.是否能透过滤纸或半透膜
D.分散质微粒直径大小
【考点】分散系、胶体与溶液的概念及关系.
【分析】溶液、胶体和浊液这三种分散系的本质区别是分散质微粒直径大小.
【解答】解;A.胶体和浊液的分散质都是大量分子或离子的集合体,故A不选;
B.溶液、胶体是均一、稳定的,故B不选;
C.溶液、胶体都能通过滤纸,故C不选;
D.当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小,故D选;
故选D.
10.下列离子方程式书写错误的是( )
A.铁与稀硫酸反应:2Fe+6H+═2Fe2++3H2↑
B.碳酸氢钙溶液与盐酸反应:Ca(HCO3)2+2H+═Ca2++2CO2↑+2H2O
C.醋酸与氢氧化钾溶液反应:CH3COOH+OH﹣═CH3COO﹣+H2O
D.硝酸银溶液与氯化钾溶液反应:Ag++Cl﹣═AgCl↓
【考点】离子方程式的书写.
【分析】A.Fe与稀硫酸反应生成硫酸亚铁和氢气;
B.碳酸氢钙为易溶物,离子方程式中应该拆开;
C.醋酸与氢氧化钾溶液反应生成醋酸钾和水;
D.硝酸银与氯化钾溶液反应生成氯化银沉淀和硝酸钾.
【解答】解:A.铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为:2Fe+6H+═2Fe2++3H2↑,故A正确;
B.碳酸氢钙溶液与盐酸反应生成氯化钙、二氧化碳气体和水,正确的离子方程式为:HCO3﹣+H+═CO2↑+H2O,故B错误;
C.醋酸与氢氧化钾溶液反应的离子方程式为:CH3COOH+OH﹣═CH3COO﹣+H2O,故C正确;
D.硝酸银溶液与氯化钾溶液反应生成AgCl沉淀和硝酸钾,反应的离子方程式为:Ag++Cl﹣═AgCl↓,故D正确;
故选B.
11.酸雨能造成多方面的危害,下列说法中与酸雨有直接关系的是( )
①造成植物死亡
②造成土壤酸化
③使湖泊富营养化,鱼类死亡
④危害建筑设施
⑤危害桥梁和电缆.
A.②③
B.③④⑤
C.①③⑤
D.①②④⑤
【考点】"三废"处理与环境保护.
【分析】酸雨中含有亚硫酸、硫酸或硝酸,具有酸性,结合酸的性质解答该题.
【解答】解:①酸雨可导致植物死亡,故正确;
②酸雨酸性较强,可造成土壤酸化,故正确;
③含磷、氮较多的废水的排放可导致湖泊富营养化,鱼类死亡,与酸雨无关,故错误;
④酸雨可危害建筑设施,故正确;
⑤酸雨可与碳酸盐、金属等反应,可危害桥梁和电缆,故正确.
故选D.
12.点燃的镁条伸入盛有下列气体的集气瓶中,能继续燃烧的是( )
①O2
②Cl2
③水蒸气
④CO2.
A.只有①
B.只有①②
C.只有①③④
D.只有①②④
【考点】镁的化学性质.
【分析】镁能在氮气、二氧化碳、空气、氯气中燃烧生成化合物,不与水蒸气反应,据此分析解答.
【解答】解:Mg在氧气中剧烈燃烧,发出耀眼的强光,生成白色固体MgO:2Mg+O22MgO,在氯气中的燃烧方程式为:Mg+Cl2MgCl2,在二氧化碳中燃烧的化学方程式为:CO2+2Mg2MgO+C,
所以镁条在①O2、②Cl2、④CO2.在③水蒸气不能燃烧,
故选D.
13.下列关于药品的保存方法正确的是( )
A.少量钠保存在汽油中
B.固态碘盛放在细口玻璃瓶中
C.液溴保存在加有少量水的盖有玻璃塞的棕色细口瓶中
D.浓硝酸盛放在盖有橡胶塞的棕色瓶中
【考点】化学试剂的存放.
【分析】A.汽油易挥发、易燃烧;
B.固体药品盛放在广口瓶;
C.液溴易挥发,需液封;
D.浓硝酸具有强氧化性、不稳定性,见光分解;
【解答】解:A.汽油易挥发、易燃烧,所以不能将钠保存在汽油里,一般保存在煤油中,故A错误;
B.固态碘盛放在广口玻璃瓶中,便于取用,故B错误;
C.溴单质易挥发,应在盛溴的试剂瓶里加一些水来防止溴挥发,水封法保存,故C正确;
D.浓硝酸具有强氧化性,能够使橡胶老化,不能使用橡胶塞,故D错误;
故选:C.
14.已知常温下氯酸钾与浓盐酸反应能放出氯气,现按如图进行卤素的性质实验.玻璃管内分别装有滴有少量不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
①
②
③
④
A
黄绿色
橙色
蓝色
红色
B
黄绿色
橙色
蓝色
白色
C
黄绿色
无色
紫色
红色
D
无色
橙色
紫色
白色
A.A
B.B
C.C
D.D
【考点】氯、溴、碘及其化合物的综合应用.
【分析】根据题给信息,常温下氯酸钾与浓盐酸反应放出Cl2,①处充满黄绿色Cl2;氯气进入玻璃管后与②处NaBr溶液发生置换反应生成Br2;氯气和③处KI溶液反应置换出I2;④处利用氯气与碱液反应进行Cl2的尾气吸收.
【解答】解:常温下氯酸钾与浓盐酸反应放出Cl2,①处充满黄绿色Cl2;
氯气进入玻璃管后与②处NaBr溶液发生置换反应生成Br2,白色棉球变为橙色;
氯气和③处KI溶液反应置换出I2,遇淀粉变蓝;
④处利用氯气与碱液反应进行Cl2的尾气吸收,尽管反应生成的物质均为无色,但棉球本身是白色的,所以④处的颜色为白色.
故选B.
15.下列有关硅及其化合物的说法正确的是( )
A.晶体硅具有金属光泽,可以导电,属于金属材料
B.常温下,硅的化学性质稳定,所以自然界中的硅大部分以游离态存在
C.SiO2是一种酸性氧化物,能够与水反应生成相应的酸
D.除去SiO2中混有的CaCO3可加入适量的稀盐酸
【考点】硅和二氧化硅.
【分析】A.硅是非金属元素;
B.硅属于亲氧元素,在自然界中以化合态存在;
C.SiO2是一种酸性氧化物,SiO2不溶于水;
D.根据原物质和杂质的性质选择适当的除杂剂和分离方法,除杂(提纯)是指除去杂质,同时被提纯物质不得改变,加入适量的稀盐酸可除去SiO2中混有的CaCO3;
【解答】解:A.硅单质是半导体材料,可以导电,但属于非金属材料,故A错误;
B.硅的化学性质不活泼,但硅属于亲氧元素,在自然界中以化合态存在,不能以游离态存在,广泛存在于矿物和岩石中,故B错误;
C.酸性氧化物不一定都与水反应生成相应的酸,SiO2不溶于水,不能够与水反应生成相应的酸,故C错误;
D.盐酸和碳酸钙反应生成可溶性的氯化钙,二氧化硅和盐酸不反应,然后采用过滤的方法除去氯化钙,所以能除去杂质,故D正确;
故选D.
16.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为( )
A.1:1
B.1:3
C.1:2
D.4:1
【考点】氧化还原反应.
【分析】NO2与水反应方程式3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,据此进行判断.
【解答】解:NO2与水反应产生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,
所以发生还原反应和发生氧化反应的NO2的质量比为1:2,
故选C.
17.将2.56g
Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05
mol
B.1
mol
C.1.05
mol
D.0.13
mol
【考点】硝酸的化学性质;化学方程式的有关计算.
【分析】铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量.
【解答】解:铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,
则n(NO2)+n(NO)==0.05mol,即被还原的硝酸的物质的量为0.05mol,
n(Cu)==0.04mol,则生成n(Cu(NO3)2)=0.04mol,
可知表现酸性的硝酸的物质的量为0.04mol×2=0.08mol,
则参加反应的硝酸的物质的量为:0.05mol+0.08mol=0.13mol.
故选D.
18.下列说法中,正确的是( )
A.制取水泥和玻璃的原料中都含有石灰石
B.普通玻璃是电的绝缘体,这种透明的固体物质属于晶体
C.石英玻璃能经受温度剧变且抵抗酸碱的腐蚀
D.硅酸盐可用氧化物表示其组成,这表明硅酸盐是由氧化物组成的
【考点】玻璃的主要化学成分、生产原料及其用途.
【分析】A.生产玻璃的原料是纯碱、石灰石和石英,生产水泥以黏土和石灰石,据此解答;
B.玻璃为混合物;
C.二氧化硅能够与氢氧化钠反应生成硅酸钠和水;
D.硅酸盐含硅的盐类,它可以表示成氧化物的形式,但不能认为硅酸盐中含有这些氧化物.
【解答】解:A.生产玻璃的原料是纯碱、石灰石和石英,生产水泥以黏土和石灰石,所以制取水泥和玻璃时都需要的原料石灰石,故A正确;
B.普通玻璃是混合物,没有固定熔沸点,不属于晶体,故B错误;
C.石英玻璃主要成分二氧化硅,二氧化硅能够碱反应,不耐碱腐蚀,故C错误;
D.硅酸盐含硅的盐类,它可以表示成氧化物的形式,但不能认为硅酸盐中含有这些氧化物,故D错误;
故选:A.
19.喷泉是一种常见的自然现象,如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体;下列气体和液体的组合中不可能形成喷泉的是( )
A.HCl和H2O
B.O2和H2O
C.NH3和H2O
D.CO2和NaOH溶液
【考点】实验装置综合.
【分析】在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体,若形成喷泉,则气体极易溶于液体或气体极易与液体反应,以此来解答.
【解答】解:在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体,若形成喷泉,则气体极易溶于液体或气体极易与液体反应,
A.HCl极易溶于水,则可形成喷泉,故A不选;
B.氧气不溶于水,则不能形成喷泉,故B选;
C.氨气极易溶于水,可形成喷泉,故C不选;
D.二氧化碳极易与NaOH反应,产生压强差,形成喷泉,故D不选;
故选B.
20.下列各组稀溶液,只用试管和胶头滴管不能鉴别的是( )
A.AlCl3和KOH
B.Na2CO3和盐酸
C.Na[Al(OH)4]和盐酸
D.AlCl3和氨水
【考点】物质的检验和鉴别的基本方法选择及应用.
【分析】只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的物质可以采用相互滴加的方法检验,滴加顺序不同,现象不同的可以鉴别.
【解答】解:A.将氯化铝溶液滴加到KOH溶液中先没有现象,后生成沉淀,将KOH滴到氯化铝溶液中先生成沉淀后沉淀消失,二者现象不同,可鉴别,故A不选;
B.Na2CO3溶液滴入稀盐酸中,立即产生气体,若将盐酸滴入Na2CO3溶液中,开始没有气体生成,后有气体生成,二者显现不同,可鉴别,故B不选;
C.向Na[Al(OH)4]溶液加盐酸,先有沉淀后沉淀消失,而向盐酸中加Na[Al(OH)4]溶液,先没有沉淀后生成沉淀,现象不同,能鉴别,故C不选;
D.无论将氨水滴到AlCl3溶液中还是将AlCl3溶液滴到氨水中都生成白色沉淀,现象相同,不能鉴别,故D选.
故选D.
21.下列说法中,正确的是( )
A.铁是人类在生产、生活中最早使用的金属
B.金、银、铜是应用最广泛的金属材料
C.钛被誉为“21世纪的金属”,应用前景很广阔
D.铜是导电性、导热性最好的黑色金属
【考点】常见金属元素的单质及其化合物的综合应用.
【分析】A、由于铜的活动性比较弱,以单质形式存在的比较多,在我国,距今4000年前的夏朝已经开始使用红铜,即天然铜.铁比铜活泼,到春秋时期才发现使用,铝的活动性比铁还强,难以炼制铝的单质,所以到近代才被大量应用;
B、世界上应用最广泛的金属材料是铁;
C、金属钛的机械强度搞,抗腐蚀能力强,被誉为21世纪的金属;
D、导体都能导电,但是常温下,导电能力是不同的,导电性从强到弱的是银、铜、铁.
【解答】解:A、由于铜的活动性比较弱,以单质形式存在的比较多,在我国,距今4000年前的夏朝已经开始使用红铜,即天然铜.铁比铜活泼,到春秋时期才发现使用,铝的活动性比铁还强,难以炼制铝的单质,所以到近代才被大量应用,是铜而非铁,故A错误;
B、世界上应用最广泛的金属材料是铁,故B错误;
C、金属钛的机械强度搞,抗腐蚀性能力强,被誉为21世纪的金属,故C正确;
D、导体都能导电,但是常温下,导电能力是不同的,导电性从强到弱的是银、铜、铁,最好的是银,故D错误;
故选C.
二、填空题(本题包括2小题,共19分)
22.在3NO2+H2O=2HNO3+NO反应中,被氧化的元素是 N ,被还原的元素是 N ;氧化剂是 NO2 ,还原剂是 NO2 ,氧化剂与还原剂的物质的量之比为 1:2 ;氧化产物是 HNO3 ,还原产物是 NO ;当有3molNO2参加反应时,转移电子总数为 2NA ,当转移4mol电子时,生成标准状况下的NO 44.8 升.
【考点】氧化还原反应.
【分析】3NO2+H2O═2HNO3+NO反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,根据化合价的变化计算.
【解答】解:3NO2+H2O═2HNO3+NO反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,被氧化的元素和被还原的元素都是N元素,所以NO2既是氧化剂也是还原剂,氧化剂被还原生成还原产物为NO,还原剂被氧化生成氧化产物为HNO3,氧化剂与还原剂的物质的量之比为1:2;当有3molNO2参加反应时,转移电子总数为2NA;当转移4mol电子时,生成NO为2mol,在标准状况下的体积为44.8L;
故答案为:N;
N;
NO2;
NO2;
1:2;
HNO3;NO;
2NA;
44.8.
23.(1)除去FeCl2溶液中混有的FeCl3,用 Fe粉 试剂除去,离子方程式为 2Fe3++Fe=3Fe2+
(2)除去FeCl3溶液中混有的FeCl2,用 氯水(Cl2) 试剂除去,离子方程式为 Cl2+2Fe2+═2Fe3+
(3)FeCl3溶液腐蚀铜箔线路板的离子方程式 2Cu+2Fe3+═2Fe2++Cu2+
(4)Na2O2与CO2反应的化学方程式 2Na2O2+2CO2═2Na2CO3+O2↑ .
【考点】物质的分离、提纯的基本方法选择与应用;离子方程式的书写.
【分析】(1)Fe能与氯化铁反应生成氯化亚铁;
(2)FeCl2可与氯气反应生成FeCl3;
(3)铁离子具有强氧化性,可氧化铜;
(4)Na2O2与CO2反应生成碳酸钠和氧气.
【解答】解:(1)Fe能与氯化铁反应生成氯化亚铁,则选择除杂试剂为Fe粉,发生的离子反应为2Fe3++Fe=3Fe2+,故答案为:Fe粉;2Fe3++Fe=3Fe2+;
(2)FeCl2可与氯气反应生成FeCl3,可加入氯水或通入氯气,反应的离子方程式为Cl2+2Fe2+═2Fe3+,故答案为:氯水(Cl2);
Cl2+2Fe2+═2Fe3+;
(3)铁离子具有强氧化性,可氧化铜,反应的离子方程式为2Cu+2Fe3+═2Fe2++Cu2+,故答案为:2Cu+2Fe3+═2Fe2++Cu2+;
(4)Na2O2与CO2反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2↑,故答案为:2Na2O2+2CO2═2Na2CO3+O2↑.
三、推断题(共12分)
24.A、B、C、D、E五种化合物,均含有某种常见金属元素,A中又含有钾元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的具有两性的白色固体,E易溶于水.
试回答:
(1)写出化学式
A KAlO2 ,C A12O3 ,D AlCl3 ,E NaAlO2
(2)写出下列反应的离子方程式:
A→B AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ ,F→E 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ .
(3)写出下列反应的化学方程式:
F→C 2Al+Fe2O3Al2O3+2Fe ,B→E Al(OH)3+NaOH=NaAlO2+2H2O .
【考点】无机物的推断.
【分析】A、B、C、D、E五种化合物,均含有某种常见金属元素,A中又含有钾元素,且A为澄清溶液,C为难溶的具有两性的白色固体,根据图示可知B能够与NaOH溶液反应生成E,E易溶于水,则A为KAlO2,B为Al(OH)3,C为A12O3,E为NaAlO2;A与过量盐酸反应生成D,则D为AlCl3;F在高温下能够生成C(A12O3),还能够与盐酸反应生成D(AlCl3),则F为金属Al,据此结合对应物质的性质进行解答.
【解答】解:A、B、C、D、E五种化合物,均含有某种常见金属元素,A中又含有钾元素,且A为澄清溶液,C为难溶的具有两性的白色固体,根据图示可知B能够与NaOH溶液反应生成E,E易溶于水,则A为KAlO2,B为Al(OH)3,C为A12O3;A与过量盐酸反应生成D,则D为AlCl3;F在高温下能够生成C(A12O3),还能够与盐酸反应生成D(AlCl3),则F为金属Al,
(1)根据分析可知,A为KAlO2,C为A12O3,D为AlCl3,E为NaAlO2,
故答案为:KAlO2;A12O3;AlCl3;NaAlO2;
(2)A→B的反应为AlO2﹣和Al(OH)3的转化,反应的离子方程式为:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;
F→E为Al与氢氧化钠溶液的反应,反应的离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
故答案为:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(3
)
F→C可以为Al在高温下与氧化铁反应生成氧化铝和铁,反应的化学方程式为:2Al+Fe2O3Al2O3+2Fe;
B→E为氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:2Al+Fe2O3Al2O3+2Fe;Al(OH)3+NaOH=NaAlO2+2H2O.
四、计算题
25.钙元素是人体必需的常量元素,所有细胞都需要钙元素.正常人体血液含Ca2+为2.2×10﹣3~2.7×10﹣3
mol/L.先抽取某人血样10mL,稀释后用草酸铵
(NH4)2C2O4]溶液处理,使Ca2+完全变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0mL
5.0×10﹣3
mol/L
KMnO4溶液与溶解得到的草酸恰好完全反应.求此人血液中Ca2+的浓度,并判断其血液含钙量是否正常.(提示:2KMnO4+5H2C2O4+3H2SO4=2MnO4+K2SO4+10CO2+8H2O)
【考点】化学方程式的有关计算.
【分析】根据方程式计算草酸钙的物质的量,根据元素守恒可知血液中钙离子物质的量再计算浓度.
【解答】解:消耗高锰酸钾的物质的量为:5.0×10﹣3mol/L×0.002L=1×10﹣5mol,
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O
2
5
1×10﹣5mol
n(H2C2O4)
=,
n(H2C2O4)=2.5×10﹣5mol,
C2O42﹣﹣﹣﹣﹣﹣H2C2O4﹣﹣﹣﹣CaC2O4﹣﹣﹣Ca2+
1
1
1
1
2.5×10﹣5mol
n(Ca2+)
n(Ca2+)=2.5×10﹣5mol
CCa2+)===2.5×10﹣3mol/L,
浓度为mol=2.5×10﹣3
mol/L,介于2.2×10﹣3~2.7×10﹣3
mol/L之间,所以此人健康,
答:此人血液中的Ca2+的物质的量浓度为2.5×10﹣3
mol/L,此人健康.
2016年11月3日
同课章节目录
