人教版高一化学必修一第二章第一节(分散系胶体)课件 (共51张PPT)
文档属性
| 名称 | 人教版高一化学必修一第二章第一节(分散系胶体)课件 (共51张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-11-04 05:48:11 | ||
图片预览








文档简介
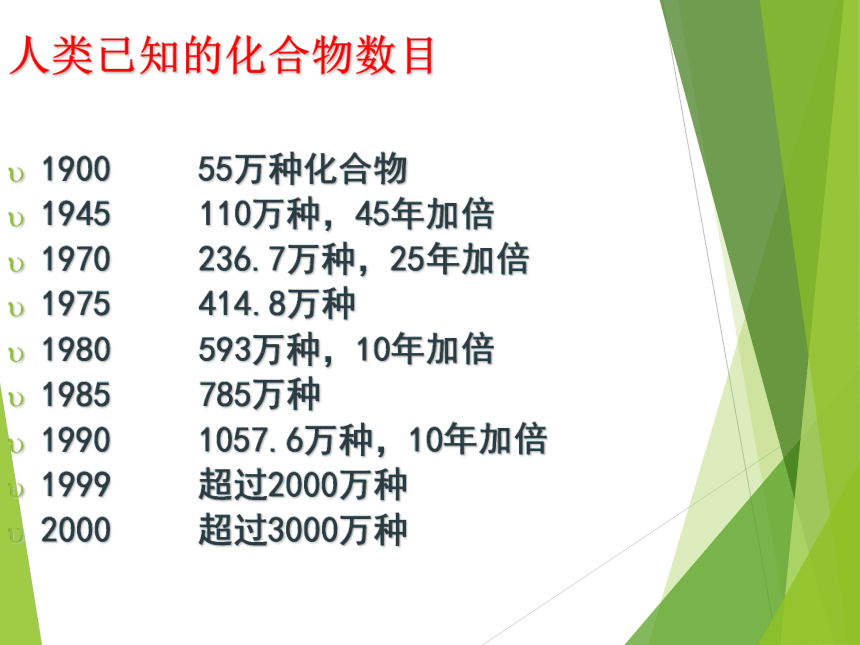
课件51张PPT。第一节 物质的分类图书馆里有许许多多的书籍,为什么你很快就找到你需要的书?人类已知的化合物数目1900 55万种化合物
1945 110万种,45年加倍
1970 236.7万种,25年加倍
1975 414.8万种
1980 593万种,10年加倍
1985 785万种
1990 1057.6万种,10年加倍
1999 超过2000万种
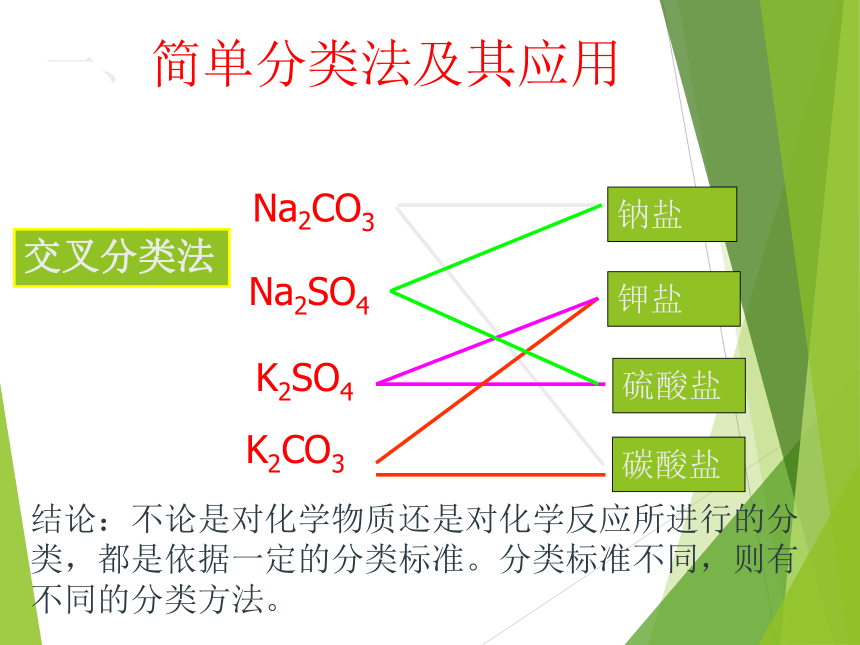
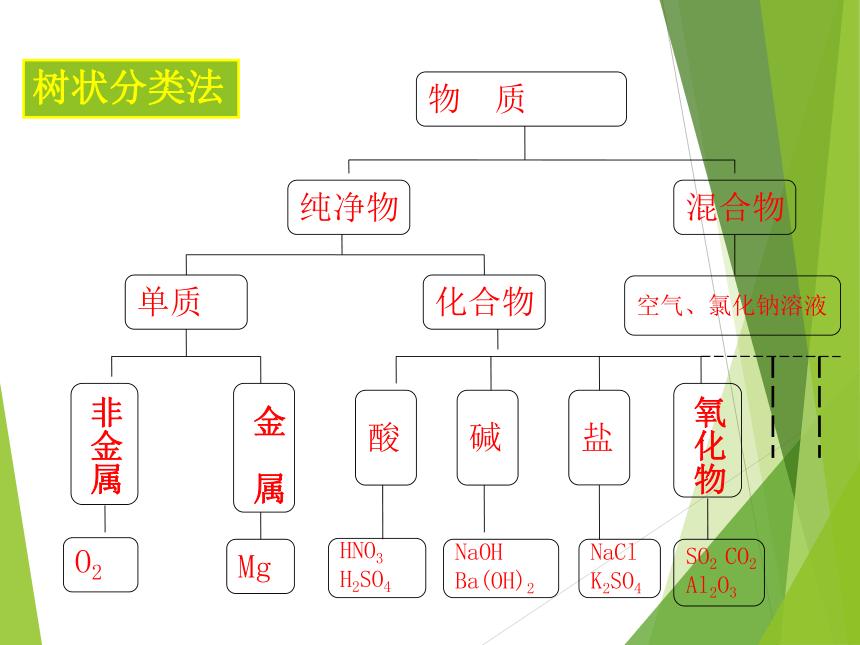
2000 超过3000万种 分类法是把某些特征相似的物体归类到一起的方法。常言道:物以类聚Na2SO4Na2CO3K2CO3K2SO4钠盐钾盐硫酸盐碳酸盐交叉分类法结论:不论是对化学物质还是对化学反应所进行的分类,都是依据一定的分类标准。分类标准不同,则有不同的分类方法。 一、简单分类法及其应用物 质纯净物混合物空气、氯化钠溶液化合物单质盐碱酸O2MgHNO3
H2SO4NaOH
Ba(OH)2NaCl
K2SO4SO2 CO2
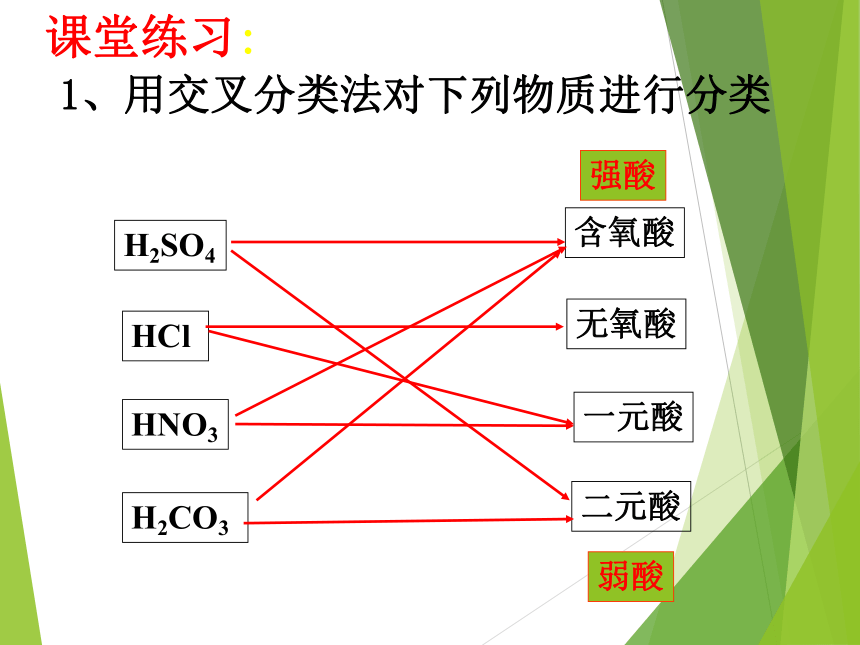
Al2O3树状分类法含氧酸无氧酸一元酸二元酸1、用交叉分类法对下列物质进行分类H2SO4HClHNO3H2CO3 课堂练习:二、分散系及其分类 阅读教材,完成以下问题: (1)什么是分散系? (2)按分散质或分散剂的聚集状态(气态、液态、固态),它们之间可以组合形成几种分散系? 1、分散系:
把一种(或多种)物质分散在另一种 (或多种)物质中所得到的体系。
2、分散质::被分散的物质
3、分散剂:能够分散其他物质的物质一、分散系、分散质、分散剂 二、分散系的分类:(1)按照分散质或分散剂的聚集状态:
(气、液、固)来分,有9种类型。分散质分散剂气 态液 态固 态固 态液 态气 态空气云、雾烟、灰尘泡沫、汽水牛奶、酒精的水溶液糖水、油漆、泥水泡沫塑料、面包珍珠(包藏着水的碳酸钙)有色玻璃、合金常见的一些分散系 当分散剂是水或其它液体时,如果按照分散质粒子的大小来分类,分散系可以分为哪几类?(2)分散剂是液体时, 思考与交流:
它们的分散质粒子大小不同﹑性质有何区别?按分散质粒子的大小可分为3种 :
A、溶液(d<1nm)
B、胶体(1nm<d<100nm)
C、浊液(d>100nm)
注:1nm=10-9m d为粒子直径分散系胶 体浊 液溶 液悬浊液乳浊液 从稳定性角度 : 溶液——————————_
胶体————————
浊液——————-————————,
最稳定、均一的最不稳定、不均一的介于二者之间.认识几种常见胶体三、胶体的性质1、丁达尔效应: Fe(OH)3胶体是怎样制备出来的?又如何来区分溶液、胶体和浊液呢?想一想1.取3个小烧杯,分别加入25ml 蒸馏水、 25ml CuSO4溶液和25ml泥水。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~ 6滴 FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热。观察制得的Fe(OH)3胶体,并与CuSO4溶液和泥水比较。观察并思考:
(1)、三个烧杯得到的分别是哪种分散系?
(2)、如何区分这三种分散系?2.把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。CuSO4溶液Fe(OH)3胶体无光亮的“通路”有光亮的“通路” 当可见光束通过胶体时,在入射光侧面可观察到明亮的“通路”,这种现象叫做丁达尔效应。丁达尔效应:形成一条光亮的通路无光现象产生溶液中粒子的直径小于1nm,散射极其微弱胶体的直径在1-100nm之间,能使光波发生散射.实验现象记录 结论1、胶体有丁达尔效应,溶液没有,可以此区分溶液及胶体。
说明胶体分散质粒子比溶液分散质粒子大。电影放映时的丁达尔效应丁达尔效应——早晨的阳光射入森林的美丽景象丁 达 尔 效 应3.将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象。滤纸上无滤渣,滤液颜色不变,(无现象)在滤纸上带有泥沙,由浑浊变澄清结论2、胶体能透过滤纸,而悬浊液无法通过滤纸, 说明胶体粒子比悬浊液粒子小。2、渗析思考:如何分离胶体和溶液?(半透膜:只能容许某些分子或离子通过的薄膜) 利用半透膜把胶体中混有的离子或分子从胶体溶液里分离的操作,叫做渗析。
其原理为胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。 由于胶体微粒直径在1nm~100nm之间,所以可以通过滤纸,不能通过半透膜。一定时间之后,
烧杯中能够检测出的是:
检测不出的是:盛有淀粉胶体和食盐溶液的半透膜浸在蒸馏水中-分离提纯的一种方法渗析氯化钠淀粉3、电泳:
胶体粒子带有电荷(胶体能稳定存在主要原因)
电场作用下胶体有什么表现?阴极附近的颜色逐渐变深,阳极附近的颜色逐渐变浅.在外加电场作用下, 胶体粒子在分散剂里向电极 (阴极或阳极) 作定向移动的现象, 叫做电泳。电泳:原因:粒子胶体微粒带同种电荷,当胶粒带正电荷时向阴极运动,当胶粒带负电荷时向阳极运动。胶体能发生电泳及稳定的原因:
在外加电场作用下,胶粒定向移动产生电泳现象,这是因为胶体粒子具有相对较大的表面积,能吸附离子而带正电荷或负电荷。由于同一胶体粒子带同种电荷,具有静电斥力,这是胶体稳定的主要原因。
4、布朗运动:
胶体相对稳定的次要因素
——思路:中和胶体微粒表面吸附的电荷,减弱胶粒间的电性排斥,从而使之聚集成大颗粒沉淀下来。应用实例:
豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐;1.加入少量电解质5.胶体的聚沉定义:使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出的过程叫做聚沉。——思路:带不同电荷的胶体微粒相互吸引发生电性中和,从而在胶粒碰撞时发生凝聚,形成沉淀。应用实例:
用明矾、氯化铁等净水加入胶粒带相反电荷的胶体加热——思路:加速胶粒碰撞,减弱胶粒的吸附能力使得胶粒在碰撞时容易结合成大颗粒,形成沉淀。应用实例:
淀粉溶液加热后凝聚成了浆糊凝胶
蛋清加热后凝聚成了白色胶状物。小结:溶液、胶体与浊液三类分散系的比较。均一、透明、
稳定均一、透明
较稳定、不均一、不透
明、不稳定能
能
不能
食盐水
碘酒
Fe(OH)3胶体泥水
油水混合物无丁达尔效应有丁达尔效应无丁达尔效应 溶液、胶体、浊液的本质区别是粒子直径的大小强调1.用特殊方法把固体物质加工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液 C、胶体 D、乳浊液
c 2、下列不属于胶体的是[ ]
A.水银 B.烟、云、雾
C.有色玻璃 D.淀粉溶液
3、鉴别胶体和溶液可以采取的方法是 [ ]
A.蒸发 B.从外观观察
C.稀释 D.利用丁达尔效应 AD4 . Fe(OH)3胶体和MgCl2溶液共同具备的性质是[ ]
A.都不稳定,密封放置会产生沉淀
B.都有丁达尔现象 C.加入足量盐酸,均可发生化学反应 D.分散质微粒均可透过滤纸
5.下列分离物质的方法中,据微粒大小进行分离[ ]
A.萃取 B.重结晶 C.沉降 D.过滤
DD6、下列事实与胶体性质无关的是( )
A. 在豆浆里加入盐卤做豆腐
B.盐碱地里土壤保肥能力差
C. 一束平行光照射蛋白质溶液时,从侧面可以看到一条光亮的通路
D. 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀D7、已知土壤胶体胶粒带负电荷,又有很大的表面积,因而具有选择吸附能力,在土壤里施用含氮量相同的下列化肥,肥效较差的是( )
A.(NH4)2SO4 B. NH4HCO3
C.NH4NO3 D. NH4ClC 8、各组中都有一种物质与其他几种物质在分类上不同,试分析每组物质组成上的规律,将这种不同于其它物质的物质找出来。
⑴ NaCl、KCl、NaClO、BaCl2
⑵ HClO3、KClO3、Cl2、NaClO3
⑶ H3PO4、H4SiO4、HCl、H2SO4
⑷ 空气、N2、HCl气体、CuSO4·5H2O
⑸ Cu、Au、Hg、NaNaClOCl2HCl空气Hg or Na9、将某溶液逐滴加入Fe(OH)3溶胶内,开始产生沉淀,继续滴加沉淀又溶解,该溶液是( )
(A)2molLNaOH (B)2molL H2SO4
(C)2molLMgSO4 (D)硅酸溶胶 B
1945 110万种,45年加倍
1970 236.7万种,25年加倍
1975 414.8万种
1980 593万种,10年加倍
1985 785万种
1990 1057.6万种,10年加倍
1999 超过2000万种
2000 超过3000万种 分类法是把某些特征相似的物体归类到一起的方法。常言道:物以类聚Na2SO4Na2CO3K2CO3K2SO4钠盐钾盐硫酸盐碳酸盐交叉分类法结论:不论是对化学物质还是对化学反应所进行的分类,都是依据一定的分类标准。分类标准不同,则有不同的分类方法。 一、简单分类法及其应用物 质纯净物混合物空气、氯化钠溶液化合物单质盐碱酸O2MgHNO3
H2SO4NaOH
Ba(OH)2NaCl
K2SO4SO2 CO2
Al2O3树状分类法含氧酸无氧酸一元酸二元酸1、用交叉分类法对下列物质进行分类H2SO4HClHNO3H2CO3 课堂练习:二、分散系及其分类 阅读教材,完成以下问题: (1)什么是分散系? (2)按分散质或分散剂的聚集状态(气态、液态、固态),它们之间可以组合形成几种分散系? 1、分散系:
把一种(或多种)物质分散在另一种 (或多种)物质中所得到的体系。
2、分散质::被分散的物质
3、分散剂:能够分散其他物质的物质一、分散系、分散质、分散剂 二、分散系的分类:(1)按照分散质或分散剂的聚集状态:
(气、液、固)来分,有9种类型。分散质分散剂气 态液 态固 态固 态液 态气 态空气云、雾烟、灰尘泡沫、汽水牛奶、酒精的水溶液糖水、油漆、泥水泡沫塑料、面包珍珠(包藏着水的碳酸钙)有色玻璃、合金常见的一些分散系 当分散剂是水或其它液体时,如果按照分散质粒子的大小来分类,分散系可以分为哪几类?(2)分散剂是液体时, 思考与交流:
它们的分散质粒子大小不同﹑性质有何区别?按分散质粒子的大小可分为3种 :
A、溶液(d<1nm)
B、胶体(1nm<d<100nm)
C、浊液(d>100nm)
注:1nm=10-9m d为粒子直径分散系胶 体浊 液溶 液悬浊液乳浊液 从稳定性角度 : 溶液——————————_
胶体————————
浊液——————-————————,
最稳定、均一的最不稳定、不均一的介于二者之间.认识几种常见胶体三、胶体的性质1、丁达尔效应: Fe(OH)3胶体是怎样制备出来的?又如何来区分溶液、胶体和浊液呢?想一想1.取3个小烧杯,分别加入25ml 蒸馏水、 25ml CuSO4溶液和25ml泥水。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~ 6滴 FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热。观察制得的Fe(OH)3胶体,并与CuSO4溶液和泥水比较。观察并思考:
(1)、三个烧杯得到的分别是哪种分散系?
(2)、如何区分这三种分散系?2.把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。CuSO4溶液Fe(OH)3胶体无光亮的“通路”有光亮的“通路” 当可见光束通过胶体时,在入射光侧面可观察到明亮的“通路”,这种现象叫做丁达尔效应。丁达尔效应:形成一条光亮的通路无光现象产生溶液中粒子的直径小于1nm,散射极其微弱胶体的直径在1-100nm之间,能使光波发生散射.实验现象记录 结论1、胶体有丁达尔效应,溶液没有,可以此区分溶液及胶体。
说明胶体分散质粒子比溶液分散质粒子大。电影放映时的丁达尔效应丁达尔效应——早晨的阳光射入森林的美丽景象丁 达 尔 效 应3.将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象。滤纸上无滤渣,滤液颜色不变,(无现象)在滤纸上带有泥沙,由浑浊变澄清结论2、胶体能透过滤纸,而悬浊液无法通过滤纸, 说明胶体粒子比悬浊液粒子小。2、渗析思考:如何分离胶体和溶液?(半透膜:只能容许某些分子或离子通过的薄膜) 利用半透膜把胶体中混有的离子或分子从胶体溶液里分离的操作,叫做渗析。
其原理为胶体微粒不能透过半透膜,而溶液中的分子和离子能透过半透膜。 由于胶体微粒直径在1nm~100nm之间,所以可以通过滤纸,不能通过半透膜。一定时间之后,
烧杯中能够检测出的是:
检测不出的是:盛有淀粉胶体和食盐溶液的半透膜浸在蒸馏水中-分离提纯的一种方法渗析氯化钠淀粉3、电泳:
胶体粒子带有电荷(胶体能稳定存在主要原因)
电场作用下胶体有什么表现?阴极附近的颜色逐渐变深,阳极附近的颜色逐渐变浅.在外加电场作用下, 胶体粒子在分散剂里向电极 (阴极或阳极) 作定向移动的现象, 叫做电泳。电泳:原因:粒子胶体微粒带同种电荷,当胶粒带正电荷时向阴极运动,当胶粒带负电荷时向阳极运动。胶体能发生电泳及稳定的原因:
在外加电场作用下,胶粒定向移动产生电泳现象,这是因为胶体粒子具有相对较大的表面积,能吸附离子而带正电荷或负电荷。由于同一胶体粒子带同种电荷,具有静电斥力,这是胶体稳定的主要原因。
4、布朗运动:
胶体相对稳定的次要因素
——思路:中和胶体微粒表面吸附的电荷,减弱胶粒间的电性排斥,从而使之聚集成大颗粒沉淀下来。应用实例:
豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐;1.加入少量电解质5.胶体的聚沉定义:使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出的过程叫做聚沉。——思路:带不同电荷的胶体微粒相互吸引发生电性中和,从而在胶粒碰撞时发生凝聚,形成沉淀。应用实例:
用明矾、氯化铁等净水加入胶粒带相反电荷的胶体加热——思路:加速胶粒碰撞,减弱胶粒的吸附能力使得胶粒在碰撞时容易结合成大颗粒,形成沉淀。应用实例:
淀粉溶液加热后凝聚成了浆糊凝胶
蛋清加热后凝聚成了白色胶状物。小结:溶液、胶体与浊液三类分散系的比较。均一、透明、
稳定均一、透明
较稳定、不均一、不透
明、不稳定能
能
不能
食盐水
碘酒
Fe(OH)3胶体泥水
油水混合物无丁达尔效应有丁达尔效应无丁达尔效应 溶液、胶体、浊液的本质区别是粒子直径的大小强调1.用特殊方法把固体物质加工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液 C、胶体 D、乳浊液
c 2、下列不属于胶体的是[ ]
A.水银 B.烟、云、雾
C.有色玻璃 D.淀粉溶液
3、鉴别胶体和溶液可以采取的方法是 [ ]
A.蒸发 B.从外观观察
C.稀释 D.利用丁达尔效应 AD4 . Fe(OH)3胶体和MgCl2溶液共同具备的性质是[ ]
A.都不稳定,密封放置会产生沉淀
B.都有丁达尔现象 C.加入足量盐酸,均可发生化学反应 D.分散质微粒均可透过滤纸
5.下列分离物质的方法中,据微粒大小进行分离[ ]
A.萃取 B.重结晶 C.沉降 D.过滤
DD6、下列事实与胶体性质无关的是( )
A. 在豆浆里加入盐卤做豆腐
B.盐碱地里土壤保肥能力差
C. 一束平行光照射蛋白质溶液时,从侧面可以看到一条光亮的通路
D. 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀D7、已知土壤胶体胶粒带负电荷,又有很大的表面积,因而具有选择吸附能力,在土壤里施用含氮量相同的下列化肥,肥效较差的是( )
A.(NH4)2SO4 B. NH4HCO3
C.NH4NO3 D. NH4ClC 8、各组中都有一种物质与其他几种物质在分类上不同,试分析每组物质组成上的规律,将这种不同于其它物质的物质找出来。
⑴ NaCl、KCl、NaClO、BaCl2
⑵ HClO3、KClO3、Cl2、NaClO3
⑶ H3PO4、H4SiO4、HCl、H2SO4
⑷ 空气、N2、HCl气体、CuSO4·5H2O
⑸ Cu、Au、Hg、NaNaClOCl2HCl空气Hg or Na9、将某溶液逐滴加入Fe(OH)3溶胶内,开始产生沉淀,继续滴加沉淀又溶解,该溶液是( )
(A)2molLNaOH (B)2molL H2SO4
(C)2molLMgSO4 (D)硅酸溶胶 B
