湖北省武汉市第二中学2016-2017学年高二上学期期中考试化学试题
文档属性
| 名称 | 湖北省武汉市第二中学2016-2017学年高二上学期期中考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 810.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-11-11 11:18:29 | ||
图片预览




文档简介
武汉二中2016-2017学年度上学期期中考试
高二化学试卷
考试时间:2016年11月10日上午10:30-12:00
试卷满分:100分
可能用到的相对原子质量:H:1
C:12
N:14
O:16
Cu:64
Fe:56
一、选择题(每小题均只有一个选项,共48分。)
1.
化学无处不在,下列与化学知识有关的说法不正确的是(
)
A.可用三氯化铝对自来水进行杀菌消毒
B.热的纯碱溶液可用于去油污
C.利用中和滴定原理可测定NaOH和NaCl混合液中NaCl的含量
D.用氯化铵浓溶液可除去铁器表面的铁锈
2.
化学与生产、生活密切相关,下列叙述中正确的是(
)
A.铜制品在潮湿空气中生锈,其主要原因是发生了析氢腐蚀.
B.铜的电解精炼工业中,沉积在电解槽底部的阳极泥可作为提炼金、银等贵重金属的原料
C.泡沫灭火器中所装试剂为Na2CO3和Al2(SO4)3
D.从海水中可以制取NaCl,电解饱和NaCl溶液可以制金属Na
3.
准确移取20.00mL草酸溶液于锥形瓶中,用0.1000
mol
·
L-1KOH溶液滴定。下列说法不正确的是(
)
A.
碱式滴定管用蒸馏水洗涤之后装入KOH标准溶液,并读数
B.
选择酚酞作指示剂,终点时溶液由无色刚好变成粉红色且半分钟不褪色
C.
锥形瓶中从滴定开始到滴定终点时,水电离的c(H+)由小逐渐增大
D.
滴定终点时,发现滴定管尖嘴处有气泡,则测定结果偏低
4.
用惰性电极电解下列物质的溶液,一段时间后,再加入一定质量的另一物质(括号内),溶液一定不能与原来溶液一样的是(
)
A.
CuCl2[CuCl2]
B.
AgNO3[Ag2O]
C.
NaCl[NaCl]
D.
CuSO4[Cu(OH)2]
5.
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是(
)
A.pH=4的HCl溶液中H2O电离出的c(H+)=10-4
mol.L-1
B.曲线I为CH3COOH溶液的稀释曲线
C.a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质
的量相等
D.a、b、c三点溶液中Kw:c=b6.
电解质溶液的电导率越大,导电能力越强。用0.1
mol·
L-1的NaOH溶液分别滴定体积均为10.00
mL浓度均为0.1
mol
·
L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是(
)
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05
mol.L-1
C.在相同温度下,A、B、C三点溶液中水电离的c(H+):BD.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
7.
最近,科学家用氮化镓材料与铜组装如
( http: / / www.21cnjy.com )图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2。下列有关说法中正确的是(
)
A.该装置只有化学能转化为电能
B.氮化镓电极是阴极
C.导线中经过2
mol的电子,氮化镓电极生成1
molO2
D.铜电极表面的电极反应式:CO2+8e-+8H+===
CH4+2H2O
8.
常温下,下列有关溶液pH的相关说法正确的是(
)
A.将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13
mol
·
L-1
B.将pH=9的氢氧化钠溶液和pH=13的氢氧化钡溶液等体积混合,所得混合溶液的pH=11
C.将pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,由于氢氧化钡过量,所得溶液的pH>7
D.将pH=1的硫酸和pH=5的盐酸等体积混合,所得混合溶液的pH=1.3
9.
已知等浓度的HF和NaF的混合溶液呈酸性,溶液中存在以下平衡:①HFF-+H+;②F-+H2OHF+OH-。常温下,向c(HF)+c(NaF)=0.1
mol
·
L-1的溶液中分别加入以下物质,下列有关说法不正确的是(
)
A.加入少量Na2CO3固体,平衡①右移,平衡②左移,溶液中c(F-)增大
B.加入少量NaOH固体至c(F-)>c(HF),溶液一定呈碱性
C.加入少量Na至pH=8,则C(Na+)-c(F-)=0.99
×10-7mol·L-1
D.加入少量盐酸,不变
10.
有4种混合溶液,分别由等体积0.1的两种溶液混合而成:①NH4Cl与CH3COONa;②NH4Cl与HCl;③NH4Cl与NaCl;④NH4Cl与NH3·H2O(混合溶液呈碱性)。下列各项排序正确的是(
)
A.
pH:②<①<③<④
B.
溶液中c(H+):①<③<②<④
C.
c(NH4+)①<③<②<④
D.
c(NH3·H2O):①<③<④<②
11.
下列指定溶液中一定能大量共存的离子组是
(
)
A.,,,
B.含有大量的溶液中:
C.中性溶液中:
D.溶液中:
12.
一定温度下,将0.1molAgCl
( http: / / www.21cnjy.com )固体加入1L
0.1mol·L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是(
)
A、沉淀转化反应2AgCl(s)+
CO32-(aq)Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1
B、约有2×10-5mol
AgCl溶解
C、反应后溶液中的:c(Na+)>c
(CO32-)
>c
(Ag+)>c
(Cl-)
>c
(H+)
D、反应后溶液中的:c(Na+)+
c
(Ag+)+
c
(H+)=c
(CO32-)+
c
(HCO3-)+
c
(Cl-)
+c
(OH-)
13、已知25℃时,CaS
( http: / / www.21cnjy.com )O4在水中的沉淀溶解平衡曲线如图所示,向100
mL该条件下的CaSO4饱和溶液中加入400
mL
0.01
mol·L-1Na2SO4溶液,针对此过程的下列叙述正确的是( )
A、溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来的大
B、溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C、溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D、溶液中无沉淀析出,但最终溶液中c(SO42-)较原来的大
14.常温下,向20ml某浓度的硫酸溶液中滴入0.1mol·l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是(
)
A.
d点所示溶液中:c(NH4+)=2c(SO42-)
B.
c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.
V=40
D.
NH3.H2O的电离常数K=10-4
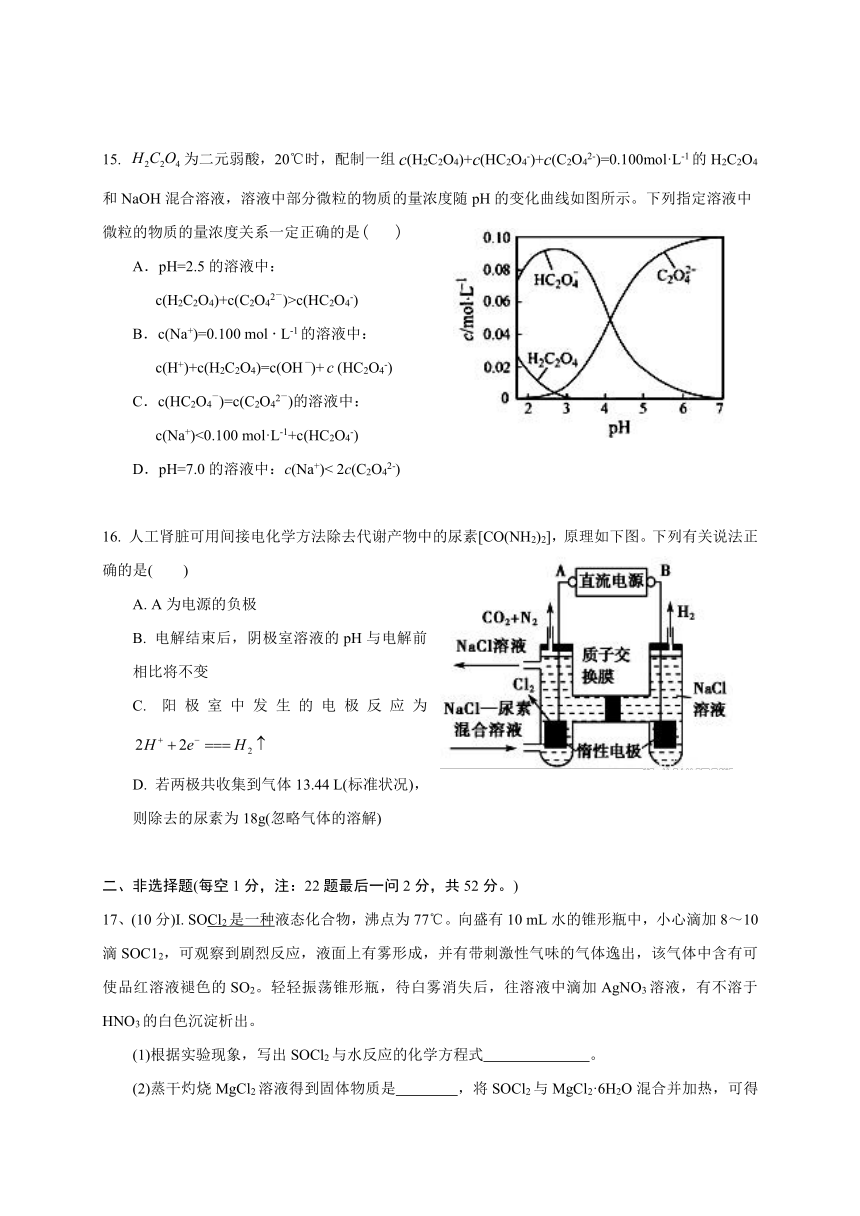
15.
为二元弱酸,20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是(
)
A.pH=2.5的溶液中:
c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B.c(Na+)=0.100
mol
·
L-1的溶液中:
c(H+)+c(H2C2O4)=c(OH-)+(HC2O4-)
C.c(HC2O4-)=c(C2O42-)的溶液中:
c(Na+)<0.100
mol·L-1+c(HC2O4-)
D.pH=7.0的溶液中:c(Na+)<
2c(C2O42-)
16.
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如下图。下列有关说法正确的是(
)
A.
A为电源的负极
B.
电解结束后,阴极室溶液的pH与电解前相比将不变
C.
阳极室中发生的电极反应为
D.
若两极共收集到气体13.44
L(标准状况),则除去的尿素为18g(忽略气体的溶解)
二、非选择题(每空1分,注:22题最后一问2分,共52分。)
17、(10分)I.
SOCl2是一种
( http: / / www.21cnjy.com )液态化合物,沸点为77℃。向盛有10
mL水的锥形瓶中,小心滴加8~10滴SOC12,可观察到剧烈反应,液面上有雾形成,并有带刺激性气味的气体逸出,该气体中含有可使品红溶液褪色的SO2。轻轻振荡锥形瓶,待白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。
(1)根据实验现象,写出SOCl2与水反应的化学方程式
。
(2)蒸干灼烧MgCl2溶液得到固体物质是
,将SOCl2与MgCl2·6H2O混合并加热,可得到无水MgCl2,
其原因为
(结合化学用语回答)
II.
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4
mol电子时铁电极的质量减少11.2
g。请回答
下列问题。
(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极产物共
( http: / / www.21cnjy.com ) g,Cu电极的电极反应式是 ,CuSO4溶液的浓度
(填“减小”、“增大”或“不变”)
(3)把物质的量均为0.1mol的AlCl3
( http: / / www.21cnjy.com )、CuCl2和H2SO4溶于水制成100mL的混合溶液,用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是(
)
A.
阳极得到的气体中有0.35mol
O2
B.
铝元素以Al(OH)3、Al3+的形式存在
C.
阴极质量增加3.2g
D.
电路中共转移0.9mol电子
18、(9分)I.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来。
已知:①甲品牌充电宝属于锂钒氧化物凝胶电池,其电池总反应为LixV2O5
②乙品牌充电宝工作原理如图所示,该电池的总反应式为Li1-xMnO2+LixC6LiMnO2+C6(LixC6表示锂原子嵌入石墨形成的复合材料):
请回答下列问题:
(1)甲品牌充电宝放电时,正极的电极反应式为
。
(2)图中K与N相接时,负极的电极反应式为
,
Li+由
区迁移到
区。
(填写“A”或“B”)
(3)图中K与M相接时,阳极的电极反应式为
。
II.
某兴趣小组用如图装置做了两次实验,不可思议地用原电池完成总反应:H++OH-=H2O
实验①:向甲池的Pt电极表面通氢气,发现电流计指针发生了偏转,乙池的Pt电极表面出现气泡。
实验②:向乙池的Pt电极表面通入另一气体,发现电流计指针也发生了偏转,且偏转方向与实验①相同,同时甲池的Pt电极表面也出现气泡。
( http: / / www.21cnjy.com )
(1)实验①,甲池通氢气的
( http: / / www.21cnjy.com )Pt电极为
极,电极反应式为__________________________________________。
(2)实验②中乙池中通入
( http: / / www.21cnjy.com )气体为______________,甲池电解质溶液为____________________________________________。
19、(8分)下表是不同温度下水的离子积常数:
温度/℃
25
90℃
100℃
水的离子积常数
3.8×10-13
试回答以下问题:
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=
(保留三位有效数字)。
(2)25℃时,将pH=11的苛性钠溶液与的稀硫酸混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
。此溶液中各种离子的浓度由大到小的顺序是
。
(3)假设H2SO4是强酸,但
( http: / / www.21cnjy.com )常温下0.1mol·L-1H2SO4的溶液中c(H+)=0.11mol·L-1,则Na2SO4溶液呈 性(填“酸”、“碱”或“中”),0.1mol·L-1的NaHSO4溶液的c(H+) 0.01mol·L-1(填“>”、“<”或“=”)
H2SO4溶液与Na2SO4溶液反应的离子方程式为
。
(4)25℃时pH=5的H2SO4溶液
( http: / / www.21cnjy.com )加水稀释到10倍,则稀释后c(SO)与c(H+)的比值为________________;加水稀释到100倍,则稀释后c(SO)与c(H+)的比值为__________________;
20、(7分)某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分
的含量。制备流程示意图如下。
( http: / / www.21cnjy.com )
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1
mol
·
L-1计算)如下表所示。
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0
mol·
( http: / / www.21cnjy.com )L-1稀硝酸250
mL。需要的玻璃仪器有烧杯、量筒、玻璃棒,胶头滴管和
。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为
。
(3)步骤(b)首先加入试剂x调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是
②试剂X可以是
(填标号)。
A.H2SO4
B.Ni(OH)2
C.NaOH
D.Fe2O3
E.NiO
(4)步骤(c)和(d)中的反应都需要在冰水浴环境下进行,其作用除了可以减少氨水的挥发.还有
。
(5)NH3含量的测定。[已知:Ni(NH3)6Cl2+6HCl=
NiCl2+6NH4Cl]
i.用电子天平称量mg产品于锥形瓶中,
用25mL水溶解后加入5
mL的6mol
·
L-1盐酸,以甲基橙作指示剂,滴定至终点消耗0.500
0
mol·L-1
NaOH标准溶液V1
mL。
ii.空白试验:不加入样品重复实验i。消耗NaOH标准溶液V2
mL。
①NH3的质量分数为
。
②在上述方案的基础上,下列措施中能进一步提高测定准确度的有
(填标号)。
A.适当提高称量产品的质量
B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙
D.进行平行试验
21、(9分)I.
水是重要的自然资源,与人类的发展密切相关。铁酸铜(CuFe2O4)是很有前景的热化学循环分解水制氢的材料
i.某课外小组制备铁酸铜(CuFe2O4)的流程如下:
( http: / / www.21cnjy.com )
搅拌I所得溶液中Fe(NO3)3、Cu(NO3)2的物质的量浓度分别为2.6
mol·L-l、1.3
mol·L-1。
(1)搅拌I所得溶液中Fe元素的存在形式有Fe3+和
(填化学式)。
(2)搅拌II要跟踪操作过程的pH变化。在滴加KOH溶液至pH=4的过程中(假设溶液体积不变),小组同学绘制了溶液中c(Fe3+)、c(Cu2+)随pH变化的曲线(如下图),其中正确的是
(用“A”“B”填空)。已知:Ksp[Fe(OH)3]=2.6x10-39、Ksp
[Cu(OH)2]=2.2x10-20。
(3)操作III为
、
。
ii.
在热化学循环分解水制氢的过程中,
( http: / / www.21cnjy.com )铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(4)氧缺位体与水反应制氢的化学方程式为
。
(5)课外小组将铁酸铜样品在N2的气
( http: / / www.21cnjy.com )氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=
。
II.
化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,
同时获得氢气:,工作原理如图1所示。装置通电后,铁电极附近生成紫红色,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:只在强碱性条件下稳定,易被H2还原。
(1)电解一段时间后,c(OH-)降低的区域在
(填“阴极室”或“阳极室”)
(2)电解过程中,须将阴极产生的气体及时排出,其原因为
.
(3)c(Na2FeO4)随初始c(N
( http: / / www.21cnjy.com )aOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:
22、(9分)(1)三种弱酸电离常数为1.8×,5.6×、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA+HB-(少量)===A-+H2B;
②H2B(少量)+C-===HB-+HC;③HA(少量)+C-==A-+HC。
若H2B的Ka1=4.3×10
( http: / / www.21cnjy.com )-7,则另两种酸对应的电离常数分别为(根据已知数据填空):HA的Ka=
,
HC的Ka=
(2)25℃时0.1
mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、
R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为
(填化学式)。
(3)常温下,H3PO4与NaOH溶液
( http: / / www.21cnjy.com )反应的体系中,含磷各物质的分布分数(平衡时某物质的浓度与各物质浓度之和的比值)与pH的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是(
)
( http: / / www.21cnjy.com )
A.
H3PO4的Ka3=10-12.2,
HPO42-的水解平衡常数为10-6.8
B.
Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液显酸性
C.
为获得尽可能纯的NaH2PO4应控制在4~5.5左右
D.
pH=13时,溶液中各微粒浓度大小关系为:
(4)298K时,在20.0mL0.20mol·L-1氨水中滴入0.20
mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
①为减小实验误差,由图可知滴定时指示剂应选用
(填“石蕊”、“酚酞”、“甲基橙”)
②N、M、P三点所示溶液导电能力最强的是
对应的溶液;M点对应离子浓度大小关系为
.
③25℃时,
N点c(OH-)为
.(2分)
武汉二中2016-2017学年度上学期期中考试
高二化学
答案
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
A
B
A
C
C
C
D
D
B
C
D
B
D
A
C
B
17.
(10分)
I.
(1)
(1分)
(2)MgO
(1分)
与水反应生成HCl,使水解平衡左移,可得到MgCl2
(1分)
II.
(1)负
(1分)
(1分)
减小(1分)
(2)0.4(1分)
(1分)
不变(1分)
(3)BD(1分)
18.
(9分)
I.
(1)V2O5+xe-+xLi+===LixV2O5(1分)
(2)LixC6-xe-===xLi++
C6(1分)
B(1分)
A(1分)
(3)LiMnO2-xe-===Li1-xMnO2+
xLi+(1分)
II.
(1)负(1分)
(1分)
(2)O2(1分)
NaOH(合理均可)
(1分)
19.
(8分)
(1)
(1分)
(2)90:11(1分)
(1分)
(3)碱(1分)
>(1分)
H++SO42-=HSO4-(1分)
(4)1:2
(1分)
(1分)
20.
(7分)
(1)250mL容量瓶(1分)
(2)(1分)
(3)(1分)
②C(1分)
(4)(1分)(5)(1分)
②AD(1分)
21.
(9分)
I.
i.
(1)(1分)
(2)B(1分)
(3)洗涤(1分)
干燥(1分)
ii.
(4)
(1分)
(5)0.51(1分)
II.
(1)阳极室(1分)
(2)防止Na2FeO4与H2反应使产率降低(1分)
(3)M点:C(OH-)低,Na2FeO4
( http: / / www.21cnjy.com )稳定性差,且反应慢。N点:C(OH-)过高,铁电极上有Fe(OH)3或Fe2O3生成,使Na2FeO4产率降低。(1分)
22.
(8分)
(1)②1.8×10-5(1分)
4.9×10-10(1分)
(2)NaHR(1分)
(3)D(1分)
(4)①甲基橙(1分)
②P(1分)
(1分)
③(2分)
高二化学试卷
考试时间:2016年11月10日上午10:30-12:00
试卷满分:100分
可能用到的相对原子质量:H:1
C:12
N:14
O:16
Cu:64
Fe:56
一、选择题(每小题均只有一个选项,共48分。)
1.
化学无处不在,下列与化学知识有关的说法不正确的是(
)
A.可用三氯化铝对自来水进行杀菌消毒
B.热的纯碱溶液可用于去油污
C.利用中和滴定原理可测定NaOH和NaCl混合液中NaCl的含量
D.用氯化铵浓溶液可除去铁器表面的铁锈
2.
化学与生产、生活密切相关,下列叙述中正确的是(
)
A.铜制品在潮湿空气中生锈,其主要原因是发生了析氢腐蚀.
B.铜的电解精炼工业中,沉积在电解槽底部的阳极泥可作为提炼金、银等贵重金属的原料
C.泡沫灭火器中所装试剂为Na2CO3和Al2(SO4)3
D.从海水中可以制取NaCl,电解饱和NaCl溶液可以制金属Na
3.
准确移取20.00mL草酸溶液于锥形瓶中,用0.1000
mol
·
L-1KOH溶液滴定。下列说法不正确的是(
)
A.
碱式滴定管用蒸馏水洗涤之后装入KOH标准溶液,并读数
B.
选择酚酞作指示剂,终点时溶液由无色刚好变成粉红色且半分钟不褪色
C.
锥形瓶中从滴定开始到滴定终点时,水电离的c(H+)由小逐渐增大
D.
滴定终点时,发现滴定管尖嘴处有气泡,则测定结果偏低
4.
用惰性电极电解下列物质的溶液,一段时间后,再加入一定质量的另一物质(括号内),溶液一定不能与原来溶液一样的是(
)
A.
CuCl2[CuCl2]
B.
AgNO3[Ag2O]
C.
NaCl[NaCl]
D.
CuSO4[Cu(OH)2]
5.
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是(
)
A.pH=4的HCl溶液中H2O电离出的c(H+)=10-4
mol.L-1
B.曲线I为CH3COOH溶液的稀释曲线
C.a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质
的量相等
D.a、b、c三点溶液中Kw:c=b
电解质溶液的电导率越大,导电能力越强。用0.1
mol·
L-1的NaOH溶液分别滴定体积均为10.00
mL浓度均为0.1
mol
·
L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是(
)
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05
mol.L-1
C.在相同温度下,A、B、C三点溶液中水电离的c(H+):B
7.
最近,科学家用氮化镓材料与铜组装如
( http: / / www.21cnjy.com )图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2。下列有关说法中正确的是(
)
A.该装置只有化学能转化为电能
B.氮化镓电极是阴极
C.导线中经过2
mol的电子,氮化镓电极生成1
molO2
D.铜电极表面的电极反应式:CO2+8e-+8H+===
CH4+2H2O
8.
常温下,下列有关溶液pH的相关说法正确的是(
)
A.将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13
mol
·
L-1
B.将pH=9的氢氧化钠溶液和pH=13的氢氧化钡溶液等体积混合,所得混合溶液的pH=11
C.将pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,由于氢氧化钡过量,所得溶液的pH>7
D.将pH=1的硫酸和pH=5的盐酸等体积混合,所得混合溶液的pH=1.3
9.
已知等浓度的HF和NaF的混合溶液呈酸性,溶液中存在以下平衡:①HFF-+H+;②F-+H2OHF+OH-。常温下,向c(HF)+c(NaF)=0.1
mol
·
L-1的溶液中分别加入以下物质,下列有关说法不正确的是(
)
A.加入少量Na2CO3固体,平衡①右移,平衡②左移,溶液中c(F-)增大
B.加入少量NaOH固体至c(F-)>c(HF),溶液一定呈碱性
C.加入少量Na至pH=8,则C(Na+)-c(F-)=0.99
×10-7mol·L-1
D.加入少量盐酸,不变
10.
有4种混合溶液,分别由等体积0.1的两种溶液混合而成:①NH4Cl与CH3COONa;②NH4Cl与HCl;③NH4Cl与NaCl;④NH4Cl与NH3·H2O(混合溶液呈碱性)。下列各项排序正确的是(
)
A.
pH:②<①<③<④
B.
溶液中c(H+):①<③<②<④
C.
c(NH4+)①<③<②<④
D.
c(NH3·H2O):①<③<④<②
11.
下列指定溶液中一定能大量共存的离子组是
(
)
A.,,,
B.含有大量的溶液中:
C.中性溶液中:
D.溶液中:
12.
一定温度下,将0.1molAgCl
( http: / / www.21cnjy.com )固体加入1L
0.1mol·L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是(
)
A、沉淀转化反应2AgCl(s)+
CO32-(aq)Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1
B、约有2×10-5mol
AgCl溶解
C、反应后溶液中的:c(Na+)>c
(CO32-)
>c
(Ag+)>c
(Cl-)
>c
(H+)
D、反应后溶液中的:c(Na+)+
c
(Ag+)+
c
(H+)=c
(CO32-)+
c
(HCO3-)+
c
(Cl-)
+c
(OH-)
13、已知25℃时,CaS
( http: / / www.21cnjy.com )O4在水中的沉淀溶解平衡曲线如图所示,向100
mL该条件下的CaSO4饱和溶液中加入400
mL
0.01
mol·L-1Na2SO4溶液,针对此过程的下列叙述正确的是( )
A、溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来的大
B、溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C、溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D、溶液中无沉淀析出,但最终溶液中c(SO42-)较原来的大
14.常温下,向20ml某浓度的硫酸溶液中滴入0.1mol·l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是(
)
A.
d点所示溶液中:c(NH4+)=2c(SO42-)
B.
c点所示溶液中:c(H+)-c(OH-)=2c(NH3·H2O)
C.
V=40
D.
NH3.H2O的电离常数K=10-4
15.
为二元弱酸,20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是(
)
A.pH=2.5的溶液中:
c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B.c(Na+)=0.100
mol
·
L-1的溶液中:
c(H+)+c(H2C2O4)=c(OH-)+(HC2O4-)
C.c(HC2O4-)=c(C2O42-)的溶液中:
c(Na+)<0.100
mol·L-1+c(HC2O4-)
D.pH=7.0的溶液中:c(Na+)<
2c(C2O42-)
16.
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如下图。下列有关说法正确的是(
)
A.
A为电源的负极
B.
电解结束后,阴极室溶液的pH与电解前相比将不变
C.
阳极室中发生的电极反应为
D.
若两极共收集到气体13.44
L(标准状况),则除去的尿素为18g(忽略气体的溶解)
二、非选择题(每空1分,注:22题最后一问2分,共52分。)
17、(10分)I.
SOCl2是一种
( http: / / www.21cnjy.com )液态化合物,沸点为77℃。向盛有10
mL水的锥形瓶中,小心滴加8~10滴SOC12,可观察到剧烈反应,液面上有雾形成,并有带刺激性气味的气体逸出,该气体中含有可使品红溶液褪色的SO2。轻轻振荡锥形瓶,待白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。
(1)根据实验现象,写出SOCl2与水反应的化学方程式
。
(2)蒸干灼烧MgCl2溶液得到固体物质是
,将SOCl2与MgCl2·6H2O混合并加热,可得到无水MgCl2,
其原因为
(结合化学用语回答)
II.
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4
mol电子时铁电极的质量减少11.2
g。请回答
下列问题。
(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极产物共
( http: / / www.21cnjy.com ) g,Cu电极的电极反应式是 ,CuSO4溶液的浓度
(填“减小”、“增大”或“不变”)
(3)把物质的量均为0.1mol的AlCl3
( http: / / www.21cnjy.com )、CuCl2和H2SO4溶于水制成100mL的混合溶液,用石墨作电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是(
)
A.
阳极得到的气体中有0.35mol
O2
B.
铝元素以Al(OH)3、Al3+的形式存在
C.
阴极质量增加3.2g
D.
电路中共转移0.9mol电子
18、(9分)I.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来。
已知:①甲品牌充电宝属于锂钒氧化物凝胶电池,其电池总反应为LixV2O5
②乙品牌充电宝工作原理如图所示,该电池的总反应式为Li1-xMnO2+LixC6LiMnO2+C6(LixC6表示锂原子嵌入石墨形成的复合材料):
请回答下列问题:
(1)甲品牌充电宝放电时,正极的电极反应式为
。
(2)图中K与N相接时,负极的电极反应式为
,
Li+由
区迁移到
区。
(填写“A”或“B”)
(3)图中K与M相接时,阳极的电极反应式为
。
II.
某兴趣小组用如图装置做了两次实验,不可思议地用原电池完成总反应:H++OH-=H2O
实验①:向甲池的Pt电极表面通氢气,发现电流计指针发生了偏转,乙池的Pt电极表面出现气泡。
实验②:向乙池的Pt电极表面通入另一气体,发现电流计指针也发生了偏转,且偏转方向与实验①相同,同时甲池的Pt电极表面也出现气泡。
( http: / / www.21cnjy.com )
(1)实验①,甲池通氢气的
( http: / / www.21cnjy.com )Pt电极为
极,电极反应式为__________________________________________。
(2)实验②中乙池中通入
( http: / / www.21cnjy.com )气体为______________,甲池电解质溶液为____________________________________________。
19、(8分)下表是不同温度下水的离子积常数:
温度/℃
25
90℃
100℃
水的离子积常数
3.8×10-13
试回答以下问题:
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=
(保留三位有效数字)。
(2)25℃时,将pH=11的苛性钠溶液与的稀硫酸混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
。此溶液中各种离子的浓度由大到小的顺序是
。
(3)假设H2SO4是强酸,但
( http: / / www.21cnjy.com )常温下0.1mol·L-1H2SO4的溶液中c(H+)=0.11mol·L-1,则Na2SO4溶液呈 性(填“酸”、“碱”或“中”),0.1mol·L-1的NaHSO4溶液的c(H+) 0.01mol·L-1(填“>”、“<”或“=”)
H2SO4溶液与Na2SO4溶液反应的离子方程式为
。
(4)25℃时pH=5的H2SO4溶液
( http: / / www.21cnjy.com )加水稀释到10倍,则稀释后c(SO)与c(H+)的比值为________________;加水稀释到100倍,则稀释后c(SO)与c(H+)的比值为__________________;
20、(7分)某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分
的含量。制备流程示意图如下。
( http: / / www.21cnjy.com )
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1
mol
·
L-1计算)如下表所示。
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0
mol·
( http: / / www.21cnjy.com )L-1稀硝酸250
mL。需要的玻璃仪器有烧杯、量筒、玻璃棒,胶头滴管和
。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为
。
(3)步骤(b)首先加入试剂x调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是
②试剂X可以是
(填标号)。
A.H2SO4
B.Ni(OH)2
C.NaOH
D.Fe2O3
E.NiO
(4)步骤(c)和(d)中的反应都需要在冰水浴环境下进行,其作用除了可以减少氨水的挥发.还有
。
(5)NH3含量的测定。[已知:Ni(NH3)6Cl2+6HCl=
NiCl2+6NH4Cl]
i.用电子天平称量mg产品于锥形瓶中,
用25mL水溶解后加入5
mL的6mol
·
L-1盐酸,以甲基橙作指示剂,滴定至终点消耗0.500
0
mol·L-1
NaOH标准溶液V1
mL。
ii.空白试验:不加入样品重复实验i。消耗NaOH标准溶液V2
mL。
①NH3的质量分数为
。
②在上述方案的基础上,下列措施中能进一步提高测定准确度的有
(填标号)。
A.适当提高称量产品的质量
B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙
D.进行平行试验
21、(9分)I.
水是重要的自然资源,与人类的发展密切相关。铁酸铜(CuFe2O4)是很有前景的热化学循环分解水制氢的材料
i.某课外小组制备铁酸铜(CuFe2O4)的流程如下:
( http: / / www.21cnjy.com )
搅拌I所得溶液中Fe(NO3)3、Cu(NO3)2的物质的量浓度分别为2.6
mol·L-l、1.3
mol·L-1。
(1)搅拌I所得溶液中Fe元素的存在形式有Fe3+和
(填化学式)。
(2)搅拌II要跟踪操作过程的pH变化。在滴加KOH溶液至pH=4的过程中(假设溶液体积不变),小组同学绘制了溶液中c(Fe3+)、c(Cu2+)随pH变化的曲线(如下图),其中正确的是
(用“A”“B”填空)。已知:Ksp[Fe(OH)3]=2.6x10-39、Ksp
[Cu(OH)2]=2.2x10-20。
(3)操作III为
、
。
ii.
在热化学循环分解水制氢的过程中,
( http: / / www.21cnjy.com )铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(4)氧缺位体与水反应制氢的化学方程式为
。
(5)课外小组将铁酸铜样品在N2的气
( http: / / www.21cnjy.com )氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=
。
II.
化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,
同时获得氢气:,工作原理如图1所示。装置通电后,铁电极附近生成紫红色,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:只在强碱性条件下稳定,易被H2还原。
(1)电解一段时间后,c(OH-)降低的区域在
(填“阴极室”或“阳极室”)
(2)电解过程中,须将阴极产生的气体及时排出,其原因为
.
(3)c(Na2FeO4)随初始c(N
( http: / / www.21cnjy.com )aOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:
22、(9分)(1)三种弱酸电离常数为1.8×,5.6×、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA+HB-(少量)===A-+H2B;
②H2B(少量)+C-===HB-+HC;③HA(少量)+C-==A-+HC。
若H2B的Ka1=4.3×10
( http: / / www.21cnjy.com )-7,则另两种酸对应的电离常数分别为(根据已知数据填空):HA的Ka=
,
HC的Ka=
(2)25℃时0.1
mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、
R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为
(填化学式)。
(3)常温下,H3PO4与NaOH溶液
( http: / / www.21cnjy.com )反应的体系中,含磷各物质的分布分数(平衡时某物质的浓度与各物质浓度之和的比值)与pH的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是(
)
( http: / / www.21cnjy.com )
A.
H3PO4的Ka3=10-12.2,
HPO42-的水解平衡常数为10-6.8
B.
Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液显酸性
C.
为获得尽可能纯的NaH2PO4应控制在4~5.5左右
D.
pH=13时,溶液中各微粒浓度大小关系为:
(4)298K时,在20.0mL0.20mol·L-1氨水中滴入0.20
mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
①为减小实验误差,由图可知滴定时指示剂应选用
(填“石蕊”、“酚酞”、“甲基橙”)
②N、M、P三点所示溶液导电能力最强的是
对应的溶液;M点对应离子浓度大小关系为
.
③25℃时,
N点c(OH-)为
.(2分)
武汉二中2016-2017学年度上学期期中考试
高二化学
答案
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
A
B
A
C
C
C
D
D
B
C
D
B
D
A
C
B
17.
(10分)
I.
(1)
(1分)
(2)MgO
(1分)
与水反应生成HCl,使水解平衡左移,可得到MgCl2
(1分)
II.
(1)负
(1分)
(1分)
减小(1分)
(2)0.4(1分)
(1分)
不变(1分)
(3)BD(1分)
18.
(9分)
I.
(1)V2O5+xe-+xLi+===LixV2O5(1分)
(2)LixC6-xe-===xLi++
C6(1分)
B(1分)
A(1分)
(3)LiMnO2-xe-===Li1-xMnO2+
xLi+(1分)
II.
(1)负(1分)
(1分)
(2)O2(1分)
NaOH(合理均可)
(1分)
19.
(8分)
(1)
(1分)
(2)90:11(1分)
(1分)
(3)碱(1分)
>(1分)
H++SO42-=HSO4-(1分)
(4)1:2
(1分)
(1分)
20.
(7分)
(1)250mL容量瓶(1分)
(2)(1分)
(3)(1分)
②C(1分)
(4)(1分)(5)(1分)
②AD(1分)
21.
(9分)
I.
i.
(1)(1分)
(2)B(1分)
(3)洗涤(1分)
干燥(1分)
ii.
(4)
(1分)
(5)0.51(1分)
II.
(1)阳极室(1分)
(2)防止Na2FeO4与H2反应使产率降低(1分)
(3)M点:C(OH-)低,Na2FeO4
( http: / / www.21cnjy.com )稳定性差,且反应慢。N点:C(OH-)过高,铁电极上有Fe(OH)3或Fe2O3生成,使Na2FeO4产率降低。(1分)
22.
(8分)
(1)②1.8×10-5(1分)
4.9×10-10(1分)
(2)NaHR(1分)
(3)D(1分)
(4)①甲基橙(1分)
②P(1分)
(1分)
③(2分)
同课章节目录
