课题3 元素 教学课件公开课教学课件 (共55张PPT)
文档属性
| 名称 | 课题3 元素 教学课件公开课教学课件 (共55张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-11-13 00:00:00 | ||
图片预览







文档简介
课件55张PPT。第三单元 物质构成的奥秘
课题3 元 素学习目标1、了解元素的概念
2、知道地壳中各元素的含量
3、知道元素的分类埃及的眼泪主要成分:碳酸钙(CaCO3)
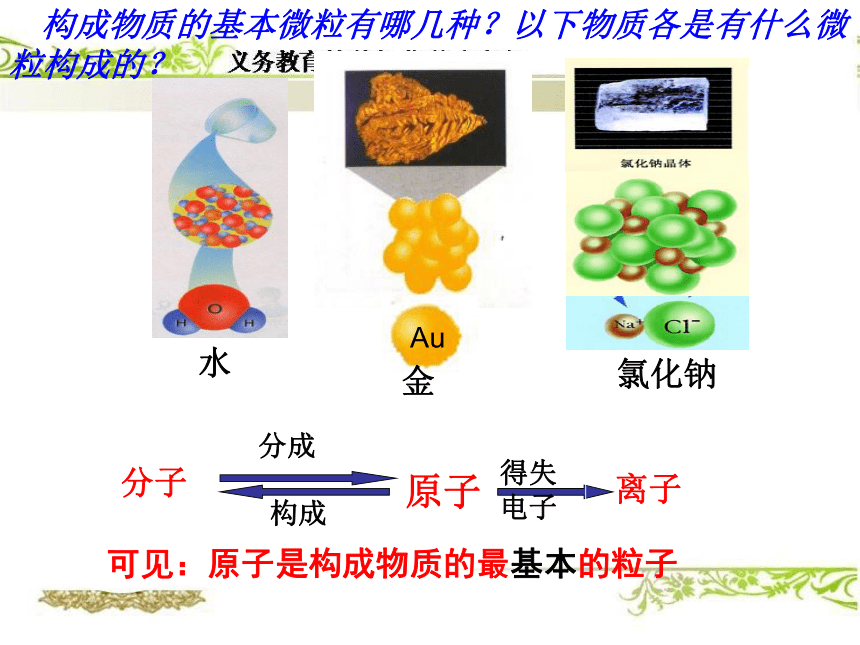
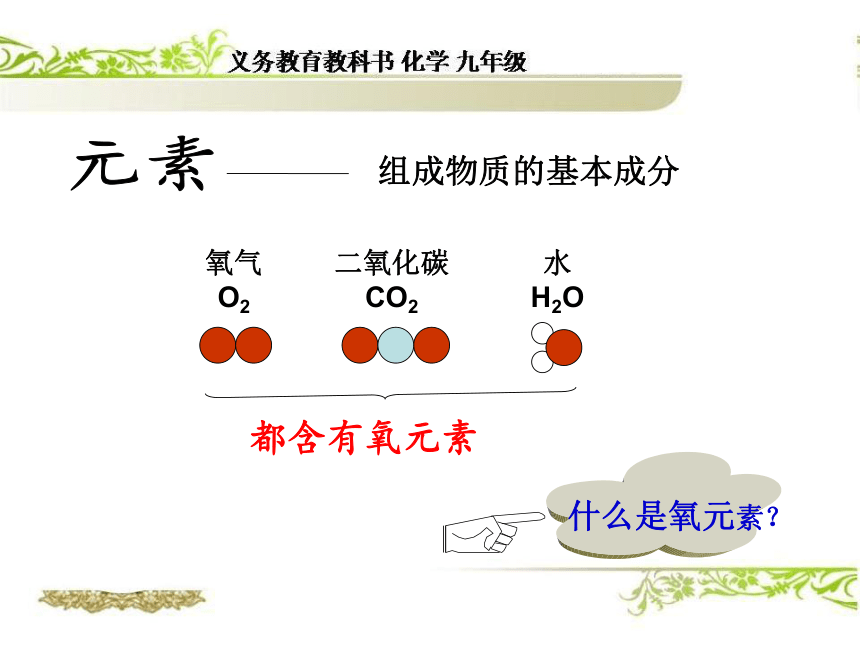
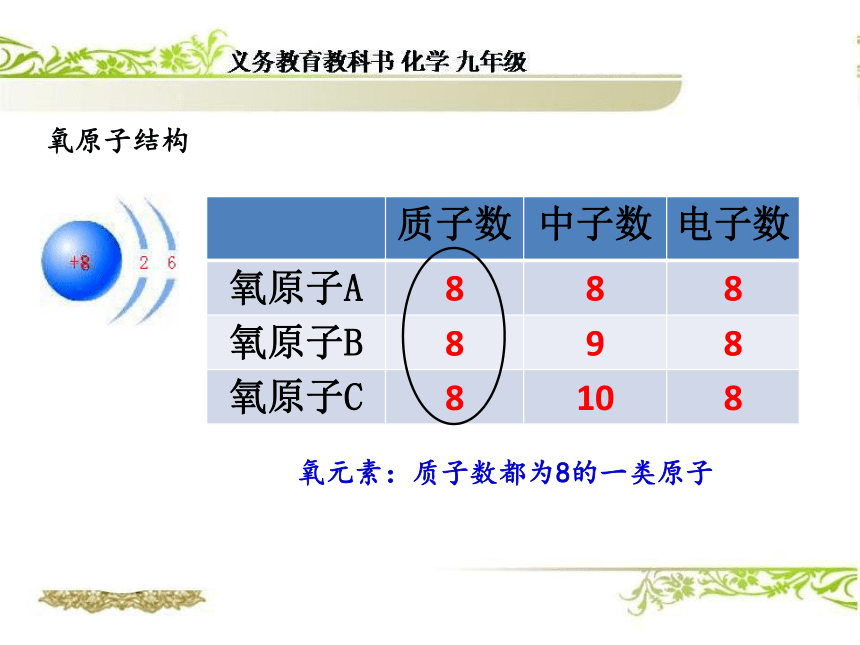
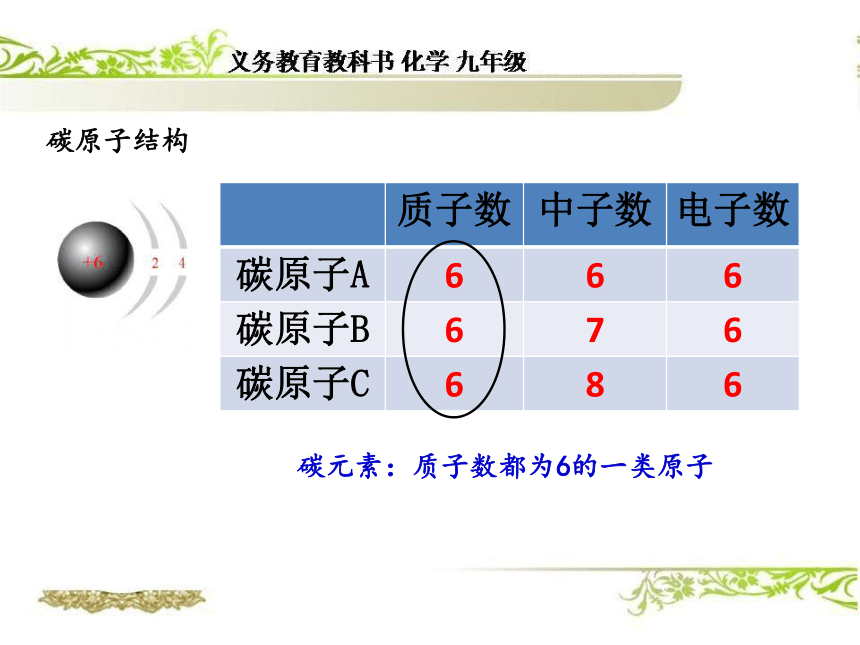
由钙元素、碳元素、氧元素组成 构成物质的基本微粒有哪几种?以下物质各是有什么微粒构成的?水 氯化钠分子原子离子可见:原子是构成物质的最基本的粒子元素组成物质的基本成分都含有氧元素什么是氧元素?氧原子结构氧元素:质子数都为8的一类原子碳原子结构碳元素:质子数都为6的一类原子元素就是具有相同(即核内质子数)的一类原子的总称。=核内质子数的一类原子的总称。核电荷数注意:1、质子数决定元素的种类。
质子数相同,是同种元素。质子数不同,是不同种元素。
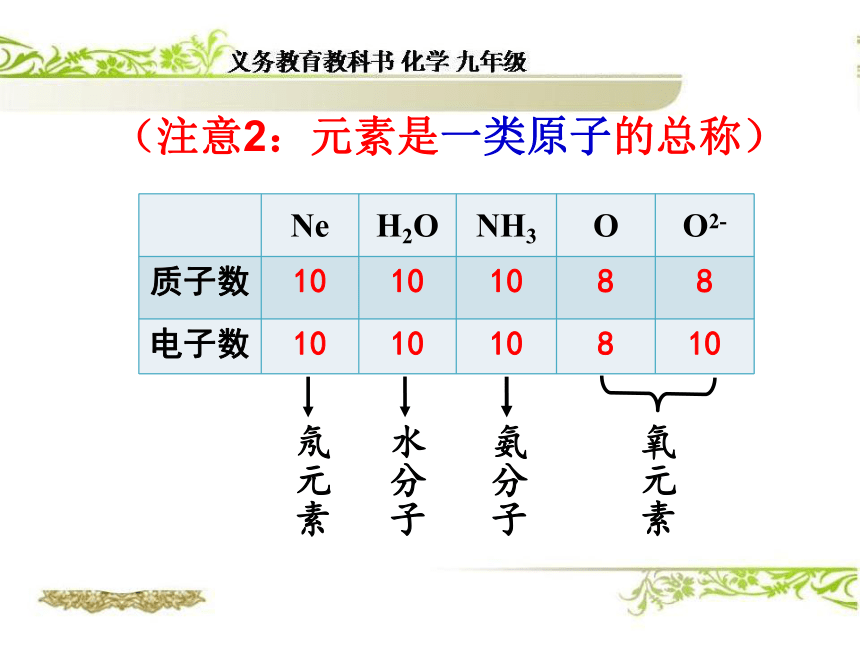
2、元素只讲种类,不讲个数.1、元素的定义元素——质子数(即核电荷数)相同的一类原子的总称。(注意1:元素的种类由质子数决定)质子数为1的所有氢原子统称为 氢元素质子数为6的所有碳原子统称为碳元素氧元素质子数为8的所有氧原子统称为(注意2:元素是一类原子的总称)氖元素水分子氨分子氧元素(注意3:元素是一类原子的总称)元素 是同一类原子的“总称”,是一个宏观概
念,因此元素只讲种类,不讲个数。例:KMnO4是由钾、锰、氧三种元素组成KMnO4是由一个钾元素、一个锰元素、四个氧元素组成氕原子氚原子氘原子1、判断下列图形是否属于同种元素氢元素 碳元素2、判断下表是哪一种元素3、判断下图是否属于同种元素OO2- 氧元素4.二氧化碳CO2是由 和 组成的,共有两 元素碳元素氧元素种 5、 判断正误:
(1)水是由一个氢元素和一个氧元素组成。
(2)水是由氢、氧两种元素的组成×√2、物质的组成和构成 (课本 P60) 原子离子分子、原子、离子组成元素与物质、微粒间的关系物质微粒物质的组成和构成二氧化碳是由碳元素和氧元素组成
二氧化碳分子是由碳原子和氧原子构成
一个二氧化碳分子是由1个碳原子和2个氧原子构成3、元素与原子的比较(1)宏观的概念(2)表示物质的 宏观组成(3)只讲种类,不讲个数(1)微观的概念(2)表示物质的微观构成(3)既讲种类,又讲个数水是由 和 组成的。水是由 构成
水分子是由 和 构成
一个水分子由 和 构成的铁是由 构成的。元素与原子的比较应用实例氢元素氧元素水分子氢原子氧原子铁原子1个氧原子2个氢原子1、CO2由氧、碳 元素组成
2、 CO2分子由氧、碳 原子构成。
一个CO2分子中共有 原子。3.铁是由 组成
4.铁是由 构成铁元素铁原子两种两种3个练一练练一练1.元素是具有 的一类 的总称。
2.二氧化碳是由 元素和 元素组成的。
3. 一个水分子是由 和 构成的。
4.决定元素种类的是( )
A.质子数 B.中子数 C.电子数 D.原子质量
5.据报道,目前世界上患有缺铁性贫血的人约有20亿之多。这里的“铁”是指( )
A.钢铁 B.铁元素
C.四氧化三铁 D.三氧化二铁
相同质子数原子碳氧1个氧原子 2个氢原子AB我们是金属元素!我们是非金属元素!我也是
金属元素元素的分类铜铁银钠镁铝钙钾锰锌钡铂……碳磷硫硅等溴氢氧氮氟氯等氦 氖 氩 氪……找偏旁的规律⑴ 金属元素:“钅”字旁(汞除外,俗称“水银”),⑵非金属元素:①(“石”字旁)固态②(“氵”字旁)液态③(“气”字头)气态⑶稀有气体元素:5、元素的分布5、元素的分布地壳中生物细胞中空气中海水中氮(N)、氧(O)氧(O)、碳(C)氢(H)、氮(N)氧(O)、硅(Si)铝(Al)、铁(Fe)氧(O)、氢(H)
氯(Cl)、钠(Na)(1)地壳中含量最多的元素?
(2)地壳中含量最多的金属元素?
(3)地壳中含量最多的非金属元素?
(4)空气中含量最多的元素?
(5)生物细胞中含量最多的元素?其次是?
(6)海水中含量最多的元素?回答下列问题:氧元素铝元素氧元素氮元素氧元素、碳元素氧元素记忆这些元素的名称和符号H、He、C、 N、 O、 F、Ne、Na、Mg、Al、
氢、氦、碳、氮、氧、氟、氖、钠、镁、 铝
Si、 P、 S、Cl、Ar、K、 Ca、Mn、Fe、Cu、
硅、磷、硫、氯、氩、钾、钙、锰、铁、铜
Zn、Ag、I、 Ba、Pt、Au、 Hg、 Pb、Sn
锌、 银、碘、钡、铂、金、 汞、 铅、 锡请你将下列元素进行分类:在化学变化中,分子破裂,原子(或离子)重新组合思考:1、在化学反应前后分子是否发生了变化。
2、在化学反应前后,元素种类有没有改变?
在化学反应前后,原子种类有没有发生改变? 在化学反应前后,原子种类没有发生改变分子变了元素种类没有变了课题2 元素 第二课时 元素符号学习目标
1、了解元素符号所表示的意义
2、学会元素符号的正确写法
3、记忆常见的元素符号
4、初步认识元素周期表一、元素符号(拉丁文名称)1、元素符号的书写(1)由一个字母表示的元素符号要大写。
(2)由两个字母表示的元素符号第一个字母要大写,第二个字母要小写。(一大二小)N O P S
氮 氧 磷 硫 Ne Na Mg
氖 钠 镁 ClCMgSiMn找茬铜CU 锌ZN 银AG 锰mN 钙cA Cu Zn Ag Mn Ca铁FE 硅si 钠Na 铝AL 铁Fe 硅Si 钠Na 铝Al 氧元素2、元素符号的含义O通常有两种含义你们说的都对某元素某元素的一个原子H表示氢元素表示一个氢原子2H?H2?2H—表示2个氢原子H2—表示1个氢分子部分元素符号有三个意义:②一个铁原子①铁元素FeC③铁这种物质①碳元素②一个碳原子③碳这种物质Ne表示氖元素表示一个氖原子表示稀有气体氖 金属元素、固态非金属元素、稀有气体元素知识应用:1. “H”表示的意义有哪些?宏观:表示氢元素
微观:一个氢原子2. “3H”表示的意义有哪些?微观:3个氢原子
(有系数所以只表示微观意义)3、几个原子的表示方法书写时在元素符号的前面加上相应的数字。
如 2O :表示2个氧原子
2N:表示2个氮 原子氮元素,1个氮原子2 O3个碳原子2 H 表示2个氢原子 n Mg我们是金属元素!我们是非金属元素!我也是
金属元素元素的分类铜铁银钠镁铝钙钾锰锌钡铂……碳磷硫硅等溴氢氧氮氟氯等氦 氖 氩 氪……找偏旁的规律⑴ 金属元素:“钅”字旁(汞除外,俗称“水银”),⑵非金属元素:①(“石”字旁)固态②(“氵”字旁)液态③(“气”字头)气态⑶稀有气体元素:记忆这些元素的名称和符号H、He、C、 N、 O、 F、Ne、Na、Mg、Al、
氢、氦、碳、氮、氧、氟、氖、钠、镁、 铝
Si、 P、 S、Cl、Ar、K、 Ca、Mn、Fe、Cu、
硅、磷、硫、氯、氩、钾、钙、锰、铁、铜
Zn、Ag、I、 Ba、Pt、Au、 Hg、 Pb、Sn
锌、 银、碘、钡、铂、金、 汞、 铅、 锡请你将下列元素进行分类:门捷列夫的元素周期表 1865年,英国化学家纽兰兹把当时已知的元素按原子量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一个元素的性质相近。 当年,纽兰兹在英国化学学会上受到了嘲弄,主持人以不无讥讽的口吻问道:“你为什么不按元素的字母顺序排列?”
门捷列夫顾不了这么多,他以惊人的洞察力投入了艰苦的探索。直到1869年,他将当时已知的仍种元素的主要性质和原子量,写在一张张小卡片上,进行反复排列比较,才最后发现了元素周期规律,并依此制定了元素周期表。1
2
3
4
5
6
7
周期族特殊:三个竖行为一个族非金属元素稀
有
气
体
元
素汞(Hg)是金属,常温下为液态元素周期表1.元素周期表上分两大区域2.横行——周期3.纵行——族7个横行就是7个周期18个纵行16个族金属和非金属氧元素在元素周期表中的分析O氧8 16.00原子序数元素符号元素名称相对原子质量核电荷数质子数===核外电子数≈质子数+中子数课堂练习1、二氧化碳是由( )
A 碳元素和氧元素组成
B 碳原子和氧原子构成
C 碳和氧气两种单质组成
D 以上说法都不正确A标签上的Ca、Fe、Zn是指:
A 单质 B 元素
C 分子 D 原子B3、不同元素之间本质的区别 ( )
A、 电子数不同
B、 核内质子数不同
C、 核内中子数不同
D、 相对原子质量不同
B4、元素是具有( )的一类原子的总称。
A.相同中子数 B.相同质量
C.相同电子数 D.相同核电荷数
5、地壳中含量最多的金属元素是
( ) 。
A.氧 B.铝 C.铁 D.硅
BD
6、“2H”表示的意义是 ( )
A.两个氢原子 B.两个氢元素
C.两个氢分子 D.氢元素A7、地壳中含量最多的元素是( ),含量最多的金属元素是( )。
8、写出下列元素的元素符号
氧( )铁( )铜( )
镁( )铝( )氯( )
氩( )汞( )钙( )
银( )硅( )硫( )OAlFeCuMgAlClArHgCaAgSiSO ——门捷列夫
什么是天才?终身努力,便成天才!谢谢!
课题3 元 素学习目标1、了解元素的概念
2、知道地壳中各元素的含量
3、知道元素的分类埃及的眼泪主要成分:碳酸钙(CaCO3)
由钙元素、碳元素、氧元素组成 构成物质的基本微粒有哪几种?以下物质各是有什么微粒构成的?水 氯化钠分子原子离子可见:原子是构成物质的最基本的粒子元素组成物质的基本成分都含有氧元素什么是氧元素?氧原子结构氧元素:质子数都为8的一类原子碳原子结构碳元素:质子数都为6的一类原子元素就是具有相同(即核内质子数)的一类原子的总称。=核内质子数的一类原子的总称。核电荷数注意:1、质子数决定元素的种类。
质子数相同,是同种元素。质子数不同,是不同种元素。
2、元素只讲种类,不讲个数.1、元素的定义元素——质子数(即核电荷数)相同的一类原子的总称。(注意1:元素的种类由质子数决定)质子数为1的所有氢原子统称为 氢元素质子数为6的所有碳原子统称为碳元素氧元素质子数为8的所有氧原子统称为(注意2:元素是一类原子的总称)氖元素水分子氨分子氧元素(注意3:元素是一类原子的总称)元素 是同一类原子的“总称”,是一个宏观概
念,因此元素只讲种类,不讲个数。例:KMnO4是由钾、锰、氧三种元素组成KMnO4是由一个钾元素、一个锰元素、四个氧元素组成氕原子氚原子氘原子1、判断下列图形是否属于同种元素氢元素 碳元素2、判断下表是哪一种元素3、判断下图是否属于同种元素OO2- 氧元素4.二氧化碳CO2是由 和 组成的,共有两 元素碳元素氧元素种 5、 判断正误:
(1)水是由一个氢元素和一个氧元素组成。
(2)水是由氢、氧两种元素的组成×√2、物质的组成和构成 (课本 P60) 原子离子分子、原子、离子组成元素与物质、微粒间的关系物质微粒物质的组成和构成二氧化碳是由碳元素和氧元素组成
二氧化碳分子是由碳原子和氧原子构成
一个二氧化碳分子是由1个碳原子和2个氧原子构成3、元素与原子的比较(1)宏观的概念(2)表示物质的 宏观组成(3)只讲种类,不讲个数(1)微观的概念(2)表示物质的微观构成(3)既讲种类,又讲个数水是由 和 组成的。水是由 构成
水分子是由 和 构成
一个水分子由 和 构成的铁是由 构成的。元素与原子的比较应用实例氢元素氧元素水分子氢原子氧原子铁原子1个氧原子2个氢原子1、CO2由氧、碳 元素组成
2、 CO2分子由氧、碳 原子构成。
一个CO2分子中共有 原子。3.铁是由 组成
4.铁是由 构成铁元素铁原子两种两种3个练一练练一练1.元素是具有 的一类 的总称。
2.二氧化碳是由 元素和 元素组成的。
3. 一个水分子是由 和 构成的。
4.决定元素种类的是( )
A.质子数 B.中子数 C.电子数 D.原子质量
5.据报道,目前世界上患有缺铁性贫血的人约有20亿之多。这里的“铁”是指( )
A.钢铁 B.铁元素
C.四氧化三铁 D.三氧化二铁
相同质子数原子碳氧1个氧原子 2个氢原子AB我们是金属元素!我们是非金属元素!我也是
金属元素元素的分类铜铁银钠镁铝钙钾锰锌钡铂……碳磷硫硅等溴氢氧氮氟氯等氦 氖 氩 氪……找偏旁的规律⑴ 金属元素:“钅”字旁(汞除外,俗称“水银”),⑵非金属元素:①(“石”字旁)固态②(“氵”字旁)液态③(“气”字头)气态⑶稀有气体元素:5、元素的分布5、元素的分布地壳中生物细胞中空气中海水中氮(N)、氧(O)氧(O)、碳(C)氢(H)、氮(N)氧(O)、硅(Si)铝(Al)、铁(Fe)氧(O)、氢(H)
氯(Cl)、钠(Na)(1)地壳中含量最多的元素?
(2)地壳中含量最多的金属元素?
(3)地壳中含量最多的非金属元素?
(4)空气中含量最多的元素?
(5)生物细胞中含量最多的元素?其次是?
(6)海水中含量最多的元素?回答下列问题:氧元素铝元素氧元素氮元素氧元素、碳元素氧元素记忆这些元素的名称和符号H、He、C、 N、 O、 F、Ne、Na、Mg、Al、
氢、氦、碳、氮、氧、氟、氖、钠、镁、 铝
Si、 P、 S、Cl、Ar、K、 Ca、Mn、Fe、Cu、
硅、磷、硫、氯、氩、钾、钙、锰、铁、铜
Zn、Ag、I、 Ba、Pt、Au、 Hg、 Pb、Sn
锌、 银、碘、钡、铂、金、 汞、 铅、 锡请你将下列元素进行分类:在化学变化中,分子破裂,原子(或离子)重新组合思考:1、在化学反应前后分子是否发生了变化。
2、在化学反应前后,元素种类有没有改变?
在化学反应前后,原子种类有没有发生改变? 在化学反应前后,原子种类没有发生改变分子变了元素种类没有变了课题2 元素 第二课时 元素符号学习目标
1、了解元素符号所表示的意义
2、学会元素符号的正确写法
3、记忆常见的元素符号
4、初步认识元素周期表一、元素符号(拉丁文名称)1、元素符号的书写(1)由一个字母表示的元素符号要大写。
(2)由两个字母表示的元素符号第一个字母要大写,第二个字母要小写。(一大二小)N O P S
氮 氧 磷 硫 Ne Na Mg
氖 钠 镁 ClCMgSiMn找茬铜CU 锌ZN 银AG 锰mN 钙cA Cu Zn Ag Mn Ca铁FE 硅si 钠Na 铝AL 铁Fe 硅Si 钠Na 铝Al 氧元素2、元素符号的含义O通常有两种含义你们说的都对某元素某元素的一个原子H表示氢元素表示一个氢原子2H?H2?2H—表示2个氢原子H2—表示1个氢分子部分元素符号有三个意义:②一个铁原子①铁元素FeC③铁这种物质①碳元素②一个碳原子③碳这种物质Ne表示氖元素表示一个氖原子表示稀有气体氖 金属元素、固态非金属元素、稀有气体元素知识应用:1. “H”表示的意义有哪些?宏观:表示氢元素
微观:一个氢原子2. “3H”表示的意义有哪些?微观:3个氢原子
(有系数所以只表示微观意义)3、几个原子的表示方法书写时在元素符号的前面加上相应的数字。
如 2O :表示2个氧原子
2N:表示2个氮 原子氮元素,1个氮原子2 O3个碳原子2 H 表示2个氢原子 n Mg我们是金属元素!我们是非金属元素!我也是
金属元素元素的分类铜铁银钠镁铝钙钾锰锌钡铂……碳磷硫硅等溴氢氧氮氟氯等氦 氖 氩 氪……找偏旁的规律⑴ 金属元素:“钅”字旁(汞除外,俗称“水银”),⑵非金属元素:①(“石”字旁)固态②(“氵”字旁)液态③(“气”字头)气态⑶稀有气体元素:记忆这些元素的名称和符号H、He、C、 N、 O、 F、Ne、Na、Mg、Al、
氢、氦、碳、氮、氧、氟、氖、钠、镁、 铝
Si、 P、 S、Cl、Ar、K、 Ca、Mn、Fe、Cu、
硅、磷、硫、氯、氩、钾、钙、锰、铁、铜
Zn、Ag、I、 Ba、Pt、Au、 Hg、 Pb、Sn
锌、 银、碘、钡、铂、金、 汞、 铅、 锡请你将下列元素进行分类:门捷列夫的元素周期表 1865年,英国化学家纽兰兹把当时已知的元素按原子量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一个元素的性质相近。 当年,纽兰兹在英国化学学会上受到了嘲弄,主持人以不无讥讽的口吻问道:“你为什么不按元素的字母顺序排列?”
门捷列夫顾不了这么多,他以惊人的洞察力投入了艰苦的探索。直到1869年,他将当时已知的仍种元素的主要性质和原子量,写在一张张小卡片上,进行反复排列比较,才最后发现了元素周期规律,并依此制定了元素周期表。1
2
3
4
5
6
7
周期族特殊:三个竖行为一个族非金属元素稀
有
气
体
元
素汞(Hg)是金属,常温下为液态元素周期表1.元素周期表上分两大区域2.横行——周期3.纵行——族7个横行就是7个周期18个纵行16个族金属和非金属氧元素在元素周期表中的分析O氧8 16.00原子序数元素符号元素名称相对原子质量核电荷数质子数===核外电子数≈质子数+中子数课堂练习1、二氧化碳是由( )
A 碳元素和氧元素组成
B 碳原子和氧原子构成
C 碳和氧气两种单质组成
D 以上说法都不正确A标签上的Ca、Fe、Zn是指:
A 单质 B 元素
C 分子 D 原子B3、不同元素之间本质的区别 ( )
A、 电子数不同
B、 核内质子数不同
C、 核内中子数不同
D、 相对原子质量不同
B4、元素是具有( )的一类原子的总称。
A.相同中子数 B.相同质量
C.相同电子数 D.相同核电荷数
5、地壳中含量最多的金属元素是
( ) 。
A.氧 B.铝 C.铁 D.硅
BD
6、“2H”表示的意义是 ( )
A.两个氢原子 B.两个氢元素
C.两个氢分子 D.氢元素A7、地壳中含量最多的元素是( ),含量最多的金属元素是( )。
8、写出下列元素的元素符号
氧( )铁( )铜( )
镁( )铝( )氯( )
氩( )汞( )钙( )
银( )硅( )硫( )OAlFeCuMgAlClArHgCaAgSiSO ——门捷列夫
什么是天才?终身努力,便成天才!谢谢!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
