人教版高一化学必修一第二章第二节 离子反应第一课时课件 (共17张PPT)
文档属性
| 名称 | 人教版高一化学必修一第二章第二节 离子反应第一课时课件 (共17张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 645.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-11-23 15:38:20 | ||
图片预览






文档简介
课件17张PPT。第二节 离子反应学.科.网zxxkw【学生练习】1、下列物质中哪些能导电?为什么能电?
石墨、 Cu、
盐酸、NaOH溶液、K2SO4溶液、 NaCl溶液
NaCl固体、
蔗糖溶液、酒精溶液。【分析】 ①石墨、铜能导电,是因为其中有自由移动的电子存在。
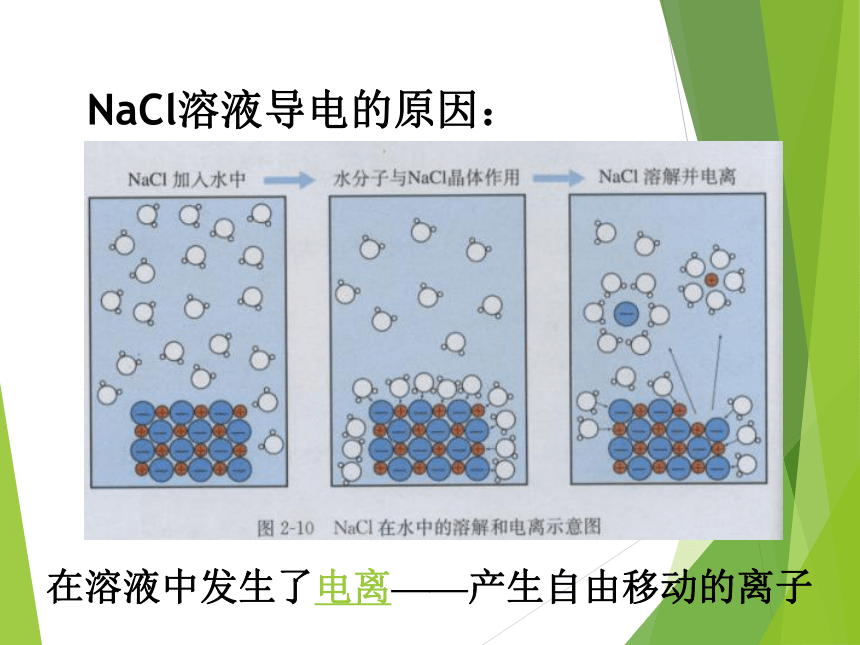
②盐酸、NaOH溶液、K2SO4溶、NaCl溶液能导电,是因为它们的溶液中有自由移动的离子存在。 在溶液中发生了电离——产生自由移动的离子NaCl溶液导电的原因:一、酸、碱、盐在水溶液中的电离1、电离
酸、碱、盐导电的条件:水溶液或熔融状态2、电解质
在水溶液里或熔融状态下能够导电
的化合物,如酸、碱、盐等。注意事项:电解质一定为化合物;
酸、碱、大部分的盐、水均为电解质。zxxkw一、酸、碱、盐在水溶液中的电离3、电离方程式
NaCl = Na+ + Cl―
练习答案:
HClHNO3H2SO4= H++ Cl-= H++NO3-= 2H++SO42-请观察上述方程式,总结规律。电离时生成的阳离子全部是H+ 的化合物叫酸学.科.网3、 请写出NaOH、Ba(OH)2的电离方程式。4、请写出Na2SO4、NH4Cl的电离方程式。【学生练习】3、 请写出NaOH、Ba(OH)2的电离方程式。
?
NaOH=
?
Ba(OH)2 =
?Na+ + OH-Ba2+ + 2OH-
4、请写出Na2SO4、NH4Cl的电离方程式。
?
Na2SO4=
NH4Cl=2Na+ + SO42-NH4+ + Cl-zxxkw 电离时生成的阴离子全部是OH- 的化合物叫碱 电离时生成的阳离子全是金属离子,阴离子全是酸根离子 的化合物叫盐思考与交流:学.科.网注意事项:1、 HCO3-、OH-、SO42-等原子团不能拆开;
2、离子或原子团的个数做系数、所带电荷数和电性要正确表示。
二、离子反应1、离子反应:有离子参加的反应。
[实验2-1]zxxkw二、离子反应1、离子反应:有离子参加的反应。
2、离子方程式:用实际参与反应的
离子符号来表示离子间反应的过程。3、离子方程式的书写:
“写、拆、删、查”四个步骤 学.科.网①写:化学方程式;
②拆:强酸、强碱和可溶性盐; ③删:相同的离子;④查:计量数比、电荷数、质量数。注意事项:查: 例:判断下列离子方程式是否配平 Cu+Ag+=Cu2++Ag Fe3++Fe=2Fe2+1.要看质量守恒
2.要看电荷是否守恒结论:3.必须符合反应事实判断是否正确:2Fe + 6H+ ==2Fe3+ + 3H2↑学生练习:6、完成下列化学反应方程式,并改写为离子方程式:
1)NaOH+H2SO4—— ;
离子方程式: ;
2)CaCO3+HCl—— ;
离子方程式: ;
石墨、 Cu、
盐酸、NaOH溶液、K2SO4溶液、 NaCl溶液
NaCl固体、
蔗糖溶液、酒精溶液。【分析】 ①石墨、铜能导电,是因为其中有自由移动的电子存在。
②盐酸、NaOH溶液、K2SO4溶、NaCl溶液能导电,是因为它们的溶液中有自由移动的离子存在。 在溶液中发生了电离——产生自由移动的离子NaCl溶液导电的原因:一、酸、碱、盐在水溶液中的电离1、电离
酸、碱、盐导电的条件:水溶液或熔融状态2、电解质
在水溶液里或熔融状态下能够导电
的化合物,如酸、碱、盐等。注意事项:电解质一定为化合物;
酸、碱、大部分的盐、水均为电解质。zxxkw一、酸、碱、盐在水溶液中的电离3、电离方程式
NaCl = Na+ + Cl―
练习答案:
HClHNO3H2SO4= H++ Cl-= H++NO3-= 2H++SO42-请观察上述方程式,总结规律。电离时生成的阳离子全部是H+ 的化合物叫酸学.科.网3、 请写出NaOH、Ba(OH)2的电离方程式。4、请写出Na2SO4、NH4Cl的电离方程式。【学生练习】3、 请写出NaOH、Ba(OH)2的电离方程式。
?
NaOH=
?
Ba(OH)2 =
?Na+ + OH-Ba2+ + 2OH-
4、请写出Na2SO4、NH4Cl的电离方程式。
?
Na2SO4=
NH4Cl=2Na+ + SO42-NH4+ + Cl-zxxkw 电离时生成的阴离子全部是OH- 的化合物叫碱 电离时生成的阳离子全是金属离子,阴离子全是酸根离子 的化合物叫盐思考与交流:学.科.网注意事项:1、 HCO3-、OH-、SO42-等原子团不能拆开;
2、离子或原子团的个数做系数、所带电荷数和电性要正确表示。
二、离子反应1、离子反应:有离子参加的反应。
[实验2-1]zxxkw二、离子反应1、离子反应:有离子参加的反应。
2、离子方程式:用实际参与反应的
离子符号来表示离子间反应的过程。3、离子方程式的书写:
“写、拆、删、查”四个步骤 学.科.网①写:化学方程式;
②拆:强酸、强碱和可溶性盐; ③删:相同的离子;④查:计量数比、电荷数、质量数。注意事项:查: 例:判断下列离子方程式是否配平 Cu+Ag+=Cu2++Ag Fe3++Fe=2Fe2+1.要看质量守恒
2.要看电荷是否守恒结论:3.必须符合反应事实判断是否正确:2Fe + 6H+ ==2Fe3+ + 3H2↑学生练习:6、完成下列化学反应方程式,并改写为离子方程式:
1)NaOH+H2SO4—— ;
离子方程式: ;
2)CaCO3+HCl—— ;
离子方程式: ;
